Innovative Therapiekonzepte myeloischer Neoplasien
Autoren:
Dr. Leo Edlinger
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin
LKH-Univ. Klinikum Graz
E-Mail: leo.edlinger@medunigraz.at
Univ.-Prof. Dr. Philipp Jost
Leiter der Klinischen Abteilung für Onkologie
Universitätsklinik für Innere Medizin
LKH-Univ. Klinikum Graz
E-Mail: philipp.jost@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Trotz rezenter Therapiefortschritte ist die akute myeloische Leukämie (AML) noch immer mit einer schlechten Prognose assoziiert – dies gilt vor allem für Hochrisikopatient*innen, die für eine intensive Chemotherapie ungeeignet sind. Wir stellen hier die aktuellsten Ergebnisse innovativer Therapiekonzepte der AML vor, welche potenziell zu einer Prognoseverbesserung beitragen können.
Keypoints
-
Der Menin-MLL1-Inhibitor Revumenib zeigt klinische Aktivität in der akuten Leukämie mit KMT2A-Rearrangement oder NPM1-Mutation.
-
Mit dem LSD1-Inhibitor Iadademstat wird ein neuer epigenetischer Therapieansatz verfolgt.
-
Magrolimab ist ein gegen CD47 gerichteter Makrophagen-Checkpoint-Inhibitor.
-
UniCAR-T-Zellen ermöglichen eine präzise Therapie- und Nebenwirkungssteuerung.
-
Eprenetapopt wurde initial als TP53-Reaktivator beschrieben, mittlerweile geht man aber davon aus, dass die Ferroptose-Induktion den eigentlichen Wirkmechanismus darstellt.
In der Gruppe der Hochrisikopatient*innen mit akuter myeloischer Leukämie (AML), die für eine intensive Chemotherapie ungeeignet sind, konnten hypomethylierende Substanzen (HMA) die Prognose verbessern.
So konnten HMA (Azacitidin, Decitabin) in Phase-III-Studien bei älteren Patient*innen (≥65 Jahre) mit De-novo-AML ein medianes Gesamtüberleben (mOS) von 12,1 Monaten (Azacitidin) vs. 6,9 Monate (Standard-Induktionschemotherapie, niedrig dosiertes Cytarabin oder supportive Therapie) bzw. von 7,7 Monaten (Decitabin) vs. 5,0 Monate (niedrig dosiertes Cytarabin oder supportive Therapie) erreichen.1,2
Der selektive BCL-2-Inhibitor Venetoclax (ABT-199) führt zur Apoptose von Stamm- und Progenitorzellen bei Hochrisiko-MDS/sAML (myelodysplastisches Syndrom/sekundäre AML) und erzielte in Kombination mit Azacitidin in der Phase-III-Studie VIALE-A bei De-novo-AML-Patient*innen, die für eine intensive Chemotherapie ungeeignet waren, ein medianes Gesamtüberleben (mOS) von 14,7 Monaten (Venetoclax + Azacitidin) vs. 9,6 Monate (Placebo + Azacitidin) und eine CR+CRi(komplette Remission und komplette Remission mit unvollständiger hämatologischer Erholung)-Rate von 66,4% (Venetoclax + Azacitidin) vs. 28,3% (Placebo + Azacitidin).3,4
Hierauf aufbauend sollen im Folgenden neue Therapieansätze vorgestellt werden.
Menin-MLL1-Inhibition: Revumenib
MLL/KMT2A-Rearrangements kommen in 10% aller akuten Leukämien (AML, ALL – akute lymphatische Leukämie, MPAL – akute Leukämie mit gemischtem Phänotyp) vor und sind durch eine Translokation des Gens „Mixed Lineage Leukemia 1“ (MLL, MLL1, alternative Bezeichnung: „Lysine[K]-specific Methyltransferase 2A“ [KMT2A]) auf Chromosom 11q23 mit einem von über 80 Fusionspartnern gekennzeichnet.5
Das dadurch entstehende Fusionsprotein interagiert mit Chromatin-assoziierten Proteinkomplexen, die u.a. aus den für die Leukämogenese kritischen Proteinen Menin, „Disruptor Of Telomeric Silencing 1-Like“ (DOT1L – eine für die Methylierung bestimmter Histon-Lysinresiduen verantwortliche Methyltransferase) und Proteinen des „Super Elongation Complex“ (SEC) bestehen.6,7
Neben der Methyltransferaseaktivität von DOT1L ist auch die Interaktion zwischen Menin und dem MLL-Fusionsprotein essenziell für die Expression von MLL-Targetgenen.8 Die Hemmung der genannten Interaktion ist ein neuer Therapieansatz für Leukämien mit KMT2A-Rearrangement, der in laborexperimentellen Studien auch in der AML mit NPM1-Mutation (in 30% der AML-Fälle vorkommend) wirksam ist.9–13
Die daraufhin initiierte Phase-I/II-Studie AUGMENT-101 untersuchte die klinische Aktivität des Menin-MLL1-Inhibitors Revumenib (SNDX-5613) als orale Monotherapie bei der rezidivierten/refraktären akuten Leukämie (82% AML, 16% ALL, 2% MPAL) mit KMT2A-Rearrangement (68%) oder NPM1-Mutation (21%).14 Die Patient*innen waren im Median mit vier Linien vortherapiert, 46% wurden bereits stammzelltransplantiert und 60% hatten eine Vortherapie mit Venetoclax.
Die dosislimitierende Toxizität ergab sich durch asymptomatische QTc-Verlängerungen (Grad 3) bei 13% der Patient*innen, während QTc-Verlängerungen (≥Grad 1) insgesamt in 53% der Fälle auftraten. Ein Differenzierungssyndrom (bei allen Grad 2) konnte bei 16% aller Patient*innen beobachtet werden. Es war jedoch mit Steroid und/oder Hydroxyurea gut kontrollierbar.
Revumenib führte bei AML-Patient*innen mit KMT2A-Rearrangement oder NPM1-Mutation zu einem mOS von 7,0 Monaten und einer Gesamtansprechrate (ORR) von 53% und zeigte somit bei geringen Nebenwirkungen eine überzeugende klinische Wirksamkeit.
LSD1-Inhibition: Iadademstat
Die „Lysine-specific Histone Demethylase 1A“ (LSD1) ist für die Demethylierung bestimmter Histon-Lysinresiduen verantwortlich und reguliert damit auf epigenetische Weise die Transkription.15,16 Zusätzlich bildet LSD1 gemeinsam mit „Co-Repressor Element-1 Silencing Transcription Factor“ (CoREST) und dem Transkriptionsfaktor „Growth Factor Independent 1“ (GFI-1) einen Transkriptionsrepressorkomplex, der eine wichtige Rolle in der Hämatopoese und der Pathogenese des MDS und der AML spielt.17
LSD1 wird in hämatopoetischen Stammzellen und Myeloblasten stark exprimiert und ist für die Proliferation und terminale Differenzierung im Rahmen der Hämatopoese erforderlich.18 In soliden und hämatologischen Neoplasien wird LSD1 überexprimiert.19 So konnte in einer AML-Fallserie eine erhöhte LSD1-Expression in ca. 60% der Fälle beobachtet werden.20 Im AML-Mausmodell mit einer MLL-AF9-Translokation fördert LSD1 auf DNA-Ebene das durch MLL-AF9 induzierte leukämogene Expressionsprogramm und hemmt somit Differenzierung und Apoptose leukämischer Stammzellen.21
Die Inhibition von LSD1 in primären humanen AML-Zellen mit MLL-AF9-Translokation hemmt die Koloniebildung und fördert die Differenzierung in dosisabhängiger Weise.21 Darüber hinaus wurden AML-Zelllinien mit anderen Translokationen ebenfalls durch LSD1-Inhibition in ihrem Wachstum gehemmt.22 Dies führte zur Entwicklung von Iadademstat (ORY-1001), das durch kovalente und irreversible Bindung selektiv LSD1 inhibiert, eine Interaktion zwischen LSD1 und GFI-1 verhindert, die Expression myeloischer Differenzierungsmarker in AML-Zelllinien induziert und das Wachstum primärer humaner AML-Zellen hemmt.23
In einer Phase-I-Dosisfindungsstudie zeigte die orale Monotherapie mit Iadademstat bei Patient*innen mit rezidivierter/refraktärer AML, die für eine Standardtherapie ungeeignet waren, eine gute klinische und biologische Aktivität mit Reduktion und Differenzierung von Blasten im peripheren Blut und im Knochenmark. Das traf vor allem auf Patient*innen mit KMT2A-Translokation zu.24
Die Kombination aus Iadademstat und Azacitidin zeigte als Erstlinientherapie bei AML-Patient*innen, die ungeeignet für eine intensive Chemotherapie waren, in der Phase-IIa-Studie ALICE eine ORR (Gesamtansprechrate) von 81%, eine CR+CRi-Rate von 52%, ein mOS von 14,3 Monaten und insgesamt ein robustes und schnelles Ansprechen bei geringer Toxizität.25
CD47-Inhibition: Magrolimab
CD47 ist ein transmembranöses Protein, das in hämatologischen und soliden Neoplasien überexprimiert ist und als „Do not eat me“-Signal für Makrophagen die Phagozytose von neoplastischen Zellen verhindert.26
Durch Bindung von CD47 auf neoplastischen Zellen an den zugehörigen Rezeptor „Signal Regulatory Protein Alpha“ (SIRPα) auf Makrophagen kommt es zur Aktivierung von Tyrosinphosphatasen und zur Hemmung der Myosinakkumulation an der phagozytotischen Synapse, was letztendlich die Phagozytose verhindert.26,27
Eine erhöhte CD47-Expression ist in der AML mit einer schlechten Prognose assoziiert und findet sich sowohl auf mobilisierten hämatopoetischen als auch auf leukämischen Stammzellen. Die Inhibition von CD47 führte zur Phagozytose von primären humanen AML-Zellen in vitro und zu deren Depletion im peripheren Blut und im Knochenmark im Xenograft-Mausmodell in vivo.28
Die vielversprechenden präklinischen Daten führten zur Entwicklung des humanisierten Anti-CD47-Antikörpers Magrolimab (Hu5F9-G4), welcher als Monotherapie in einer Phase-I-Dosiseskalationsstudie in der rezidivierten/refraktären AML trotz Blastenreduktion im Knochenmark kein objektives Ansprechen zeigte.26,29,30
Die in weiterer Folge in einer Phase-Ib-Studie untersuchte Kombination aus Magrolimab und Azacitidin erzielte bei nicht vorbehandelten AML-Patient*innen (ungeeignet für eine intensive Chemotherapie, 64% mit ungünstiger zytogenetischer Risikokonstellation, 65% mit TP53-Mutation) eine ORR von 65% und eine CR-Rate von 44% im gesamten Patient*innenkollektiv, während bei TP53-mutierten (TP53mut) Patient*innen sogar eine ORR von 71% und eine CR-Rate von 48% beobachtet werden konnte.31
Das mOS betrug bei TP53mut-Patient*innen 12,9 Monate und bei TP53-Wildtyp(TP53wt)-Patient*innen 18,9 Monate.31 Die 2022 aktualisierten Ergebnisse einer Erweiterungskohorte zeigten eine ORR von 49%, eine CR-Rate von 33% und ein mOS von 10,8 Monaten bei TP53mut-AML-Patient*innen.32
Aktuell wird in der Phase-III-Studie ENHANCE-2 die Kombination aus Magrolimab und Azacitidin vs. Standardtherapie (Induktionschemotherapie oder Azacitidin und Venetoclax) bei nicht vorbehandelten TP53mut-AML-Patient*innen untersucht.
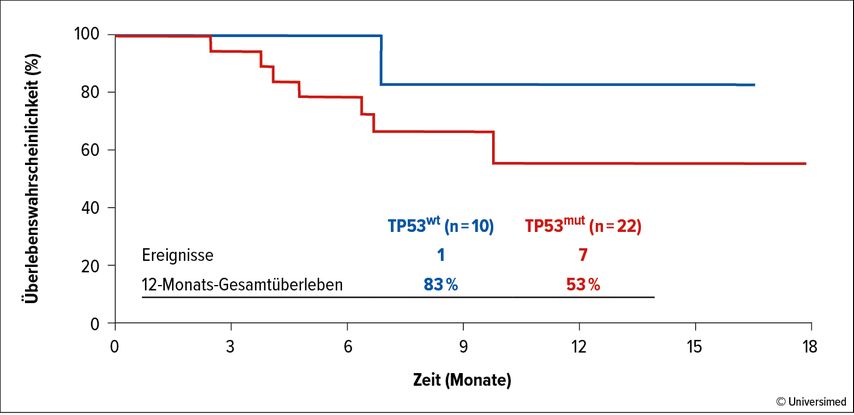
Auch die Kombination aus Magrolimab, Azacitidin und Venetoclax zeigte in der AML in einer Phase-Ib/II-Studie vielversprechende Ergebnisse.33 Die Studienpopulation war durch eine ungünstige Prognose gekennzeichnet (93% mit ungünstigem Risiko nach ELN 2017, 71% mit ungünstigem zytogenetischem Risikoprofil). Die in der Phase II eingeschlossenen Patient*innen mit neu diagnostizierter AML (älter als 75 Jahre oder ungeeignet für intensive Chemotherapie oder mit ungünstigem zytogenetischem Risikoprofil und/oder TP53-Mutation) zeigten bei 32 De-novo- oder therapieassoziierten Fällen bei TP53-Mutation eine ORR von 68%, eine CR-Rate von 41% und eine 1-Jahres-Gesamtüberlebensrate (OS) von 53%, während bei TP53-Wildtyp-Situation eine ORR von 100%, eine CR-Rate von 60% und eine 1-Jahres-OS-Rate von 83% auffiel (Abb. 1).
Abb. 1: Gesamtüberleben von 32 Patient*innen mit De-novo oder therapieassoziierter AML mit TP53wt- (n=10, blau, 1-Jahres-Gesamtüberlebensrate 83%) und mit TP53mut-Status (n=22, rot, 1-Jahres-Gesamtüberlebensrate 53%). Modifiziert nach Daver N et al.33
Bei neun unbehandelten sAML-Fällen war bei TP53-Mutation eine ORR von 100% und eine CR-Rate von 40% und bei TP53-Wildtyp-Situation eine ORR von 75% und eine CR-Rate von 50% ersichtlich.
Die häufigsten nichthämatologischen, unerwünschten Nebenwirkungen (≥Grad 3) waren febrile Neutropenie (50%), Pneumonie (38%), Hyperbilirubinämie (11%), Transaminitis (11%), Kreatininerhöhung (8%) und Hypokaliämie (8%). Es wurden keine immunassoziierten unerwünschten Nebenwirkungen beobachtet.
Insgesamt überzeugte die Kombination aus Magrolimab, Azacitidin und Venetoclax und lieferte beeindruckende klinische Resultate bei vorhandener TP53-Mutation. Aktuell wird in der placebokontrollierten, 1:1 randomisierten Phase-III-Studie ENHANCE-3 bei nicht vorbehandelten AML-Patient*innen, die für eine intensive Chemotherapie ungeeignet sind (älter als 75 Jahre oder aufgrund von Komorbiditäten), die Kombination aus Magrolimab, Azacitidin und Venetoclax untersucht.
Universelle CAR-T-Zell-Therapie: UniCAR02-T-CD123
CD123 ist die α-Kette des Interleukin-3-Rezeptors (IL-3R), einem Dimer bestehend aus der hochaffinen, zytokinspezifischen α-Untereinheit und der βc-Untereinheit, die für die intrazelluläre Signalgebung verantwortlich ist und auch im Interleukin-5-Rezeptor (IL-5R) und im Rezeptor für GM-CSF (GM-CSF-R) vorkommt.34 Die Bindung von IL-3 an CD123 führt zur Heterodimerisierung des IL-3R und zur Aktivierung intrazellulärer Signalkaskaden, welche u.a. die Differenzierung und Proliferation myeloischer Zellen bewirken.34
Bei der AML findet sich eine Überexpression von CD123 in 29–55% (mittels Immunhistochemie) bzw. 55–97% (mittels Durchflusszytometrie) der Fälle. Die Überexpression ist mit einer schlechten Prognose assoziiert.34,35 CD123 ist auf leukämischen Stammzellen im Gegensatz zu hämatopoetischen Stammzellen und myeloischen Zellen überexprimiert und stellt somit einen guten Angriffspunkt für zielgerichtete Therapien dar.34,36,37 Gegen CD123 gerichtete „Chimeric Antigen Receptor“(CAR)-T-Zellen (MB-102) zeigten in einer Phase-I-Studie klinische Aktivität.34,37,38
Um toxische Nebenwirkungen besser kontrollieren zu können, wurde ein modulares, universelles CAR-T-Zell-System (UniCAR-T) entwickelt, welches durch ein Targeting-Modul (TM) schnell und reversibel die Aktivität von CAR-T-Zellen steuern kann.39 Hierbei bindet der CAR an ein TM, das wiederum gegen ein spezifisches Tumorantigen gerichtet ist. Dadurch bleiben UniCAR-T-Zellen inaktiv, wenn das TM nicht vorhanden ist.
Gleichzeitig kann durch Austausch des TM gegen ein anderes Tumorantigen eine neue Zielstruktur durch UniCAR-T-Zellen erkannt und angegriffen werden. Das für CD123 adaptierte UniCAR-T-Zell-System (UniCAR-T-CD123) eradizierte in vitro und in vivo CD123+ leukämische Zellen und zeigte im Mausmodell eine reversible Hämatotoxizität.40,41
Die 2021 präsentierten Daten der ersten drei mit UniCAR-T-CD123 im Rahmen einer Phase-I-Studie behandelten Patient*innen mit einer refraktären/rezidivierten AML zeigten in zwei Fällen eine CRi und in einem Fall eine PR (partielle Remission).42
In einer weiteren Phase-I-Studie mit 14 AML-Patient*innen (rezidiviert/refraktär, im Median mit drei Linien vortherapiert, vier Patient*innen vorher allogen stammzelltransplantiert), die mit UniCAR02-T-CD123 behandelt wurden, zeigten zehn Patient*innen eine Blastenreduktion (2 mit einer CRi, 1 Patient mit MRD-positiver CR konvertierte zu MRD-negativer CR) und vier eine PR.43
Ein Zytokinfreisetzungssyndrom (CRS) wurde bei zwölf Patient*innen beobachtet (Grad 1 oder 2). Ein Patient präsentierte ein CAR-T-Zell-assoziiertes Enzephalopathiesyndrom (CRES) Grad 2, das durch Desorientiertheit und Verlust der Schreibfähigkeit auffiel und sich durch Verabreichungsstopp des TM rasch zurückbildete. Eine dosislimitierende Toxizität wurde bei einem Patienten beobachtet, der sich mit Hypofibrinogenämie (CRS Grad 3) präsentierte, welche sich ebenfalls nach TM-Verabreichungsstopp rasch zurückbildete.
Insgesamt steht mit UniCAR02-T-CD123 eine gut steuerbare, gegen CD123 gerichtete CAR-T-Zell-Therapie zur Verfügung, die aktuell in Erweiterungskohorten untersucht wird.
TP53-Reaktivierung/Ferroptose-Induktion: Eprenetapopt
TP53-Mutationen kommen in 5–10% der Patient*innen mit De-novo-MDS und AML und in 25–50% der Patient*innen mit therapieassoziiertem MDS und AML vor und sind durch eine schlechte Prognose gekennzeichnet.44,45
Die meisten TP53-Mutationen sind Missense-Mutationen und in der DNA-Bindungsdomäne lokalisiert.44 Ein vielversprechender Therapieansatz ist die Reaktivierung von TP53 mittels Eprenetapopt (APR-246, PRIMA-1MET), ein Prodrug, das spontan zu Methylenquinuclidinon umgewandelt wird und als solches kovalent an Cystein-Residuen des TP53-Proteins bindet und dadurch eine Konformationsänderung bewirkt, die die Funktionalität von TP53wiederherstellen soll.46
Zusätzlich wurde berichtet, dass Eprenetapopt durch Glutathion-Depletion eine eisenabhängige und durch Akkumulation von Lipidperoxiden gekennzeichnete, nichtapoptotische Form des Zelltods (sog. Ferroptose) induziert, was wiederum erklärt, wieso Eprenetapopt auch bei neoplastischen TP53wt-Zellen seine Wirkung entfaltet.47–49
Die klinische Aktivität von Eprenetapopt als Monotherapie konnte in einer Phase-I-Studie, in der auch AML-Patient*innen eingeschlossen waren, nachgewiesen werden.50,51 Die Kombination aus Eprenetapopt und Azacitidin zeigte in vitro und in vivo synergistische Aktivität in TP53mut AML- und MDS-Zelllinien, primären Patient*innenproben und in einem Xenograftmodell und erzielte in einer Phase-Ib/II-Studie mit 55 TP53mut Patient*innen (40 MDS, 11 AML, 4 MDS/myeloproliferative Neoplasien) eine ORR von 71% (MDS: 73%, AML: 64%), eine CR-Rate von 44% (MDS: 50%, AML: 36%) und ein mOS von 10,8 Monaten (MDS: 10,4 Monate, AML: 10,8 Monate).52,53 35% der Patient*innen konnten allogen stammzelltransplantiert werden und zeigten ein mOS von 14,7 Monaten.53
Die häufigsten unerwünschten Nebenwirkungen (≥Grad 3) waren febrile Neutropenie (33%), Leukopenie (29%) und Neutropenie (29%) und ähnelten insgesamt jenen einer Monotherapie mit Azacitidin oder Eprenetapopt.53 Eine französische Phase-II-Studie, die ebenfalls die Kombination aus Eprenetapopt und Azacitidin bei 52 TP53mut Patient*innen (34 MDS, 18 AML) untersuchte, präsentierte eine ORR von 52% (MDS: 62%, AML: 33%), eine CR-Rate von 37% (MDS: 47%, AML: 17%) und ein mOS von 12,1 Monaten (MDS: 12,1 Monate, AML: 10,4 Monate).54
Trotz der vielversprechenden Ergebnisse konnte in einer randomisierten Phase-III-Studie bei TP53mut Patient*innen mit MDS keine Überlegenheit der Kombination aus Eprenetapopt und Azacitidin gegenüber der Monotherapie mit Azacitidin gezeigt werden.44,49
Auch nach allogener Stammzelltransplantation von MDS- und AML-Patient*innen mit TP53-Mutation bleibt die Rezidivwahrscheinlichkeit hoch und die Prognose ungünstig.55,56 Um hier das Rezidivrisiko zu verringern, wurde in einer Phase-II-Studie bei MDS- und AML-Patient*innen mit TP53-Mutation die Kombination aus Eprenetapopt und Azacitidin als Erhaltungstherapie untersucht.57
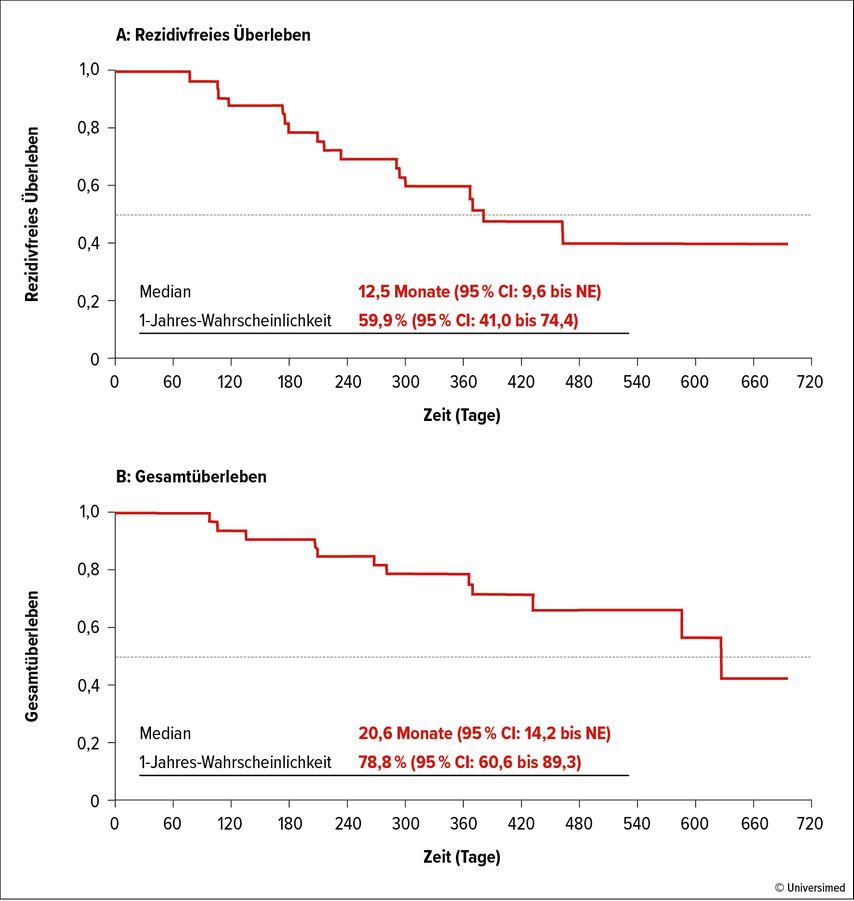
Von 55 Patient*innen mit allogener Stammzelltransplantation erhielten 33 (19 MDS, 14 AML, Hochrisikopopulation: 64% mit CR/CRi/mCR, 58% mit HCT-CI ≥3, 83% TP53mut) eine Erhaltungstherapie mit i.v. verabreichtem Eprenetapopt an den Tagen 1–4 und i.v./s.c. verabreichtem Azacitidin an den Tagen 1–5 bei einer Zyklusdauer von 28 Tagen, wobei im Median sieben Zyklen verabreicht wurden. Mit einem medianen rezidivfreien Überleben (mRFS) von 12,5 Monaten und einem mOS von 20,6 Monaten zeigten sich insgesamt vielversprechende Ergebnisse (Abb. 2).
Abb. 2: Rezidivfreies Überleben (A) und Gesamtüberleben (B) bei 33 Patient*innen mit MDS/AML unter der Erhaltungstherapie mit Eprenetapopt und Azacitidin nach allogener Stammzelltransplantation. Modifiziert nach Mishra A et al.57
Literatur:
1 Kantarjian HM et al.: Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol 2012; 30(21): 2670-7 2 Dombret H et al.: International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood 2015; 126(3): 291-9 3 Jilg S et al.: Blockade of BCL-2 proteins efficiently induces apoptosis in progenitor cells of high-risk myelodysplastic syndromes patients. Leukemia 2016; 30(1): 112-23 4 DiNardo CD et al.: Azacitidine and venetoclax in previously untreated acute myeloid leukemia. N Engl J Med 2020; 383(7): 617-29 5 Meyer C et al.: The MLL recombinome of acute leukemias in 2017. Leukemia 2018; 32(2): 273-84 6 Krivtsov AV, Armstrong SA: MLL translocations, histone modifications and leukaemia stem-cell development. Nat Rev Cancer 2007; 7(11): 823-33 7 Krivtsov AV et al.: A menin-MLL inhibitor induces specific chromatin changes and eradicates disease in models of MLL-rearranged leukemia. Cancer Cell 2019; 36(6): 660-73.e11 8 Yokoyama A et al.: The menin tumor suppressor protein is an essential oncogenic cofactor for MLL-associated leukemogenesis. Cell 2005; 123(2): 207-18 9 Kühn MWM et al.: Targeting chromatin regulators inhibits leukemogenic gene expression in NPM1 mutant leukemia. Cancer Discov 2016; 6(10): 1166-81 10 Klossowski S et al.: Menin inhibitor MI-3454 induces remission in MLL1-rearranged and NPM1-mutated models of leukemia. J Clin Invest 2020; 130(2): 981-97 11 Uckelmann HJ et al.: Therapeutic targeting of preleukemia cells in a mouse model of NPM1 mutant acute myeloid leukemia. Science 2020; 367(6477): 586-90 12 Uckelmann HJ et al.: Mutant NPM1 directly regulates oncogenic transcription in acute myeloid leukemia. Cancer Discov 2023; 13(3): 746-65 13 Falini B et al.: NPM1-mutated acute myeloid leukemia: from bench to bedside. Blood 2020; 136(15): 1707-21 14 Issa GC et al.: The menin inhibitor SNDX-5613 (revumenib) leads to durable responses in patients (Pts) with KMT2A-rearranged or NPM1 mutant AML: updated results of a phase (Ph) 1 Study. Blood 2022; 140(Suppl 1): 150-2 15 Shi Y et al.: Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell 2004; 119(7): 941-53 16 Metzger E et al.: LSD1 demethylates repressive histone marks to promote androgen-receptor-dependent transcription. Nature 2005; 437(7057): 436-9 17 Möröy T, Khandanpour C: Role of GFI1 in epigenetic regulation of MDS and AML pathogenesis: mechanisms and therapeutic implications. Front Oncol 2019; 9: 824 18 Sprüssel A et al.: Lysine-specific demethylase 1 restricts hematopoietic progenitor proliferation and is essential for terminal differentiation. Leukemia 2012; 26(9): 2039-51 19 Magliulo D, Bernardi R, Messina S: Lysine-specific demethylase 1A as a promising target in acute myeloid leukemia. Front Oncol 2018; 8: 255 20 Niebel D et al.: Lysine-specific demethylase 1 (LSD1) in hematopoietic and lymphoid neoplasms. Blood 2014; 124(1): 151-2 21 Harris WJ et al.: The histone demethylase KDM1A sustains the oncogenic potential of MLL-AF9 leukemia stem cells. Cancer Cell 2012; 21(4): 473-87 22 McGrath JP et al.: Pharmacological inhibition of the histone lysine demethylase KDM1A suppresses the growth of multiple acute myeloid leukemia subtypes. Cancer Res 2016; 76(7): 1975-88 23 Maes T et al.: ORY-1001, a potent and selective covalent KDM1A inhibitor, for the treatment of acute leukemia. Cancer Cell 2018; 33(3): 495-511.e12 24 Salamero O et al.: First-in-human phase I study of Iadademstat (ORY-1001): a first-in-class lysine-specific histone demethylase 1A inhibitor, in relapsed or refractory acute myeloid leukemia. J Clin Oncol 2020; 38(36): 4260-73 25 Salamero O et al.: Iadademstat combination with azacitidine is a safe and effective treatment in first line acute myeloid leukemia. Final results of the Alice Trial. Blood 2022; 140: 1711-3 26 Chao MP et al.: Therapeutic targeting of the macrophage immune checkpoint CD47 in myeloid malignancies. Front Oncol 2020; 9: 1380 27 Jaiswal S et al.: CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis. Cell 2009; 138(2): 271-85 28 Majeti R et al.: CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells. Cell 2009; 138(2): 286-99 29 Liu J et al.: Pre-clinical development of a humanized anti-CD47 antibody with anti-cancer therapeutic potential. PLoS One 2015; 10(9): e0137345 30 Vyas P et al.: Initial phase 1 results of the first-in-class anti-CD47 antibody Hu5F9-G4 in relapsed/refractory acute myeloid leukemia patients. Eur Hematol Assoc EHA Libr 2018; Abstr. #PF232 31 Sallman DA et al.: The first-in-class anti-CD47 antibody magrolimab combined with azacitidine is well-tolerated and effective in AML patients: phase 1b results. Blood 2020; 21: S213 32 Daver NG et al.: Tolerability and efficacy of the first-in-class anti-CD47 antibody magrolimab combined with azacitidine in frontline TP53m AML patients: phase 1b results. J Clin Oncol 2022; 40: 7020 33 Daver N et al.: Phase I/II study of azacitidine (AZA) with venetoclax (VEN) and magrolimab (Magro) in patients (pts) with newly diagnosed (ND) older/unfit or high-risk acute myeloid leukemia (AML) and relapsed/refractory (R/R) AML. Blood 2022; 140: 141-4 34 Patnaik MM et al.: Targeting CD123 in hematologic malignancies: identifying suitable patients for targeted therapy. Leuk Lymphoma 2021; 62(11): 2568-86 35 Testa U et al.: Elevated expression of IL-3Rα in acute myelogenous leukemia is associated with enhanced blast proliferation, increased cellularity, and poor prognosis. Blood 2002; 100(8): 2980-8 36 Daver N et al.: T-cell-based immunotherapy of acute myeloid leukemia: current concepts and future developments. Leukemia 2021; 35(7): 1843-63 37Pelosi E, Castelli G, Testa U: CD123 - a therapeutic target for acute myeloid leukemia and blastic plasmocytoid dendritic neoplasm. Int J Mol Sci 2023; 24(3): 2718 38 Budde LE et al.: CD123CAR displays clinical activity in relapsed/refractory (r/r) acute myeloid leukemia (AML) and blastic plasmacytoid dendritic cell neoplasm (BPDCN): safety and efficacy results from a phase 1 study. Cancer Immunol Res 2020; 8: PR14 39 Cartellieri M et al.: Switching CAR T cells on and off: a novel modular platform for retargeting of T cells to AML blasts. Blood Cancer J 2016; 6(8): e458 40 Loff S et al.: Rapidly switchable universal CAR-T cells for treatment of CD123-positive leukemia. Mol Ther Oncolytics 2020; 17: 408-20 41 Meyer JE et al.: Evaluation of switch-mediated costimulation in trans on universal CAR-T cells (UniCAR) targeting CD123-positive AML. Oncoimmunology 2021; 10(1): 1945804 42 Wermke M et al.: Proof of concept for a rapidly switchable universal CAR-T platform with UniCAR-T-CD123 in relapsed/refractory AML. Blood 2021; 137(22): 3145-8 43 Ehninger G et al.: Phase 1 dose escalation study of the rapidly switchable universal CAR-T therapy Unicar-T-CD123 in relapsed/refractory AML. Blood 2022; 137(22): 3145-8 44 Loschi M, Fenaux P, Cluzeau T: How I treat TP53-mutated acute myeloid leukemia and myelodysplastic syndromes. Cancers 2022; 14(18): 4519 45 Döhner H et al.: Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood 2022; 140(12): 1345-77 46 Lambert JMR et al.: PRIMA-1 reactivates mutant p53 by covalent binding to the core domain. Cancer Cell 2009; 15(5): 376-88 47 Peng X et al.: APR-246/PRIMA-1MET inhibits thioredoxin reductase 1 and converts the enzyme to a dedicated NADPH oxidase. Cell Death Dis 2013; 4(10): e881 48 Bykov VJN et al.: Targeting of mutant P53 and the cellular redox balance by APR-246 as a strategy for efficient cancer therapy. Front Oncol 2016; 6: 21 49 Fujihara KM et al.: Eprenetapopt triggers ferroptosis, inhibits NFS1 cysteine desulfurase, and synergizes with serine and glycine dietary restriction. Sci Adv 2022; 8(37): eabm9427 50 Lehmann S et al.: Targeting p53 in vivo: a first-in-human study with p53-targeting compound APR-246 in refractory hematologic malignancies and prostate cancer. J Clin Oncol 2012; 30(29): 3633-9 51 Deneberg S et al.: An open-label phase I dose-finding study of APR-246 in hematological malignancies. Blood Cancer J 2016; 6(7): e447 52 Maslah N et al.: Synergistic effects of PRIMA-1Met (APR-246) and 5-azacitidine in TP53-mutated myelodysplastic syndromes and acute myeloid leukemia. Haematologica 2020; 105(6): 1539-51 53 Sallman DA et al.: Eprenetapopt (APR-246) and azacitidine in TP53-mutant myelodysplastic syndromes. J Clin Oncol 2021; 39(14): 1584-94 54 Cluzeau T et al.: Eprenetapopt plus azacitidine in TP53-mutated myelodysplastic syndromes and acute myeloid leukemia: a phase II study by the Groupe Francophone des Myélodysplasies (GFM). J Clin Oncol 2021; 39(14): 1575-83 55 Bejar R et al.: Somatic mutations predict poor outcome in patients with myelodysplastic syndrome after hematopoietic stem-cell transplantation. JClin Oncol 2014; 32(25): 2691-8 56 Lindsley RC et al.: Prognostic mutations in myelodysplastic syndrome after stem-cell transplantation. NEngl J Med 2017; 376(6): 536-47 57 Mishra A et al.: Eprenetapopt plus azacitidine after allogeneic hematopoietic stem-cell transplantation for TP53-mutant acute myeloid leukemia and myelodysplastic syndromes. J Clin Oncol 2022; 40(34): 3985-93
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...