Innovationen vor dem Hintergrund einer globalen Epidemie
Bericht:
Dr. Judith Moser
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Über 2000 Teilnehmer:innen aus aller Welt kamen Anfang April in Athen zusammen, umsich im Rahmen des 11th World Congress of Melanoma, der gemeinsam mit der 21.Jahrestagung der European Association of Dermato-Oncology (EADO) abgehalten wurde, über die rezentesten Entwicklungen im Bereich von Diagnostik und Therapie kutaner Tumoren auszutauschen.
Keypoints
-
RP1 + Nivolumab wirksam bei PD-1-refraktärem Melanom
-
Tilsotolimod: signifikante RFS-Verlängerung bei frühem Melanom (SLN-Positivität)
-
TIL + Pembrolizumab: tiefe Remissionen bei Checkpoint-naivem Melanom
-
Neoadjuvantes Cemiplimab: hohe pCR-Rate und langfristige Ereignisfreiheit beim CSCC
Außer Frage steht die Tatsache einer Epidemie dermatologischer Karzinome, wie der Epidemiologe Prof. David Whiteman, Brisbane, Australien, in der ersten Keynote Lecture des Kongresses betonte. Die Erhebungen zeigen speziell in Europa und Nordamerika hohe Inzidenzen an Melanomen und Plattenepithelkarzinomen, aber auch kontinuierliche Anstiege des Merkelzellkarzinoms.1, 2 Noch mehr Besorgnis ruft die Dynamik hervor; so nehmen etwa invasive Melanome bei Älteren (speziell ab 80 Jahren) weltweit rasch zu. Zudem ist die Mortalität in vielen Populationen inakzeptabel hoch,1 und die Gesundheitssysteme kämpfen mit enormen Kosten. Whiteman wies darauf hin, dass sich nur durch das Zusammenwirken von verstärkter Primärprävention und Früherkennung sowie optimierten Behandlungsoptionen eine verbesserte Kontrolle erreichen lassen wird.
Neues zum Melanom
Signifikantes Ansprechen auf RP1 in IGNYTE
Nach dem Eintreten einer Progression unter einer Immuncheckpoint-Inhibitortherapie sind die Therapiemöglichkeiten beim fortgeschrittenen Melanom limitiert. Innovative Strategien beinhalten unter anderem RP1 (Vusolimogen oder Parepvec), ein onkolytisches Herpes-simplex-Virus Typ 1, das in der globalen Phase-I-Studie IGNYTE bei 140 Patient:innen mit fortgeschrittenem kutanem Melanom nach Anti-PD-1-Versagen getestet wurde. Es erfolgte eine achtmalige intratumorale Injektion von RP1, die in den Zyklen 2–8 von einer Nivolumab-Gabe begleitet war. Nivolumab gelangte anschließend in den Zyklen 9–30 als Monotherapie zum Einsatz. Fast die Hälfte der Patient:innen befand sich im Stadium IVM1b/c/d, und 65,7% wiesen eine primäre Resistenz gegen die PD-1-gerichtete Therapie auf.
Couselo et al. präsentierten am WCM/EADO 2025 die primäre Auswertung der Studie.3 Es fand sich ein klinisch relevantes Ansprechen mit einer bestätigten objektiven Responserate (ORR) von 33,6% und Komplettremissionen in 15,0%. Das Ansprechen war über die Subgruppen hinweg konsistent; bei primär resistenten Patient:innen betrug die ORR 35,9% und nach kombinierter PD-1-/CTLA-4-Therapie 27,7%. Auch viszerale Läsionen zeigten eine Schrumpfung, obwohl hier natürlich keine Injektionen vorgenommen worden waren. Als mediane Ansprechdauer wurden 21,6 Monate errechnet. Nach 12 Monaten bestand bei 32,8% der Patient:innen Progressionsfreiheit. Das mediane Gesamtüberleben war zum Analysezeitpunkt noch nicht erreicht; nach drei Jahren lebten 54,8% der Teilnehmer:innen.
RP1 plus Nivolumab erwies sich im Allgemeinen als gut verträglich. Die häufigsten Nebenwirkungen umfassten Müdigkeit, Fieber, Übelkeit und Influenza-artige Symptome, wobei diese meist mild bzw. moderat und transient waren. Es traten keine Grad-5-Toxizitäten auf. Immunhistochemische Analysen legen nahe, dass RP1 plus Nivolumab eine Steigerung der CD8+ T-Zell-Infiltration und der PD-L1-Expression bedingt. Derzeit läuft die Phase-III-Studie IGNYTE-3 zu RP1 plus Nivolumab nach Progression unter PD-1- und CTLA-4-gezielter Therapie (NCT06264180).
INTRIM: Tilsotolimod
Als therapeutisches Target eignen sich weiters dendritische Zellen, da sie durch TLR9-Agonisten stimuliert werden können. Die Injektion des TLR9-Agonisten CpG-7909 an der Exzisionsstelle von Melanomen im Stadium I–II bewirkte in zwei randomisierten Phase-II-Studien Anstiege der aktivierten dendritischen Zellen und melanomspezifischen CD8+ T-Zellen.4 Im Vergleich zu Placebo waren die nach einer Woche entnommenen Sentinellymphknoten (SLN) signifikant seltener positiv und das rezidivfreie Überleben (RFS) signifikant verlängert.
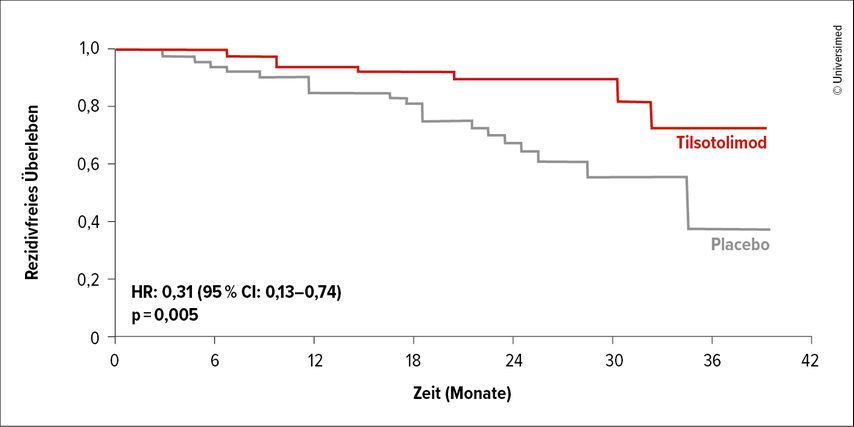
Der TLR9-Agonist Tilsotolimod wurde in der randomisierten, doppelblinden Phase-II-Studie INTRIM als adjuvante Therapie evaluiert. Nach der Exzision von Melanomen in den Stadien pT3-T4cN0M0 erfolgte eine einmalige intradermale Injektion von Tilsotolimod (n=54) oder Kochsalzlösung (n=54) sieben Tage vor einer Reexzision und SLN-Biopsie. Zum Zeitpunkt der Interimsanalyse war der primäre Endpunkt bereits erreicht; im Tilsotolimod-Arm wurde eine niedrigere positive SLN-Rate dokumentiert (13,0% vs. 44,4%; p<0,0001).5 Van den Eertwegh et al. präsentierten am WCM/EADO 2025 die Daten zum RFS.6 Nach einem medianen Follow-up von zwei Jahren fand sich eine Reduktion des Rezidivrisikos um 69% (HR: 0,31; p=0,005; Abb. 1). Die Rezidivraten betrugen 11% vs. 35%, wobei sowohl lokale Rezidive als auch Fernmetastasen im Prüfarm seltener auftraten als im Kontrollarm. In allen Subgruppen resultierten unter Tilsotolimod RFS-Vorteile. Die Substanz legte ein günstiges Nebenwirkungsprofil an den Tag. Wie die Autor:innen anmerkten, erscheint eine randomisierte Phase-III-Studie zum adjuvanten Einsatz einer lokoregionalen TLR9-Therapie beim frühen Melanom (Stadium I/II) gerechtfertigt.
IOV-COM-202L: TIL-Therapie plus Pembrolizumab
Durch die Entnahme, Expansion und Aktivierung tumorinfiltrierender Lymphozyten (TIL) lässt sich bei Patient:innen mit refraktärer Erkrankung eine Verbesserung der T-Zell-Antwort herbeiführen.7, 8 Die autologe TIL-Zell-Therapie Lifileucel wurde in Kombination mit Pembrolizumab in der Phase-II-Multikohortenstudie IOV-COM-202 bei Patient:innen mit soliden Tumoren geprüft. Kohorte 1A der Studie enthielt ein Checkpoint-Inhibitor-naives Kollektiv mit nicht resektablen oder metastasierten Melanomen. Nach einer initialen Pembrolizumab-Gabe erfolgte die nicht myeloablative Lymphodepletion und schließlich die Lifileucel-Infusion, die von ≤6 Interleukin-2-Gaben und drei- bzw. sechswöchentlichem Pembrolizumab gefolgt war. Am WCM/EADO 2025 stellten Gogas et al. die Daten für 23 Patient:innen vor.9
Die Therapie bewirkte tiefe und anhaltende Remissionen mit einer ORR von 65,2% und einer Rate an Komplettremissionen von 30,4%. Alle Response-evaluierbaren Patient:innen erfuhren eine Reduktion ihrer Target-Läsionen. Nach einem medianen Follow-up von 21,7 Monaten war die mediane Ansprechdauer noch nicht erreicht worden. Die Nebenwirkungen entsprachen den bekannten Sicherheitsprofilen der eingesetzten Substanzen. Aktuell befindet sich die konfirmatorische Phase-III-Studie TILVANCE-301, die Lifileucel plus Pembrolizumab als Frontline-Therapie des fortgeschrittenen Melanoms mit einer Pembrolizumab-Monotherapie vergleicht, in der Rekrutierungsphase (NCT05727904).
Knappe vs. weite Resektion in allen Stadien
In kritischen Regionen wie dem Gesicht können aus kosmetischen und funktionellen Gründen oft keine umfangreichen Tumorresektionen vorgenommen werden. Taglione et al. untersuchten retrospektiv, ob in dieser Situation knappe Exzisionen (5–10mm) mit ungünstigeren Outcomes assoziiert sind als weite.10 Die beiden Vergleichskollektive umfassten jeweils über 1000 Patient:innen in den Stadien T1a–T4.
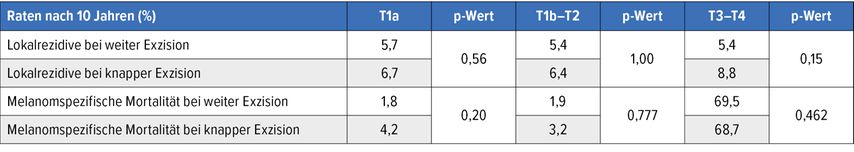
Nach zehn Jahren konnten zwischen den beiden Kollektiven keine Unterschiede hinsichtlich des Risikos für Lokalrezidive und der melanomspezifischen Mortalität festgestellt werden. Für alle Erkrankungsstadien fanden sich vergleichbare Ergebnisse (Tab. 1). Naturgemäß war die Notwendigkeit einer plastischen Rekonstruktion bei knapper Exzision in allen Stadien signifikant niedriger. Laut univariablem und multivariablem Modell bildete der Resektionsrand keinen statistisch signifikanten Parameter im Hinblick auf die Outcomes. Die Autor:innen wiesen darauf hin, dass es keinen plausiblen Grund gibt, diese bei kritischen anatomischen Lokalisationen generierten Ergebnisse nicht auf andere Lokalisationen auszudehnen. Die Ergebnisse laufender prospektiver randomisierter Studien müssen abgewartet werden, um die Beobachtungen zu untermauern.
Tab. 1: Häufigkeit von Lokalrezidiven und melanomspezifische Mortalitätsraten nach zehn Jahren je nach Umfang der Resektion und Tumorstadium10
Aderhautmelanom: neue Therapieansätze
Beträchtliche Mortalität geht vom Aderhautmelanom („uveal melanoma“, UM) aus, bei dem es sich um den häufigsten primären intraokulären Tumor Erwachsener handelt. Mit dem Fusionsprotein Tebentafusp wurde bei inoperabler oder metastasierter, HLA-A*02:01-positiver Erkrankung eine Erstlinientherapie verfügbar. Im Vergleich zu einer Behandlung nach Wahl der Prüfärzt:innen (v.a. Pembrolizumab) bewirkte der T-Zell-Engager im Phase-III-Setting einen Gesamtüberlebens-Benefit, der unter Real-World-Bedingungen bestätigt werden konnte.11, 12 Ein Therapie-Monitoring erscheint mittels ctDNA sowie löslichen cMETs möglich, wie im Rahmen eines Symposiums am WCM/EADO 2025 betont wurde.13 Anstiege dieser Marker im Plasma weisen auf ein Versagen der Therapie hin, noch bevor die LDH-Werte eine Zunahme zeigen. Als typische Nebenwirkung gelten Hautausschläge, die als Zeichen einer hohen T-Zell-Fitness gewertet werden können.14 Aktuell läuft die klinische Evaluierung von adjuvantem Tebentafusp bei Hochrisiko-UM im Rahmen der randomisierten Phase-III-Studie ATOM (NCT06246149). Zu weiteren in Entwicklung befindlichen Substanzen zählen der gegen CD3/PRAME gerichtete T-Zell-Engager Brenetafusp, der PI3Kδ-Hemmer Roginolisib, das onkolytische Virus RP2 und der Proteinkinase-C-Inhibitor Darovasertib. Diverse pivotale Studien befinden sich derzeit im Laufen. Beispielsweise wird die Kombination aus Darovasertib und Crizotinib als Erstlinientherapie des HLA-A*02:01-negativen metastasierten UM im Phase-II/III-Setting geprüft (NCT5987332).
Plattenepithelkarzinom: neoadjuvantes Cemiplimab
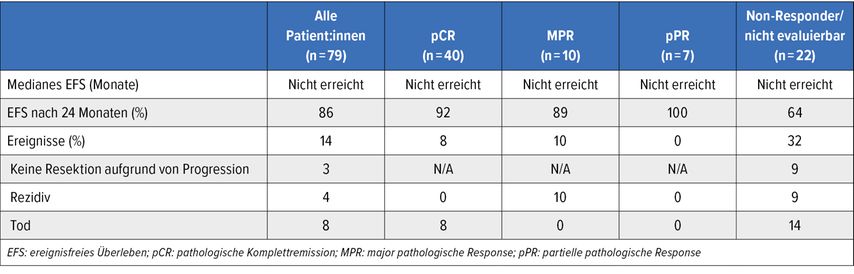
Eine nicht randomisierte Phase-II-Studie untersuchte den beim inoperablen kutanen Plattenepithelkarzinom (CSCC) zugelassenen PD-1-Antikörper Cemiplimab als neoadjuvante Therapie des lokal fortgeschrittenen, resektablen CSCC im Stadium II–IV. Nach maximal vier Cemiplimab-Dosen erfolgte die Resektion mit kurativer Intention; danach kamen nach Entscheidung der Ärzt:innen bis zu 16 Gaben adjuvantes Cemiplimab, adjuvante Radiotherapie oder Observation zum Einsatz. 70 von 79 Patient:innen wurden operiert. Initiale Analysen ergaben eine hohe Rate an pathologischen Komplettremissionen (pCR; 51%), und bei 89% lag zwölf Monate nach der Operation Ereignisfreiheit vor.15, 16 Adjuvant kam primär Observation (n=32) gefolgt von Radiotherapie (n=17) und Cemiplimab (n=16) zum Einsatz.
Gemäß den von Hauschild et al. vorgestellten Zweijahresdaten hatte kein:e Patient:in mit pCR nach einem Follow-up von 29,4 Monaten ein Rezidiv erlitten.17 In der Gruppe mit major-pathologischer Response traf dies auf eine Person von 10 zu. Bei allen 79 Patient:innen betrugen die 24-Monats-Raten für das ereignisfreie Überleben (Tab. 2) und das Gesamtüberleben jeweils 86%. 90% des Kollektivs, das eine Resektion erhalten hatte, waren nach 24 Monaten krankheitsfrei. Unter adjuvantem Cemiplimab wurden als häufigste Nebenwirkungen Diarrhö, Fatigue, Kreatininerhöhung und Plattenepithelkarzinome der Haut verzeichnet (alle 25%). Es traten keine Grad-4- oder Grad-5-Ereignisse auf. Exploratorischen Biomarkeranalysen zufolge verstärkt neoadjuvantes Cemiplimab die T-Zell-Reaktion in der Zirkulation und im Tumorgewebe. Es fand sich eine Hochregulation der adaptiven Immunreaktion, der T-Zell- und Lymphozytenaktivierung sowie anderer immunbezogener Pathways.
Tab. 2: Ereignisfreies Überleben nach neoadjuvantem Cemiplimab beim lokal fortgeschrittenen, resektablen kutanen Plattenepithelkarzinom17
Quelle:
11th World Congress of Melanoma (WCM) in conjunction with 21st European Association of Dermato-Oncology (EADO) Congress, 3.–5. April 2025, Athen
Literatur:
1 Globocan 2022 2 Olsen CM et al.: J Invest Dermatol 2021; 141(11): 2596-2601.e1 3 Couselo EM et al.: WCM/EADO 2025, Abstract O101 4 Koster BD et al.: Clin Cancer Res 2017; 23(19): 5679-5686 5 Van den Eertwegh A et al.: ESMO 2022, Abstract LBA43 6 Van den Eertwegh A et al.: WCM/EADO 2025, Abstract O103 7 Simpson-Abelson MR et al.: Ann Oncol 2020; 31: S720 8 Owens GL et al.: Cancer Immunol Immunother 2018; 67(10): 1519-1531 9 Gogas H et al.: WCM/EADO 2025, Abstract O104 10 Taglione B et al.: WCM/EADO 2025, Abstract O503 11 Hassel JC et al.: NEngl J Med 2023; 389(24): 2256-2266 12 Nathan P et al.: ESMO 2024, Abstract 1129P 13 WCM/EADO 2025, Symposium 43, “Metastatic uveal melanoma – current and emerging treatment options” 14 Sacco J et al.: ESMO 2024, Abstract 66O 15 Gross ND et al.: N Engl J Med 2022; 387(17): 1557-1568 16 Gross ND et al.: Lancet Oncol 2023; 24(11): 1196-1210 17 Hauschild A et al.: WCM/EADO 2025, Abstract O204
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...