Innovation beim frühen Mammakarzinom
Bericht: Mag. Dr. Anita Schreiberhuber
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die 17th St. Gallen International Breast Cancer Conference (SG BCC) konnte wieder mit spannenden Neuigkeiten mit Schwerpunkt auf der Primärtherapie bei frühem Brustkrebs aufwarten. Mehr als 50 Experten wurden eingeladen, auf der erstmals virtuell ausgetragenen, fünftägigen Konferenz zu sprechen. Das Programm wurde durch Diskussionsrunden mit reger Beteiligung des Publikums ergänzt. Einige Highlights der Tagung zu den unterschiedlichen Subentitäten sind auf den folgenden Seiten aufgeführt.
Keypoints
-
Beim HER2+ Mammakarzinom hat sich das Erreichen einer pCR unter neoadjuvanter Chemotherapie mittlerweile als Prädiktor etabliert und es entscheidet über eine Therapieintensivierung.
-
Vielversprechende Substanzen zur Behandlung des frühen tripelnegativen Mammakarzinoms befinden sich derzeit in klinischer Testung.
-
Der Ki-67-Status könnte beim HR+ Mammakarzinom Aufschluss über das Rezidivrisiko geben.
Frühes HER2+ Mammakarzinom
Das HER2+ Mammakarzinom, das ca. 15–20% der Mammakarzinome umfasst, ging früher aufgrund seiner aggressiven Tumorbiologie mit dem schlechtesten Outcome einher. „Im Zuge der vergangenen 15–20 Jahre fand dank der Verfügbarkeit von effektiven zielgerichteten Substanzen eine bemerkenswerte Verbesserung der klinischen Outcomes beim HER2+ Brustkrebs statt“, so die einleitenden Worte von Prof. Dr. Harold Burstein, Dana-Farber Cancer Institute, Boston, USA, der den Vorsitz der Session 2 bei der diesjährigen St. Gallen Breast Cancer Conference innehatte.
Neoadjuvante Therapie
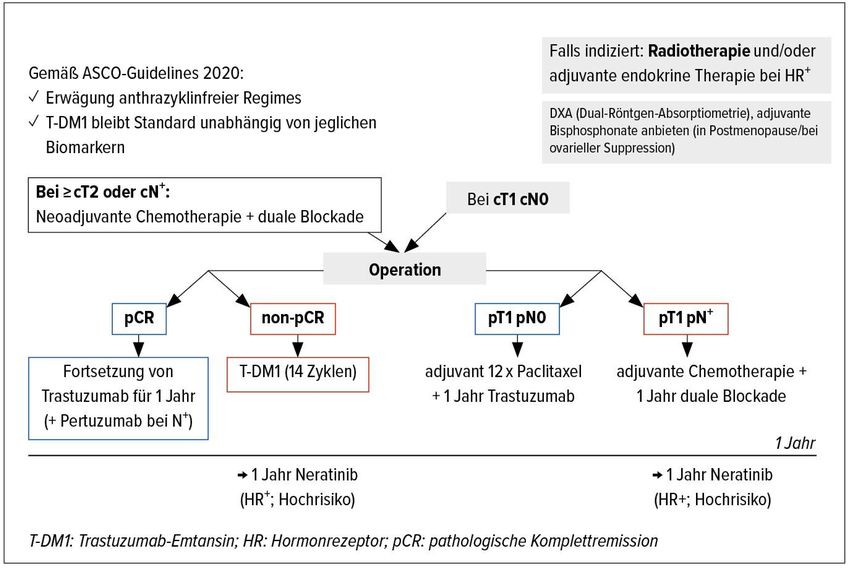
„Das HER2+ Mammakarzinom ist vermutlich jene Subentität, bei der wir in den vergangenen beiden Dekaden die meisten Fortschritte sehen konnten. Bis auf eine kleine Subgruppe hat sich die neoadjuvante Therapie als Therapie der Wahl etabliert“, betonte auch Prof. Dr. Nadia Harbeck, Brustzentrum, LMU Klinikum, München. Für die Anwendung einer neoadjuvanten Therapie beim frühen HER2+ Brustkrebs gibt es zwei fundierte Gründe: „Einerseits wissen wir nun, dass eine pCR (pathologische Komplettremission) nach neoadjuvanter Therapie ein Parameter für die Prädiktion der Outcomes ist. Andererseits können bei Patientinnen ohne pCR, die bekanntlich eine schlechte Prognose aufweisen, durch Intensivierung der adjuvanten Therapie die Outcomes verbessert werden.“ Seit 2012 hat sich die duale Antikörperblockade mit Trastuzumab (H) plus Pertuzumab (P) unter Zusatz von Docetaxel (T) im neoadjuvanten Setting etabliert, nachdem mit der Studie NeoSphere gezeigt werden konnte, dass mit diesem Schema gegenüber den Vergleichsarmen (TH, HP und TP) höhere pCR-Raten erzielt wurden.1
Beim Jahreskongress der American Society of Clinical Oncology (ASCO) 2020 wurden die 3-Jahres-Ergebnisse der Phase-III-Studie TRAIN-2 zur neoadjuvanten Chemotherapie mit oder ohne Anthrazykline plus duale HER2-Blockade präsentiert: Mit 93,5% vs. 92,7% waren die Ergebnisse zum ereignisfreien Überleben (EFS) zwischen den Armen zwar vergleichbar. Das Anthrazyklin-haltige Regime ging aber mit höherer Kardiotoxizität einher, die bei einem Drittel der Patientinnen nicht mehr reversibel war.2 Auch die pCR-Raten waren mit 67% bzw. 68% zwischen den Armen vergleichbar.3 Harbeck kommentierte die Anthrazyklin-assoziierten Nebenwirkungen folgendermaßen: „In Hinsicht auf eine optimale HER2-gerichtete Therapie benötigt man ein sehr gutes Argument, wenn man beim frühen HER2+ Mammakarzinom noch Anthrazykline einsetzen möchte.“
Adjuvantes Setting: Prognose lenkt die Therapie
In der Phase-III-Studie KATHERINE wurde das Antikörper-Wirkstoff-Konjugat T-DM1 (Trastuzumab-Emtansin) vs. Trastuzumab in der adjuvanten Situation bei 1486 pCR-negativen Patientinnen für 14 Zyklen untersucht. Mit dem Nachweis, dass T-DM1 in Hinblick auf den primären Endpunkt, das Überleben frei von invasiver Erkrankung (IDFS), signifikant überlegen war, erwies sich die Therapie in diesem Setting als hocheffektiv und konnte sich als SOC (Standard of Care) etablieren. Das berechnete 3-Jahres-IDFS lag bei 88,3% vs. 77,0% (HR: 0,50; p<0,0001).4
In der Studie APHINITY wurde die Zugabe von Pertuzumab zu Trastuzumab untersucht. In den Ergebnissen zum 3-Jahres-IDFS zeichneten sich Unterschiede bezüglich des Hormonrezeptor(HR)-Status ab: Während HR– Patientinnen keinen substanziellen Benefit durch die duale Blockade hatten, betrug der Unterschied vs. Trastuzumab-Mono in der HR+ Gruppe 1,8%.5 In den 6-Jahres-IDFS-Ergebnissen kristallisierte sich heraus, dass insbesondere Patientinnen mit einem hohen Rezidivrisiko von der Kombination profitierten – dies jedoch unabhängig vom HR-Status.6 „Diese Ergebnisse zeigen, dass wir längere Follow-up-Daten benötigen, da HR+ Patientinnen später rezidivieren als HR– Patientinnen“, merkte Harbeck an. Trotz Erreichens einer pCR sollten Patientinnen mit einer hohen Tumorlast zu Baseline demnach eine duale Therapie erhalten,7 da initialer Tumor- und Lymphknotenstatus sowie histologischer Subtyp als prognostische Faktoren für ein Rezidiv identifiziert wurden.8
Aus den Ergebnissen der ATP-Studie zur Gabe von Docetaxel plus Trastuzumab im adjuvanten Setting geht hervor, dass in einer Subgruppe von Patientinnen der Verzicht auf eine neoadjuvante Therapie sicher ist und mit guten Langzeit-Outcomes einhergeht: Nach sieben Jahren hatten nur vier der insgesamt 410 Patientinnen Fernmetastasen entwickelt.9 Im Kollektiv dieser Patientinnen mit frühem HER+ HR– Brustkrebs mit Tumoren ≤3cm scheint gemäß dieser Studie eine alleinige adjuvante Therapie ausreichend. Harbeck selbst empfiehlt diese Strategie in der klinischen Praxis nur bei einer Tumorgröße <2cm, also cT1-Tumoren.
Gibt es für HR+ und/oder pCR-negative Patientinnen eine weitere Therapiemaximierung? In der Studie ExteNET führte eine einjährige Therapie mit dem oralen pan-HER-Tyrosinkinaseinhibitor Neratinib vs. Placeboim Anschluss an eine einjährige Trastuzumab-Therapie bei HR+ Patientinnen bzw. bei non-pCR-Patientinnen zu einem IDFS-Benefit von 5,1% bzw. 7,4% (p=0,002 bzw. 0,086) und einer Risikoreduktion von 42% bzw. 40%.11 Neratinib wird daher in den aktuellen Guidelines der Arbeitsgemeinschaft Gynäkologische Onkologie für diese Kollektive empfohlen (Abb. 1).7,10
Frühes, tripelnegatives Mammakarzinom
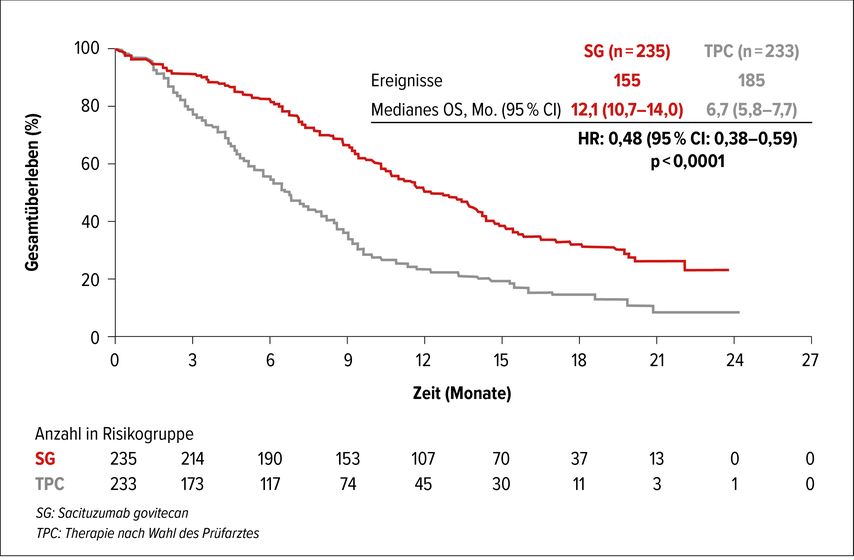
Ein spannendes Thema ist, ob für das metastasierte Setting zugelassene Substanzen den Sprung in die (neo)adjuvante Situation schaffen. Prof. Dr. Guiseppe Curiglano, Universität Mailand, Italien, berichtete, dass es im Bereich des tripelnegativen Mammakarzinoms (TNBC) einige Substanzen gibt, die vielversprechend sind. Dazu zählt beispielsweise Sacituzumab Govitecan (SG). Dabei handelt es sich um ein Antikörper-Wirkstoff-Konjugat, das in der Phase-III-Studie ASCENT beim metastasierten TNBC an Patientinnen untersucht wurde, die aufgrund ihrer fortgeschrittenen Erkrankung bereits ≥2 Chemotherapien erhalten hatten. Die Studie wurde vorzeitig gestoppt, weil gemäß der einstimmigen Beurteilung durch das Data Safety Minitoring Committee überzeugende Evidenz für die Wirksamkeit der Therapie vorliegt.
Die Patientinnen wurden 1:1 zum Erhalt von SG bzw. Therapie nach Wahl des Prüfarztes (TPC; Eribulin, Vinorelbin, Gemcitabin oder Capecitabin) randomisiert. Als primärer Endpunkt war das progressionsfreie Überleben (PFS) definiert. Mit 5,6 vs. 1,7 Monaten zeigte SG vs. TPC diesbezüglich eine signifikante Überlegenheit (HR: 0,41; p<0,0001). Das mediane Gesamtüberleben war mit 12,2 vs. 6,7 Monate bei diesem massiv vorbehandelten Kollektiv beinahe verdoppelt (HR: 0,48; p<0,0001) (Abb. 2).12 Derzeit wird SG bereits beim frühen TNBC und frühen HR+/HER2– Mammakarzinom vs. TPC (Capecitabin, platinbasierte Chemotherapie oder Observation) von der German Breast Group in der Phase-III-Studie SASCIA (NCT04595565) bei pCR-negativen Patientinnen untersucht. Dabei ist der Einschluss von 1200 Patientinnen geplant.
Als Beispiel für die erfolgreiche Überführung einer Substanz ins adjuvante Setting ist der PARP-Inhibitor Olaparib zu nennen, der bereits basierend auf der Studie OlympiAD13 für HR+ und TNBC-Patientinnen mit dem Nachweis einer BRCA-Mutation in der Keimbahn (gBRCAm) im metastasierten Setting zugelassen ist. Olaparib ist eine orale Erhaltungstherapie, die bei Patientinnen mit lokal fortgeschrittenem oder metastasiertem HER2+ Brustkrebs als Monotherapie indiziert ist.14 In OlympiAD wurde die signifikante Überlegenheit von Olaparib vs. TPC (Capecitabin, Vinorelbin oder Eribulin) hinsichtlich des primären Endpunkts PFS und sämtlicher sekundärer Endpunkte bestätigt.13
In der Phase-III-Studie OlympiA (NCT02032823) wird Olaparib vs. Placebo bei Hochrisikopatientinnen mit frühemHER2– Mammakarzinom und dem Vorliegen einer gBRCAm nach Erhalt einer neoadjuvanten oder adjuvanten Chemotherapie untersucht, wobei mindestens sechs Zyklen eines Anthrazyklins und/oder eines Taxans enthalten sein musste. Als primärer Endpunkt wird das IDFS definiert. Erfreulicherweise wurde bereits im Februar dieses Jahres per Pressemitteilung verkündet, dass unter Olaparib ein anhaltender, klinisch relevanter Therapieeffekt vs. Placebo nachgewiesen wurde und das Independent Data Monitoring Committee die Durchführung einer frühen ersten Analyse empfahl.15
Frühes HR+ Mammakarzinom
„Das Erreichen einer pCR unter einer neoadjuvanten endokrinen Therapie ist sehr selten“, konstatierte Prof. Dr. Stephen Johnston, The Royal Marsden NHS Foundation Trust & Institute of Cancer Research, Chelsea, London, der der Frage nachging, wann bei frühem HR+ Mammakarzinom eine neoadjuvante Chemotherapie dennoch Sinn macht. Er zitierte die aktuellen ASCO-Guidelines zu dieser Thematik, in denen darauf hingewiesen wird, dass bei postmenopausalen Frauen eine neoadjuvante endokrine Therapie mit einem Aromatasehemmer zu einer Verbesserung der lokoregionären chirurgischen Optionen führen kann. Bei prämenopausalen Frauen hingegen soll diese Strategie jedoch nur im Rahmen von klinischen Studien zur Anwendung kommen.16
Ki-67 etablierte sich schon vor vielen Jahren als Proliferationsmarker bei HR+ Mammakarzinomen. Es kann im neoadjuvanten Setting als dynamischer Biomarker zum Einsatz kommen, in dem der Ki-67-Status vor Beginn der endokrinen Therapie und vor der Operation bestimmt wird: Sein Verlauf erlaubt Aussagen über Therapieansprechen und Prognose.17
In der kürzlich publizierten Studie POETIC wurde Ki-67 zur Prädiktion des Rezidivrisikos eingesetzt. Postmenopausale Patientinnen mit HR+ Brustkrebs wurden im 2:1-Schema zum perioperativen zweiwöchigen Erhalt eines Aromatasehemmersbzw. Placeborandomisiert. Der Ki-67-Status wurde vor Therapiebeginn und zwei Wochen danach bestimmt und die Ergebnisse miteinander verglichen. Tatsächlich konnte eine Korrelation mit dem Rezidivrisiko nachgewiesen werden: Bei HR+ HER2– Patientinnen, bei denen der Ki-67-Anteil zu beiden Messzeitpunkten niedrig war, betrug das 5-Jahres-Risiko für ein Rezidiv 4,3%; bei denjenigen, bei denen er vor Therapie hoch und dann niedrig war, 8,4%. Patientinnen mit hohem Ki-67-Anteil zu beiden Messzeitpunkten hatten die ungünstigste Prognose – bei ihnen lag das Risiko bei 21,5%.18 Eine weitere Studie zu dieser Thematik ist ADAPT (NCT01779206): In dieser Studie wird unter Berücksichtigung des Ki-67-Abfalls und mittels Oncotype DXTM ermittelten Risikoscores entschieden, ob eine Chemotherapie erforderlich ist.19
Literatur:
1 Gianni L et al.: Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012; 13(1): 25-32 2 Van der Voort A et al.: Three-year follow-up of neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2-blockade for HER2-positive breast cancer (TRAIN-2): a randomized phase III trial. ASCO-Meeting 2020; Abstr. #501 3 Van Ramshorst MS et al.: Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2018; 19(12): 1630-40 4 Von Minckwitz G et al.: Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019; 380(7): 617-28 5 Von Minckwitz G et al.: Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. N Engl J Med 2017; 377(2): 122-131 6 Piccart M et al.: Interim overall survival analysis of APHINITY (BIG 4-11): a randomized multicenter, double-blind, placebo-controlled trial comparing chemotherapy plus trastuzumab plus pertuzumab versus chemotherapy plus trastuzumab plus placebo as adjuvant therapy in patients with operable HER2-positive early breast cancer. SABCS 2019; Abstr. #GS1-04 7 Harbeck N: Emerging strategies in neoadjuvant treatment of patients with HER2-positive early breast cancer. Breast 2019; 48(Suppl 1): S97-102 8 Huober J et al.: Factors predicting relapse in early breast cancer patients with a pathological complete response after neoadjuvant therapy – results of a pooled analysis based on the GBG meta-database. SABCS 2018; Abstr. #P2-08-01 9 Tolaney SM et al.: Seven-year follow-up analysis of adjuvant paclitaxel and trastuzumab trial for node-negative, human epidermal growth factor receptor 2-positive breast cancer. JClin Oncol 2019; 37(22): 1868-75 10 AGO (Kommission Mamma): Diagnostik und Therapie früher und fortgeschrittener Mammakarzinome. Online unter: https://www.ago-online.de/fileadmin/ago-online/downloads/_leitlinien/kommission_mamma/2020/Alle_aktuellen_Empfehlungen_2020.pdf 11 Chan A et al.: Final efficacy results of neratinib in HER2-positive hormone receptor-positive early-stage breast cancer from the phase III ExteNET trial. Clin Breast Cancer 2021; 21(1): 80-91.e7 12 Bardia A et al.: ASCENT: a randomized phase III study of sacituzumab govitecan (SG) vs treatment of physician’s choice (TPC) in patients (pts) with previously treated metastatic triple-negative breast cancer (mTNBC). ESMO-Kongress 2020; Abstr. #LBA17 13 Robson ME et al.: Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N Engl J Med 2017; 377(6): 522-33 14 Fachinformation Olaparib®, Stand: Februar 2020 15 Kemp A, AstraZeneca: IDMC has concluded that OlympiA trial of Lynparza crossed superiority boundary for invasive disease-free survival vs. placebo at planned interim analysis. Online unter: https://www.astrazeneca.com/media-centre/press-releases/2021/olympia-trial-of-lynparza-idmc-recommend-early-analysis.html l 16 Korde LA et al.: Neoadjuvant chemotherapy, endocrine therapy, and targeted therapy for breast cancer: ASCO guideline. J Clin Oncol 2021; doi.org/10.1200/jco.20.03399. Online ahead of print 17 Dowsett M et al.: Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer Working Group. J Natl Cancer Inst 2011; 103(22): 1656-64 18 Smith I et al.: Long-term outcome and prognostic value of Ki67 after perioperative endocrine therapy in postmenopausal women with hormone-sensitive early breast cancer (POETIC): an open-label, multicentre, parallel-group, randomised, phase 3 trial. Lancet Oncol 2020; 21(11): 1443-54 19 West German Study Group: Adjuvant dynamic marker-adjusted personalized therapy trial optimizing risk assessment and therapy response prediction in early breast cancer (ADAPT). Online unter: https://clinicaltrials.gov/ct2/show/NCT01779206
Quelle:
17th St. Gallen International Breast Cancer Conference17.–21. März 2021, virtuell
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...