Immuntherapeutische Erkenntnisse
Autor:
Dr. med. Rouven Müller
Oberarzt meV
Klinik für Medizinische Onkologie und Hämatologie, USZ
Facharzt Hämatologie (FMH) und Allgemeine Innere Medizin (FMH)
FA Hämatologie/Onkologie (D)
Universitätsspital Zürich
E-Mail: rouven.mueller@usz.ch
Ein Highlight des ASH-Kongresses von 2022 waren Präsentationen zu Studien, die immuntherapeutische Ansätze zur Behandlung des multiplen Myeloms behandelten, sei es im zellulären Bereich in Form von CAR-T-Zellen oder im Bereich der bispezifischen Antikörper.
Neben Updates und Subgruppenanalysen zu bereits vorgestellten CAR-T-Zell-Konstrukten wie Idecabtagen Vicleucel (Ide-Cel) und Ciltacabtagen Autoleucel (Cilta-Cel) wurden auch Ergebnisse zu einem dualen, gegen CD19 und BCMA gerichteten CAR-T-Zell-Konstrukt vorgestellt. Dieses CAR-T-Zell-Konstrukt wird mithilfe eines speziellen Produktionsprozesses hergestellt (FasTCAR). Hierbei handelt es sich um eine Methodik, die durch gleichzeitige Transduktion und Aktivierung die CAR-T-Zell-Produktion beschleunigt.
BCMA/CD19 als duale Zielstruktur
Im Rahmen einer multizentrischen Phase-I-Studie wurde dieses Konstrukt bei 17 Patienten mit Erstdiagnose eines multiplen Myeloms und Nachweis eines Hochrisikoprofils nach IMWG(International Myeloma Working Group)-Kriterien eingesetzt.1 Die Gesamtansprechrate betrug 100% mit 82% MRD-negativer, stringenter kompletter Remission (MRD-sCR, bei 14/17 Patienten). Mit einer medianen Nachverfolgungszeit von 8,1 Monaten (1,3–15,4) war die mediane Ansprechdauer am Data-Cut-off im Oktober 2022 noch nicht erreicht.
Hinsichtlich Nebenwirkungen zeigte sich bei fünf von 17 Patienten (29%) ein Zytokinfreisetzungssyndrom (CRS) vom Grad 1–2. Höhergradige Zytokinfreisetzungssyndrome oder eine Neurotoxizität waren nicht nachweisbar.
Es zeigt sich hier in einer sehr frühen Phase der Entwicklung eine beeindruckende Ansprechrate in einem Hochrisiko-Patientenkollektiv mit sehr guter Verträglichkeit in der Erstlinienbehandlung. Zu diesem frühen Zeitpunkt kann die Dauer des Ansprechens noch nicht beurteilt werden. Die Wertigkeit des Einsatzes dieses dualen CAR-T-Zell-Konstrukts gerichtet gegen CD19 und BCMA werden das Follow-up dieser Patienten und Folgestudien zeigen.
Auch wenn CAR-T-Zell-Produkte wie mit oben beschriebener Technologie zügiger hergestellt werden können und damit der gesamte Prozess von der Lymphozytenapherese bis zur Rückgabe des hergestellten Produktes verkürzt wird, bieten bispezifische Antikörper weiterhin den Vorteil der sofortigen Verfügbarkeit.
Diese meist gegen BCMA-CD3 gerichteten bispezifischen Antikörper werden mittlerweile von einer Vielzahl von Herstellern in frühen klinischen Studien untersucht und erreichen in der Regel Gesamtansprechraten zwischen 51% und 83% (vgl. Abstr. #158/#159 für Elranatamab, Abstr. #4555 für REGN5458, Abstr. #1919 für ABBV-383 und Abstr. #162 für Alnuctamab).
MonumenTAL-1: Talquetamab gegen GPRC5D
Wie im vergangenen Jahr wurden auch an diesem ASH-Kongress Daten zur Phase-I/II-Studie MonumenTAL-1 vorgestellt.2 Diese Studie untersucht die Wirksamkeit des bispezifischen, gegen GPRC5D und CD3 gerichteten Antikörpers Talquetamab als Monotherapie bei Patienten mit rezidiviertem und refraktärem multiplem Myelom. GPRC5D ist eine sehr selektiv auf Plasmazellen exprimierte Zielstruktur. Zudem wird es in der Haut, in Hautanhangsgebilden und in der Zunge exprimiert, was auch sein Nebenwirkungsspektrum erklärt.
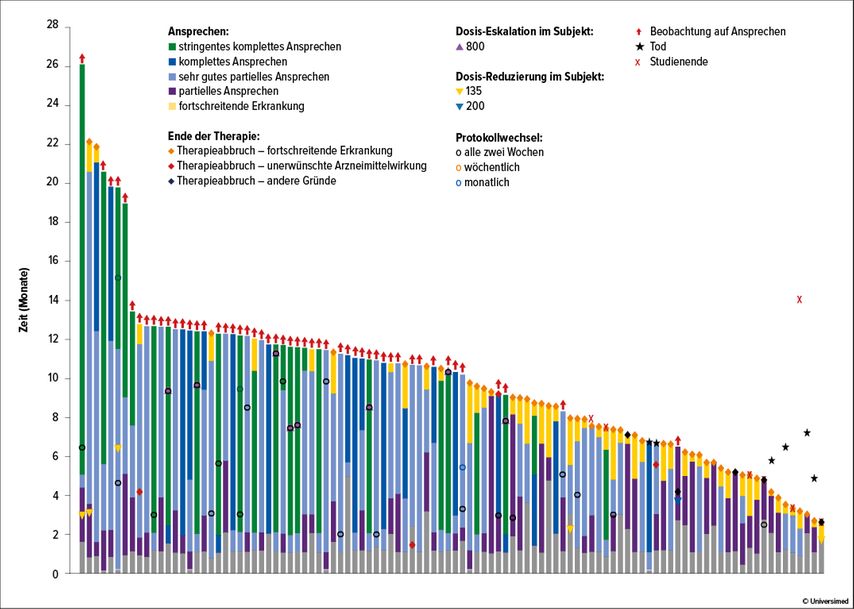
Präsentiert wurden aktualisierte Resultate der MonumenTAL-1-Studie zu den Patienten, die mit den empfohlenen Phase-II-Dosen behandelt (RP2D) wurden, sowie zu einer Kohorte von Patienten, die zuvor mit CAR-T-Zellen und bispezifischen Antikörpern therapiert worden sind (Abb. 1). Beide untersuchten RP2-Dosierungen (0,4mg/kg s.c. qw; 0,8mg/kg s.c. q2w) zeigten eine hohe Gesamtansprechrate von über 70% mit einer medianen Ansprechdauer zwischen neun und 13 Monaten, dies in einem stark vorbehandelten Patientenkollektiv mit im Median fünf vorherigen Therapielinien. Die häufigsten Nebenwirkungen waren CRS, Zytopenien und aufgrund von «On-target off-tumor»-Bindung Nebenwirkungen an Haut und Hautanhangsgebilden und Geschmackssinnveränderungen.
Abb. 1: Ansprechen auf Talquetamab in einer Dosis von 400µg/kg qw in der MonumenTAL-1-Studie. Modifiziert nach Chari A et al. 20222
Optimierte Peripherblutanalytik
Auch im Bereich der Diagnostik wurden interessante Neuerungen vorgestellt – so beispielsweise von einer spanischen Arbeitsgruppe, die das Monitoring der minimalen Resterkrankung (MRD) im peripheren Blut mittels Flowzytometrie untersuchte. Bisher benötigt die MRD-Bestimmung wiederholte invasive Knochenmarkpunktionen. Im Knochenmark ist aufgrund des im Vergleich zum Peripherblut (PB) um Logstufen höheren Tumorzellgehaltes mit der zur Verfügung stehenden Sensitivität der Methodik von «Next Generation Flow»(NGF)-Zytometrie und «Next Generation Sequencing» (NGS) eine MRD-Bestimmung möglich.
Der MRD-Wert ist aufgrund seiner Korrelation mit progressionsfreiem (PFS) und Gesamtüberleben (OS) etabliert. Noch stellen therapeutische Entscheidungen basierend auf der MRD-Diagnostik nicht die Routine in der klinischen Praxis dar. Gegenwärtige klinische Studien untersuchen jedoch verschiedene Fragestellungen der Sequenzierung und die Beendigung therapeutischer Massnahmen basierend auf der Bestimmung der minimalen Resterkrankung.
Beispielhaft seien hier folgende Szenarien genannt:
-
Steuerung der Dosisintensität konsolidierender Therapiemassnahmen
-
Dauer einer Erhaltungstherapie nach Dosisintensivierung mittels Hochdosistherapie und autologem Stammzellersatz
Diese Fragestellungen sind unmittelbar relevant für unsere Patienten, da sie häufig zu behandlungsfreier Zeit nach intensiven Therapiemassnahmen führen können – denn selbst die verträglichsten Erhaltungstherapiestrategien gehen meist noch mit einer relevanten Toxizität und damit Einschränkung der Lebensqualität einher.
Die Arbeitsgruppe untersuchte Probenmaterial von Patienten der GEM2014MAIN-Studie.3 Es wurde nach dem zweiten Jahr unter Erhaltungstherapie Peripherblut asserviert. Bei MRD-Negativität im Knochenmark stoppten die Patienten die Erhaltungstherapie. Falls noch minimale Resterkrankung im Knochenmark nachweisbar war, setzten sie die Erhaltungstherapie für drei weitere Jahre fort.
Der Nachweis von MRD im Peripherblut setzt – wie oben erwähnt – eine sensitivere Methodik voraus, beispielsweise müssen mehr als 2x108 Zellen untersucht werden, um eine Sensitivität von 10–7 zu erreichen. Das entspricht ca. 50ml Peripherblut. Um die damit einhergehenden hohen Kosten (Färbung hoher Blutvolumina, lange Untersuchungszeiten) zu vermeiden, implementierte die Gruppe einen Anreicherungsschritt durch magnetisches Labeling und Separation von Plasmazellen durch fünf verschiedene, mit magnetischen Beads gekoppelte Antikörper, sodass das zu untersuchende Probenvolumen auf 100µl reduziert werden konnte. Daraufhin wurde die Übereinstimmung der Methodik anhand von 389 Proben von 351 verschiedenen Patienten untersucht.
Zunächst wurden Proben von 138 Patienten der GEM2014MAIN-Studie mit konventioneller Flow-Methodik untersucht. Hier zeigte sich bei 15 von 138 Patienten eine positive MRD (12%). Von den verbleibenden 123 Patienten mit negativer MRD im peripheren Blut wiesen 33 (27%) noch eine persistierende minimale Resterkrankung im Knochenmark auf, was die notwendige Steigerung der Sensitivität in der Analytik des peripheren Blutes unterstreicht.
Mit der oben beschriebenen, optimierten Methodik wurden verschiedene gepaarte Knochenmark-/Peripherblut-Proben zu unterschiedlichen Behandlungszeitpunkten analysiert. Mit der optimierten Peripherblutanalytik konnte ein negativer prädiktiver Wert von 77% bezogen auf die Knochenmarkanalytik erreicht werden. Situationen, die mit häufigeren falsch negativen Resultaten im Peripherblut assoziiert waren, waren die MRD-Bestimmung während Induktion und Intensivierung, ein niedriger Zellgehalt im Peripherblut und ein MRD-Gehalt im Knochenmark unter 10–5.
In der Erhaltungsphase der untersuchten GEM2014MAIN-Proben zeigten zwei von vier Patienten mit Nachweis eines positiven MRD-Befundes im peripheren Blut einen Progress, während 29 Patienten mit nicht nachweisbarer Resterkrankung progressionsfrei blieben. Mit der vorgestellten Arbeit wurde eine sensitivere PB-MRD-Methodik etabliert, die ein regelmässiges Monitoring während einer Myelomerhaltungstherapie erlaubt, wenn auch die Nachteile einer Analytik aus dem peripheren Blut mit niedrigerem Tumorzellgehalt nicht vollständig kompensiert werden konnten.
Fazit
Zusammengefasst sollen die drei hier vorgestellten Abstracts für drei wichtige Themen der Therapie des Plasmazellmyeloms in den kommenden Jahren stehen: sowohl für die Optimierung zellbasierter und antikörperbasierter immuntherapeutischer Behandlungsansätze als auch für die individuelle Steuerung der Therapieintensität und -dauer anhand sensitiver, möglichst wenig invasiver Massnahmen zur Beurteilung des Therapieansprechens.
Literatur:
1 Du J et al.: Phase I open-label single-arm study of BCMA/CD19 dual-targeting FasTCAR-T cells (GC012F) as first-line therapy for transplant-eligible newly diagnosed high-risk multiple myeloma. ASH 2022; Abstr. #366 2 Chari A et al.: Talquetamab, a G protein-coupled receptor family C group 5 member D x CD3 bispecific antibody, in patients with relapsed/refractory multiple myeloma (RRMM): phase 1/2 results from MonumenTAL-1. ASH 2022; Abstr. #157 3 Puig N et al.: Clinical impact of next generation flow in bone marrow vs qip-mass spectrometry in peripheral blood to assess minimal residual disease in newly diagnosed multiple myeloma patients receiving maintenance as part of the GEM2014MAIN trial. ASH 2022; Abstr. #866
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...