Immunhistochemie in der Mammapathologie: HER2 und PD-L1
Autorin:
Assoc. Prof. Priv.-Doz. Dr. Zsuzsanna Bagó-Horváth
Klinisches Institut für Pathologie
Medizinische Universität Wien
Immunhistochemische Untersuchungen sind seit langer Zeit unverzichtbarer Bestandteil der pathologischen Diagnostik. Während aber in der Vergangenheit diese Untersuchungen in erster Linie dazu dienten, die Herkunft von neoplastischen Zellen zu bestimmen, wurden in den vergangenen Jahren neue immunhistochemische Methoden etabliert, mit denen die Wirksamkeit biologischer, zielgerichteter Therapien vorhergesagt werden kann. Im Rahmen dieser Untersuchungen rückt eine genauere Quantifizierung des Zielproteins statt der bisher angewendeten semiquantitativen Bestimmung immer mehr in den Fokus.
Keypoints
-
Die Bestimmung von neuen prädiktiven Biomarkern wie einer PD-L1- und einer niedrigen HER2-Expression für zielgerichtete Therapien basiert auf einer exakten Quantifikation der Expression nach definierten Kriterien.
-
Die derzeitigen Cut-off-Werte könnten je nach Studienlage neu definiert werden.
-
Es existieren derzeit keine validierten mRNS-basierten Analyseoptionen für diese beiden Biomarker.
-
Eine digitale Bildanalyse und künstliche Intelligenz wären für eine exakte Bestimmung hilfreich, leider ist die diesbezügliche Ausstattung in den meisten Pathologieinstituten verbesserungswürdig.
-
Genaue Analysen in klinischen Studien und in Real-Life-Settings könnten weitere Evidenz liefern.
Neue Aspekte eines „alten“ Biomarkers: HER2
Der Wachstumsfaktorrezeptor HER2 ist ein lang bekannter und gut charakterisierter prognostischer Faktor. Die immunhistochemische Bestimmung der Expression von HER2 gilt immer noch als Goldstandard der Indikationsstellung für HER2-gerichtete Therapien. Mit der Entwicklung neuartiger Antikörper-Wirkstoff-Konjugate hat sich das Wirkungsspektrum der Anti-HER2-Therapien wesentlich verbreitert: Die Ergebnisse der Studie DESTINY-Breast04 zeigen, dass Patient:innen mit metastasierten Tumoren mit einer niedrigen HER2-Expression ohne nachgewiesene HER2-Genamplifikation auch von einer Therapie mit dem Antikörper-Wirkstoff-Konjugat Trastuzumab Deruxtecan profitieren.1 Dies stellt Patholog:innen vor neue Herausforderungen.
Trastuzumab Deruxtecan besteht aus zwei Komponenten: Ein gegen HER2 gerichteter monoklonaler Antikörper trägt mithilfe eines spaltbaren Linkers mehrere Moleküle eines hochpotenten Zytostatikums, eines Topoisomerase-I-Inhibitors. Nach erfolgter Aufnahme in die Tumorzelle wird die zytotoxische Substanz freigesetzt und wirkt nicht nur gegen die Targetzelle, sondern auch gegen die umliegenden Tumorzellen im Rahmen eines „Bystander“-Effektes (Abb. 1).Diese Wirkung macht auch Tumoren mit einer niedrigen HER2-Expression und ohne Genamplifikation empfindlich gegenüber dem Konjugat.
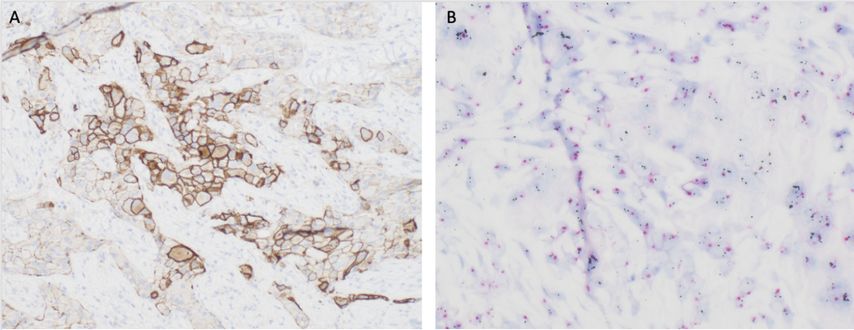
Abb. 1: Eine heterogene immunhistochemische Expression von HER2 (A, Ventana 4B5 Klon) zeigt sich auch in der heterogenen Verteilung einer HER2-Amplifikation (B, Chromogen-in-situ-Hybridisierung, PathVysion, Abbott)
Neben der Bestimmung der bisher relevanten amplifizierten Fälle, die sich immunhistochemisch als 3+ oder 2+ mit nachfolgender In-situ-Hybridisierung darstellten, sind wir nun angehalten, auch eine niedrige HER2-Expression in zumindest 10% der Tumorzellen zu erkennen und zu quantifizieren. Retrospektive Studien zeigen, dass die Konkordanz der Befunde in diesem Bereich niedriger ist als bei hoher HER2-Expression. Es ist aber zu erwarten, dass mit zunehmender Erfahrung der Befunder:innen die Konkordanz bei nicht amplifizierten Fällen ebenfalls besser wird.2
Demnach wurden die Richtlinien für die HER2-Bestimmung entsprechend adaptiert, obwohl keine neuen Kategorien geschaffen wurden.3 Der klinisch weitverbreitete Begriff der „HER2-low“-Tumoren fand keinen Eingang in die aktuellen ASCO/USCAP-Richtlinien, obwohl die prozentuelle Angabe der positiven Tumorzellen auch bei niedriger HER2-Expression (bisherige Kategorie „1+“) gefordert wird.
Eine weitere Hilfestellung bei diesen Fällen stellt die sogenannte „Objektiv-Regel“ dar. Diese Regel besagt, dass sich unterschiedliche Färbeintensitäten am einfachsten mit der Verwendung bestimmter Objektive lichtmikroskopisch bestimmen lassen: „3+“-Fälle sind in der kleinsten Vergrößerung mit einem 4x-Objektiv erkennbar, „2+“-Fälle lassen sich in der mittleren Vergrößerung mit 10x- und 20x-Objektiven identifizieren und „1+“-Fälle sind lediglich in einer großen Vergrößerung mit einem 40x-Objektiv bestimmbar. Unter Anwendung dieser Empfehlungen lassen sich die meisten Fälle diagnostisch eindeutig einordnen.4
Die aktuelle Datenlage wirft aber auch Fragen auf: So basiert der aktuelle Schwellenwert von 10% positiven Tumorzellen auf den derzeit gültigen ASCO/USCAP-Richtlinien. Die Frage „How low is low?“ kann nicht mit letzter Sicherheit beantwortet werden: Stellt eine noch geringere Anfärbbarkeit ebenfalls eine Therapieindikation für Trastuzumab Deruxtecan dar? Die derzeit zertifizierten Reagenzien sind ebenfalls nicht optimal, um eine niedrige HER2-Expression zu detektieren. Mithilfe von anderen, fluoreszenzbasierten Methoden könnte die Sensitivität der HER2-Bestimmung erhöht werden.6
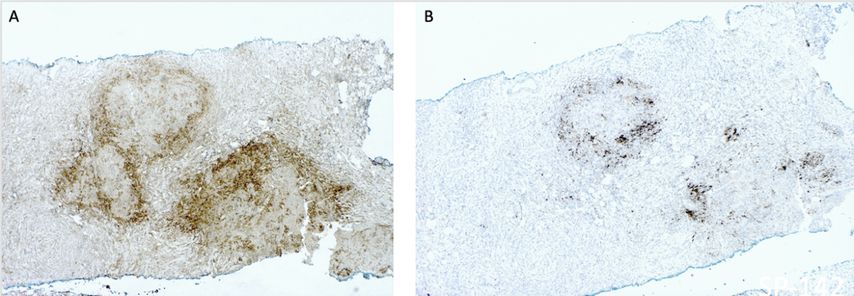
Abb. 2: PD-L1-Immunhistochemie mittels „Combined Positive Score“ (A, CPS, Nordic Biosite BSR90 Klon) und mittels Immunoscore (B, Ventana SP142 Klon) bei einem tripelnegativen Mammakarzinom
Eine weitere Unklarheit bedeutet auch die intratumorale Heterogenität: Aktuelle Empfehlungen betonen die Wichtigkeit serieller Biopsien beim metastasierten Mammakarzinom, obwohl erste Studienergebnisse zeigen, dass die HER2-Expression mit zunehmender Krankheitsdauer abnimmt. Bisher konnte keine molekularpathologische Untersuchung (Genexpressionsanalyse, Sequenzierung) entwickelt werden, die die immunhistochemische Bestimmung einer niedrigen HER2-Expression rekapitulieren könnte.
Eine vielversprechende Entwicklung bietet die digitale Pathologie: Digitale Systeme sind dem menschlichen Auge deutlich überlegen, wenn es auf genaue Quantifizierung von Signalen ankommt. So konnte die Treffsicherheit der HER2-Bestimmung mittels digitaler Bildanalyse verbessert werden, das beste Ergebnis lieferte aber der kombinierte Einsatz von geschulten Patholog:innen und digitalen Systemen.6 Mithilfe von künstlicher Intelligenz ist es auch möglich, die Verteilung der HER2-Expression auf Einzelzellebene räumlich zu modellieren und somit eine bessere Darstellung der potenziellen zytotoxischen Wirkung von Antikörper-Wirkstoff-Konjugaten zu gewinnen.
Zielgerichtete Immuntherapie: PD-L1- und Immuncheckpoint-Inhibition
Ein weiteres Einsatzgebiet prädiktiver immunhistochemischer Untersuchungen ist die Bestimmung der PD-L1-Expression als Therapieindikation beim metastasierten tripelnegativen Mammakarzinom (TNBC). PD-L1-exprimierende Tumoren können durch die Expression von Immuncheckpoint-assoziierten Molekülen die Reifung und Aktivierung von zytotoxischen T-Lymphozyten und natürlichen Killerzellen unterdrücken, womit ein „Immune-escape“-Mechanismus entsteht. Mithilfe von Immuncheckpoint-Inhibitoren lässt sich diese Unterdrückung aufheben und die Antitumor-Immunantwort in Gang setzen.
Mehrere Studien zeigen, dass eine Kombinationstherapie mit sowohl PD-1- als auch PD-L1-Inhibitoren die Wirksamkeit einer Chemotherapie bezüglich progressionsfreien und Gesamtüberlebens bei Patient:innen mit metastasiertem TNBC verbessert.7,8 Der Therapiebenefit besteht allerdings nur bei Tumoren, die PD-L1 entweder in den Tumorzellen oder in den tumorinfiltrierenden Lymphozyten exprimieren. Bei de novo diagnostizierten Metastasen eines tripelnegativen Mammakarzinoms wird eine Reflextestung der PD-L1-Expression mittels „Combined Positive Score“ (CPS) und Immunoscore (IC) dringend empfohlen.
Je nach ausgewähltem Wirkstoff erfolgt die PD-L1-Bestimmung mit unterschiedlichen Methoden: Bei einer Therapie mit Pembrolizumab wird beim Mammakarzinom der CPS bestimmt, wobei die Expression sowohl in den Tumorzellen als auch in den Immunzellen mittels oben stehender Formel berücksichtigt wird (Abb. 3).
Abb. 3: Formel zur CPS-Bestimmung mit Berücksichtigung der PD-L1-Expression in Tumorzellen und Immunzellen
Bei einer geplanten Therapie mit Atezolizumab wird der prozentuelle Flächenanteil des Tumors angegeben, der von PD-L1-exprimierenden Immunzellen eingenommen wird, das ist der Immunoscore. Diese beiden Methoden können voneinander abweichende Ergebnisse liefern, wobei in etwa 30% der Fälle ein konkordantes positives Ergebnis vorliegt. Die prädiktive Wertigkeit der beiden Untersuchungsmethoden bleibt aber substanzspezifisch: Nur ein positiver IC ist prädiktiv für das Ansprechen auf Atezolizumab und nur ein CPS ≥10 kann den Benefit einer Behandlung mit Pembrolizumab vorhersagen.
Im Gegensatz zum metastasierten Setting verliert die PD-L1-Immunhistochemie ihre prädiktive Wertigkeit in der neadjuvanten Behandlungssituation: Die Rate an pathologisch kompletten Remissionen ist erhöht nach einer neoadjuvanten Therapie mit Immuncheckpoint-Inhibitoren, unabhängig von der PD-L1-Expression.9
Die Intra- und Interobserver-Konkordanz zwischen Befunder:innen ist insgesamt gut, mit Kappa-Werten >0,7. Ein Problem stellt der niedrige Schwellenwert der Positivität dar: Im unteren Bereich, bei Fällen mit etwa 1% IC, können unterschiedliche Ergebnisse beobachtet werden.10
Auch bei PD-L1 existiert keine alternative molekularpathologische Methode, die die Immunhistochemie ersetzen könnte. Digitale Algorithmen wären aber in der Lage, die Ergebnisse einer PD-L1-Bestimmung mittels Immunhistochemie zu verbessern. Vor allem bei großen Tumorproben könnte die Digitalisierung Abhilfe schaffen und die Befundung effizienter und schneller gestalten. Der flächendeckende Einsatz solcher Systeme ist allerdings leider in den meisten Pathologieinstituten noch Zukunftsmusik.
Literatur:
1 Modi S et al.: Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022; 387(1): 9-20 2 Fernandez AI et al.: Examination of low ERBB2 protein expression in breast cancer tissue. JAMA Oncol 2022; 8(4): 1-4 3 Wolff AC et al.: Human Epidermal Growth Factor Receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Arch Pathol Lab Med 2018; 142(11): 1364-82 4 Denkert L et al.: New treatment options for metastatic HER2-low breast cancer: consequences for histopathological diagnosis. Pathologie (Heidelb) 2022; 43(6): 457-66 5Moutafi M et al.: Quantitative measurement of HER2 expression to subclassify ERBB2 unamplified breast cancer. Lab Invest 2022; 102(10): 1101-8 6 Yue et al.: Can AI-assisted microscope facilitate breast HER2 interpretation? Amulti-institutional ring study. Virchows Archiv 2021; 479: 443-9 7 Cortes J et al.: Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020; 396(10265): 1817-28 8 Emens LA et al.: First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer: IMpassion130 final overall survival analysis. Ann Oncol 2021; 32(8): 983-93 9 Schmid P et al.: Event-free survival with pembrolizumab in early triple-negative breast cancer. N Engl J Med 2022; 386: 556-67 10 Hoda RS et al.: Interobserver variation of PD-L1 SP142 immunohistochemistry interpretation in breast carcinoma: a study of 79 cases using whole slide imaging. Arch Pathol Lab Med 2021; 145(9): 1132-7
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...