HPV-Impfung und -Testung: der Anfang vom Ende des Zervixkarzinoms
Autor:
Univ.-Prof. Dr. Peter Hillemanns
Direktor der Klinik für Frauenheilkunde und Geburtshilfe
Medizinische Hochschule Hannover
E-Mail: Hillemanns.Peter@MH-Hannover.de
Der Entwicklung eines Zervixkarzinoms liegt fast immer eine Infektion mit humanen Papillomviren vom Hochrisiko-Typ (HPV) zugrunde. Glücklicherweise können seit Einführung und Etablierung der HPV-Impfung und -Testung viele Krebsfälle verhindert werden. Ein Überblick über den Status quo der Prävention des Zervixkarzinoms.
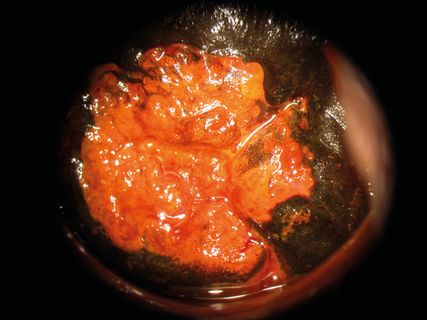
Abb. 1: Kolposkopie eines Mikrokarzinoms IA2 4x6mm im 3. Quadranten neben einer ausgedehnten CIN 3 (nach Schiller’scher Jodprobe)
Das Zervixkarzinom wird in bis zu 99,8% der Fälle durch eine Infektion mit humanen Papillomviren vom Hochrisiko-Typ (HPV) verursacht. Eine persistierende Infektion mit HPV ist eine notwendige Voraussetzung für die Entstehung des Zervixkarzinoms. Rund 14 Hochrisiko-HPV-Typen können den Gebärmutterhalskrebs auslösen – darunter die HPV-Typen 16 und 18, die für die Entstehung von etwa 70% der weltweiten Fälle von Gebärmutterhalskrebs verantwortlich sind. Im Verlauf der Infektion werden Onkoproteine (E6, E7) freigesetzt, die wichtige zelluläre Regulationsproteine mit hoher Affinität neutralisieren können. Die Latenzzeit zwischen initialer HPV-Infektion und invasivem Karzinom beträgt durchschnittlich 15 bis 30 Jahre und unterschreitet – lautmolekularbiologischen und epidemiologischen Untersuchungen – offensichtlich nie einen minimalen Zeitraum von 7–8 Jahren. Mehr als die Hälfte der Frauen durchlaufen während ihres Lebens eine HPV-Infektion, aber nur in einigen Fällen entwickelt sich daraus ein Karzinom (Abb. 1).
Die HPV-Impfung und der HPV-Nachweis stellen Meilensteine in der Prävention des Zervixkarzinoms dar. Nach mehr als 50 Jahren opportunistischen Screenings in jährlichen Intervallen mit dem zytologischen Test wurde die Umstellung auf den molekularbiologischen Nachweis von HPV-DNA in den meisten Industrieländern eingeleitet. Weltweit erkranken jährlich über 500000 Frauen – in Deutschland circa 4500 Frauen – an Gebärmutterhalskrebs, vorwiegend in den Entwicklungsländern.
Neben dem verbesserten Hygienestandard konnte die Einführung des zytologischen Krebsabstrichs die Inzidenz und Mortalität des Zervixkarzinoms um 60–70% senken. Allerdings müssen weiterhin noch viele Operationen am Muttermund (Konisation) bei hochgradigen Dysplasien (zervikale intraepitheliale Neoplasie [CIN] 2–3) durchgeführt werden, um eine Progression zum Zervixkarzinom zu verhindern. Rechtzeitig erkannt, ist die Vorstufe des Gebärmutterhalskrebses heilbar.
HPV-Impfungen zur Prävention von Neoplasien und Genitalwarzen
Alle drei Impfstoffe (bi-, tetra- und nonavalent) sind sicher und gut verträglich. Sie sind seit 2006 bzw. seit 2016 (der Neunfachimpfstoff) verfügbar, und zwar für Mädchen und Jungen ab 9 Jahren. Präventive HPV-Vakzine bestehen aus gentechnisch hergestellten leeren HP-Virushüllen („virus-likeparticles“, VLP). Außer lokalen Reaktionen und Fieber traten bei mehr als 270 Millionen Impfdosen sonstige Nebenwirkungen und Krankheiten nicht häufiger auf als bei gleichaltrigen nicht geimpften Mädchen und Frauen.
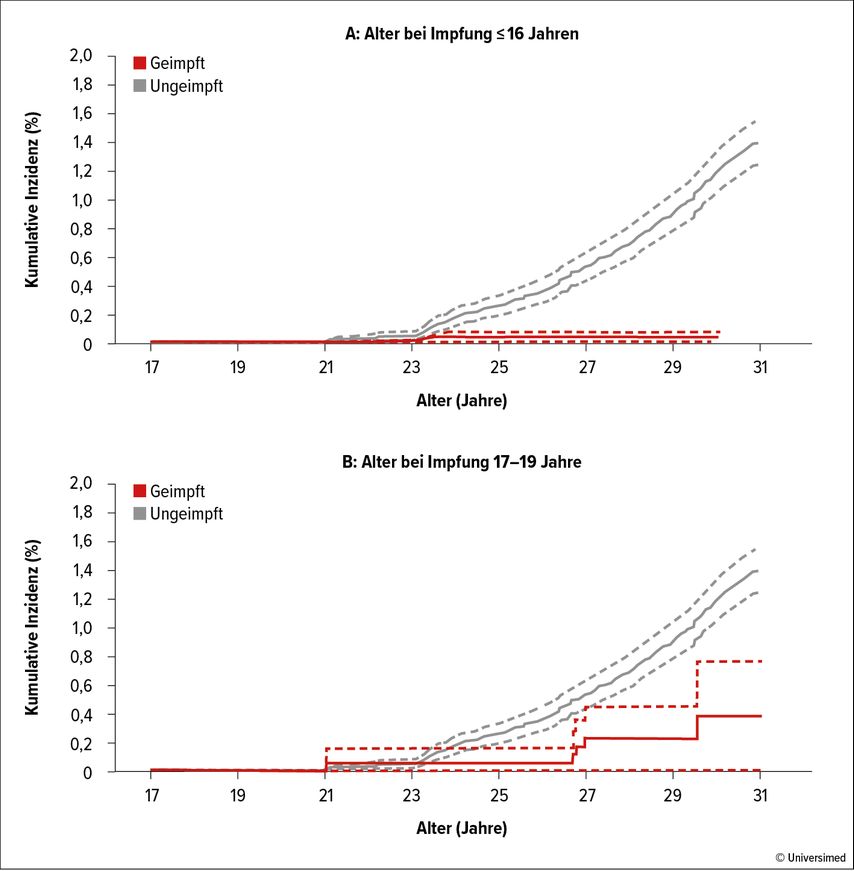
In einer dänischen Registerstudie wurde die Wirksamkeit der HPV-Impfung gegenüber Gebärmutterhalskrebs bestimmt. Die Studie umfasste 870000 Frauen im Alter von 17 bis 30 Jahren, die von Oktober 2006 bis Dezember 2019 in Dänemark lebten. 36,3% wurden im Alter ≤16 Jahren geimpft, und 19,3% bzw. 2,3% wurden mit 17–19 bzw. 20–30 Jahren geimpft. Bei Frauen, die bis zum Alter von 16 Jahren bzw. mit 17–19 Jahren geimpft wurden, waren die Inzidenzraten des Zervixkarzinoms um 86% bzw. um 68% im Vergleich zu ungeimpften Frauen verringert (Abb. 2), aber nicht bei den Frauen, die im Alter von 20–30 Jahren geimpft wurden. Dies weist auf die Bedeutung des jungen Alters bei der Impfung hin. Nach den bisher vorliegenden Daten ist für die 2v- und 4v-HPV-Impfungeine Langzeiteffektivität von mehr als 15 Jahren belegt. Bisher liegen auch keine Anzeichen für ein Nachlassen der Effektivität und die Notwendigkeit einer Auffrischungsimpfung vor. Computersimulationsmodelle gehen von einer Langzeiteffektivität von deutlich über 20 Jahren aus, eventuell sogar lebenslang.
Bisher gibt es keine Belege für ein sogenanntes Replacement, also eine Zunahme anderer HPV-Typen bei geimpften Personen. Dies ist erfreulich, da dann auch keine verzögerte Wiederzunahme an Zervixkarzinomen zu erwarten ist.
Abb. 2: Kumulative Inzidenz des Zervixkarzinoms für Frauen, die im Alter von(A)≤16 Jahren und (B) im Alter von 17–19 Jahren geimpft wurden. Modifiziert nach Kjaer SK et al. (J Natl Cancer Inst 2021)
Wie viele Dosen braucht es?
Der aktuelle Standard einer HPV-Impfung junger Mädchen und Knaben mit lediglich zwei Gaben hatte sich aus Studien ergeben, in denen auch Teilnehmer mit weniger als drei Gaben einen guten Schutz vor in den Impfstoffen enthaltenen HPV-Typen aufwiesen. Eine HPV-Impfdosis hatte in diesen Studien bei der Vorbeugung hochgradiger Dysplasien eine vergleichbare Wirksamkeit wie zwei oder drei Dosen. Diese Ergebnisse stützen die Hypothese, dass eine 1-Dosis-Impfung eine praktikable Strategie sein könnte. Für Entwicklungsländer wäre es hochinteressant, wenn auch nach einer einzigen HPV-Impfung ein guter Schutz erreicht wird. Erfreulicherweise laufen derzeit für eine Zulassung formal notwendige randomisierte Studien zur Bewertung der Wirksamkeit und Immunogenität einer Einzeldosis im Vergleich zu 2-Dosen-Regimen.
Zwar konnte bei den o.g. HPV-Impfstoffen keine therapeutische Wirkung erzielt werden. Aber es gibt gute Hinweise, dass bei geimpften Frauen vor/nach Konisation wegen CIN 2+ im Verlauf seltener Rezidive, aber auch weniger extrazervikale Präkanzerosen auftraten. Allerdings müssen auch bei dieser Fragestellung noch prospektiv-randomisierte Studien abgewartet werden. In dem Kontext ist weiterhin bemerkenswert, dass die HPV-Impfung die Frühgeburtsrate zu reduzieren scheint, insbesondere die Rate der extremen Frühgeburten unter der 32. SSW, wenn Morbidität und Mortalität am höchsten sind.
Primärscreening mit HPV-Test und/oder Zytologie
Eine persistierende Infektion mit ein und demselben HR-HPV-Typ stellt die Voraussetzung für eine virusbedingte Entstehung des Zervixkarzinoms und seiner Vorstufen dar. Als primärer Vorsorgetest führte die HPV-Testung allein oder in Kombination mit der Zytologie zu einer signifikant besseren Detektion von CIN3+ (um 48%) und zu einer ebenfalls signifikant besseren Prävention des invasiven Zervixkarzinoms (um 71%) in Studien mit insgesamt über 450000 Frauen. Dies ist eine Kernaussage der S3-Leitlinie und des IQWiG(Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen)-Berichts zur HPV-Testung.
Ein HPV-basiertes Screening eignet sich am besten für gut organisierte, bevölkerungsbasierte Screeningprogramme. Dem Auftreten von transienten HPV-Infektionen (Prävalenz <30 Jahren über 20%; ab 35 Jahren <7%) und der höheren Rate der Spontanheilung bei jungen Frauen sowie dem Anstieg der Persistenzrate ab 30 Jahren wird durch unterschiedliche Intervalle des Primärscreenings für Frauen bis/ab 35 Jahren Rechnung getragen.
Das Risiko für eine CIN 3 oder ein Zervixkarzinom (CIN 3+) sollte im Fall eines negativen Screeningtests hinreichend niedrig sein, damit die Frauen bedenkenlos wieder ins normale Screeningprogramm, z.B. bei HPV-basierten Tests nach 3–5 Jahren, zurückkehren können. Auf der anderen Seite sollte das Risiko für eine CIN 3+ möglichst hoch sein, wenn der Screeningtest positiv ausfällt (positiver Vorhersagewert, PPV), um dann eine kolposkopische Untersuchung mit Histologiegewinnung einzuleiten. Ist der PPV nicht hoch genug, dann ist ein weiterer differenzialdiagnostischer Test notwendig bzw. eine Kontrolle nach 6 bis 12 Monaten.
Ein einheitlicher Abklärungsalgorithmus ist ein wichtiger Bestandteil des organisierten Screeningprogramms. Für Frauen unter 30–35 Jahren wird weiterhin eine zytologische Untersuchung mittels Pap-Test in Abständen von mind. einem Jahr angeboten, während Frauen ab 35 Jahren in Deutschland alle 3 Jahre eine Ko-Testung aus Pap-Test und HPV-Testung angeboten wird.
Das Problem der Nichtteilnahme ander Vorsorge
Die Nichtteilnahme am Screening ist ein Hauptrisikofaktor für Gebärmutterhalskrebs. Die Selbstabnahme von vaginalen Abstrichen zur HPV-Testung kann eine Alternative zu wiederholten Einladungen für Nichtteilnehmerinnen sein. Mehrere Studien kamen zu dem Schluss, dass die Teilnahme unter Nichtteilnehmerinnen signifikant zunimmt, wenn Kits zur Selbstabnahme für HPV angeboten werden. Die Teilnahmequoten sind jedoch sehr unterschiedlich, und daher werden Pilotversuche zur Bestimmung der optimalen Implementierungsstrategie vor der routinemäßigen Einführung empfohlen.
Einige Länder wie Schweden und die Niederlande haben die Selbstuntersuchung als einzige effektive Möglichkeit, um Nichtteilnehmerinnen zu erreichen, in ihr Vorsorgeprogramm aufgenommen.
Ausblick
Bei der HPV-Impfung sollte eine Impfrate von mindestens 80% angestrebt werden. Schulimpfungen haben sich als sehr effektiv erwiesen, um dies zu erreichen. Eine weitere Strategie wäre das Herabsetzen des Impfalters auf 5 Jahre – ein Alter mit guten Impfquoten.
Die Einführung einer HPV-basierten Vorsorgeuntersuchung mit oder ohne Zytologie für Frauen ab 35 Jahren bzw. in einigen Ländern ab 30 Jahren wird zu einer weiteren Senkung derRate an Zervixkarzinomerkrankungen führen. Die internationalen Vorsorgeprogramme werden sich zukünftig an dem Status „HPV-Impfung“ orientieren und ein risikobasiertes Konzept für die „Verylowrisk“-Kollektive empfehlen.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...