Eine Ära der Hoffnung in der Therapie des SCLC
Autor:
Rami Manochakian, MD, FASCO
Hematology/Oncology Division
Mayo Clinic Comprehensive Cancer Center
Jacksonville/Florida, USA
Dank rezenter Fortschritte im Management des kleinzelligen Lungenkarzinoms verbessern sich nun endlich die Aussichten für Patient:innen mit dieser Erkrankung, die bekanntermassen eine äusserst ungünstige Prognose hat.
Die Therapie des kleinzelligen Lungenkarzinoms (SCLC) orientiert sich im ersten Schritt daran, ob die Erkrankung im limitierten (LS-SCLC) oder fortgeschrittenen Stadium (ES-SCLC) vorliegt.
Management des LS-SCLC
Bei den meisten Patient:innen mit LS-SCLC besteht die Standardbehandlung in der konkomitanten Chemoradiotherapie gefolgt von einer Konsolidierung mit Durvalumab über zwei Jahre. Hier hat die Landmark-Studie ADRIATIC unter Durvalumab im Vergleich zu Placebo eine klinisch relevante und statistisch signifikante Verlängerung des Gesamtüberlebens (OS) gezeigt (median: 55,9 vs. 33,4 Monate; HR: 0,73).1 Aktuelle Forschungen widmen sich der Frage, auf welche Weise zirkulierende Tumor-DNA (ctDNA) zur Steuerung der Immuntherapie bei LS-SCLC herangezogen werden könnte. In einer am WCLC 2025 präsentierten Studie erwies sich der ctDNA-Status als prognostisch sowie prädiktiv für den Benefit der Immuncheckpoint-Inhibition.2
Bei einem kleinen Prozentsatz der Patient:innen mit LS-SCLC stellt die chirurgische Resektion eine Option dar, wenn ein Stadium T1 oder T2 ohne Lymphknotenbefall (N0) vorliegt. Im Anschluss wird eine adjuvante Chemotherapie mit Platin/Etoposid empfohlen. Bei positivem Lymphknotenstatus soll eine Chemoradiatio zur Anwendung kommen.
Erstlinienstrategien bei ES-SCLC
Beim ES-SCLC stellt die Kombination aus Chemotherapie (Platin/Etoposid) und Immuntherapie (Atezolizumab oder Durvalumab) gefolgt von einer Immun-Maintenance unverändert die Standard-Erstlinienoption dar. Der Nutzen der Zugabe von Immuncheckpoint-Inhibitoren zur Chemotherapie wurde in den Studien IMpower-133 und CASPIAN nachgewiesen.3,4 Langzeitüberlebensdaten aus der IMbrella-A-Studie zeigen eine Fünf-Jahres-OS-Rate von 12% unter Atezolizumab plus Chemotherapie.5
Rezent wurde in der IMforte-Studie die Zugabe von Lurbinectedin zur Atezolizumab-Erhaltung nach Chemoimmuntherapie geprüft. Im Vergleich zu Atezolizumab allein verlängerte die Kombination sowohl das progressionsfreie Überleben (median: 5,4 vs. 2,1 Monate; HR: 0,54) als auch das OS (13,2 vs. 10,6 Monate; HR: 0,73).6 Trotz dieser vielversprechenden Resultate herrscht bei vielen die Meinung vor, dass der OS-Vorteil nur mässig und durch eine erhöhte Toxizität erkauft ist sowie zulasten der Lebensqualität von Patient:innen geht, die gerade vier Zyklen einer aggressiven Chemotherapie hinter sich gebracht haben. Behandlungsassoziierte Nebenwirkungen (AE) der Grade 3/4 traten unter der Kombination signifikant häufiger auf (25,6% vs. 5,8%), ebenso schwerwiegende AE (31,0% vs. 17,1%). Auch waren Patient:innen mit Hirnmetastasen aus der Studie ausgeschlossen. Angesichts all dieser Aspekte kann die Zugabe von Lurbinectedin zur Erstlinien-Erhaltungsimmuntherapie als adäquate Option bei bestimmten Patient:innen, die dafür infrage kommen, diskutiert werden.
Zweitlinientherapie des ES-SCLC: Tarlatamab als Standard
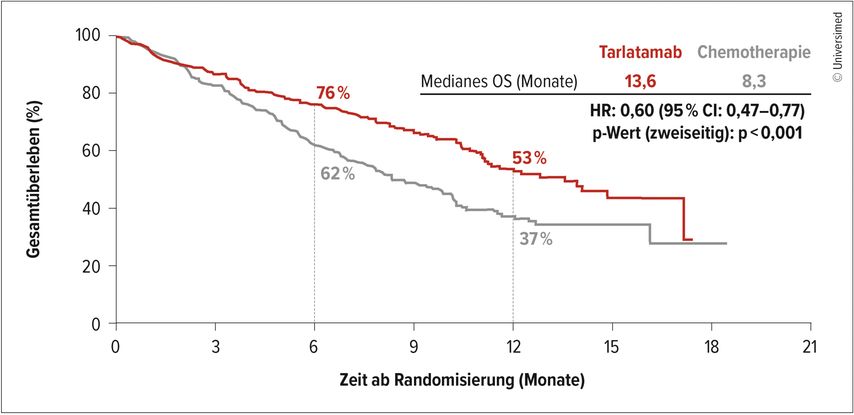
Im Zweitlinien-Setting stellt eine Platin-Etoposid-Rechallenge eine mögliche Strategie dar, speziell nach einem langen progressionsfreien Intervall im Anschluss an die Erstlinien-Chemotherapie. Jedoch hat sich Tarlatamab zunehmend als bevorzugte Standardtherapie und eine der effektivsten Optionen positioniert. Tarlatamab wurde als erster bispezifischer T-Zell-Engager für die Behandlung des SCLC zugelassen. Die pivotale DeLLphi-304-Studie erbrachte eine signifikante Verlängerung des OS unter Tarlatamab im Vergleich zur Chemotherapie mit einem Unterschied von fünf Monaten (13,6 vs. 8,3 Monate; HR: 0,60; Abb. 1) sowie häufigere und längere Remissionen.7 Zudem wurden signifikante Verbesserungen in Bezug auf Dyspnoe und Husten beobachtet, was bei diesen stark symptomatischen Patient:innen ins Gewicht fällt. Das Sicherheitsprofil von Tarlatamab war generell günstiger als jenes der Chemotherapie; allerdings können einige spezifische AE auftreten, die besonderes Augenmerk erfordern, darunter das Zytokin-Release-Syndrom (CRS) und das Immuneffektorzell-assoziierte Neurotoxizitätssyndrom (ICANS). Der Grossteil dieser Ereignisse wurde in der Studie als Grad 1 oder 2 eingestuft. Eine engmaschige Überwachung in adäquaten medizinischen Einrichtungen ist während der ersten Zyklen erforderlich (die meisten Patient:innen erhielten die ersten Zyklen im stationären Setting).
Abb. 1: Primärer Endpunkt der DeLLphi-304-Studie: Überlebensvorteil unter Tarlatamab vs. Chemotherapie (modifiziert nach Rudin et al.)7
Vor dem Hintergrund der im Zweitlinien-Setting dokumentierten Effektivität von Tarlatamab wird die Substanz nun zu einem früheren Zeitpunkt evaluiert (Erhaltung, Erstlinie). In der Phase-Ib-Studie DeLLphi 303 bedingte Tarlatamab plus Immuntherapie als Maintenance nach 4–6 Zyklen einer Chemoimmun-Induktion ein beeindruckendes medianes OS von 25,3 Monaten.8 Die Gesamtansprechrate (ORR) betrug 24%, und das Ansprechen hielt im Median 16,6 Monate an. 60% der Patient:innen erreichten eine Krankheitskontrolle. Eine wichtige Beobachtung bezieht sich auf das Ausbleiben neuer Sicherheitssignale. Aktuell werden weitere gegen DLL-3/CD3 gerichtete bispezifische T-Zell-Engager sowie auch trispezifische Antikörper untersucht.
ADC beim SCLC
Antikörper-Wirkstoff-Konjugate (ADC) etablieren sich zunehmend als neue Medikamentenklasse. Bei einigen Krebsarten existieren bereits Zulassungen, und in der Therapie des SCLC werden die Substanzen aktiv erforscht. Die Pipelines enthalten eine Reihe an Wirkstoffen, die unter anderem an B7H3, DLL3 und TROP2 ansetzen, während die Payload in der Regel Topoisomerase I ist. Das B7H3-gerichtete ADC Ifinatamab Deruxtecan (I-DXd) hat in der Phase-II-Studie IDeate-Lung01 vielversprechende Ansprechraten in späteren Linien gezeigt.9 I-DXd 12mg/kg bewirkte in der Zweitlinie eine ORR von 56,3% und ein medianes OS von 12,0 Monaten. Therapieassoziierte AE waren überwiegend hämatologischer und gastrointestinaler Natur und meist geringgradig (Grad 1 oder 2). Allerdings traten interstitielle Lungenerkrankungen (ILD)/Pneumonitiden mit einer Inzidenz von 12,4% auf.
Eine weitere multizentrische, offene Phase-I-Studie evaluierte den DLL3-gerichteten ADC SHR-4849 beim metastasierten, DLL3-exprimierenden SCLC und anderen neuroendokrinen Karzinomen nach Progression oder Rezidiv im Anschluss an eine Standardtherapie.10 Die mit SHR-4849 ≥2,4mg/kg in der Zweitliniensituation erzielte ORR betrug 77,1%, was das enorme Potenzial dieser Medikamente vor Augen führt. AE sind jedoch ein Thema, da sich in 52,0% Ereignisse der Grade ≥3 manifestierten.
Beim SCLC scheinen ADC in späteren Linien im Allgemeinen mit höheren Ansprechraten und einer längeren Ansprechdauer einherzugehen als Chemotherapien. Derzeit ist nicht bekannt, ob ein ADC besser ist als andere und ob Resistenzen gegenüber einer Substanz auf eine Unwirksamkeit aller ADC schliessen lassen. Die frühzeitige Identifikation und Therapie von AE sind unter anderem im Hinblick auf ILD und Zytopenien wichtig.
Insgesamt lässt sich feststellen, dass wir eindeutig in einer Ära der Hoffnung mit spannenden neuen Therapien für Patient:innen mit SCLC leben. Auch wenn wir noch nicht dort sind, wo wir hinwollen, machen wir kontinuierlich grosse Fortschritte.
Literatur:
1 Spigel D et al.: J Clin Oncol 2024; 42 (Suppl. 17): LBA5 2 Bi N et al.: Circulating tumor DNA refines consolidation immunotherapy for limited-stage SCLC. WCLC 2025; Abstr. # MA11.09 3 Horn L et al.: N Engl J Med 2018; 379(23): 2220-9 4 Paz-Ares L et al.: Lancet 2019; 394(10212): 1929-39 5 Liu SV et al.: Five-year survival in patients with ES-SCLC treated with atezolizumab in IMpower133: IMbrella A extension study results. WCLC 2023; Abstr. #OA01.04 6 Paz-Ares L et al.: J Clin Oncol 2025; 43(Suppl. 16): 8006 7 Rudin C et al.: J Clin Oncol 2025; 43(Suppl. 17): Abstr. #LBA8008 8 Paulson KG et al.: Lancet Oncol 2025; 26(10): 1300-11 9 Rudin CM et al.: J Clin Oncol 2025: 101200JCO2502142 10 Wang L et al.: A first-in-human phase 1 study of SHR-4849 (IDE849), a DLL3-directed antibody-drug conjugate, in relapsed SCLC. WCLC 2025; Abstr. #OA06.01
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...