Highlights zu den Tumoren des oberen Gastrointestinaltrakts
Autor:
Dr. med. Alexander Siebenhüner
Leitender Arzt Onkologie
Kantonsspital Schaffhausen
Auch 2021 wurde der Jahreskongress der American Society of Clinical Oncology (ASCO) bedingt durch die anhaltende SARS-CoV2-Pandemie virtuell ausgetragen. Durch die Erfahrungen des Vorjahres setzte die ASCO den virtuellen Jahreskongress sehr gut um. Eine Auswahl von relevanten Abstracts aus dem Gebiet der oberen gastrointestinalen (GI) und hepato-pankreatiko-biliären (HBP) Tumoren möchte ich im Folgenden darstellen.
Keypoints
-
Bei nicht metastasierten Ösophagustumoren sowie GEJ-Tumoren ist die perioperative Behandlung der neoadjuvanten Radiochemotherapie nicht unterlegen.
-
Nach neoadjuvanter Radiochemotherapie des Ösophaguskarzinoms ist adjuvantes Nivolumab ein neuer Therapiestandard.
-
Neben Nivolumab plus Chemotherapie ist auch eine Kombination von Nivolumab und Ipilimumab bei metastasierten ESCC-Patienten wirksam. Jedoch fehlen geeignete Biomarker zur Patientenselektion.
-
Die Daten der CM-649-Studie zeigen neben der günstigen Wirkung von Nivolumab plus Chemotherapie bei metastasiertem GC/GEJ oder Adenokarzinom des Ösophagus eine hohe Lebensqualität.
-
Für HER2-positive Magenkarzinome führt Pembrolizumab plus Trastuzumab plus Chemotherapie zu einer sehr hohen Ansprechrate.
-
In der Zweitlinie des fortgeschrittenen cholangiozellulären Karzinoms ist nal-IRI plus 5FU eine Alternative zu FOLFOX.
-
Für NRG1-fusionierte fortgeschrittene Pankreastumoren ist Zenocutuzumab nach erfolgter Standardtherapie eine hocheffektive und gut tolerierte Option.
Lokale bzw. lokal fortgeschrittene Ösophagustumoren
NeoAEGIS1
Während der Oral Abstract Session präsentierte John V. Reynolds dieses neoadjuvante Studienkonzept für Ösophagustumoren (EC). Eingeschlossen wurden Ösophagustumoren oder auch Übergangskarzinome (GEJ) vom Adenokarzinomtyp, AEG I–III und mit einem klinischen Stadium cT2–3, cN0–3, cM0. Dies entspricht der klassischen Population für eine neoadjuvante oder perioperative Therapie. Da beide Konzepte bislang nicht in einer 1:1-Vergleichsstudie untersucht wurden, halte ich diese Studie für klinisch bedeutsam. Verglichen wurden in einer 1:1-Randomisierung eine perioperative Behandlung analog MAGIC (ECF/ECX vor und nach Chirurgie) im Arm A mit einer neoadjuvanten Radiochemotherapie analog dem CROSS-Behandlungskonzept im Arm B.
Initial wurde das Behandlungskonzept als Superiorität zugunsten von Arm B gewählt, mit dem primären Endpunkt Gesamtüberleben sowie den sekundären Endpunkten krankheitsfreies Überleben (DFS), «time-to-treatment-failure», TRG:R0-Rate, Toxizität, postoperative Komplikationsrate und Lebensqualität (HRQoL). Mit der unter der Zeit publizierten und überlegenen perioperativen Behandlung analog FLOT2 erfuhr die Studie ein Amendment im Arm A, worin nun eine perioperative FLOT-Therapie mit der CROSS-Therapie in Arm B verglichen wurde. Das Studienkonzept wurde mit geringeren Patientenzahlen einem Non-Inferiority Trial im Amendment angepasst, primäre und sekundäre Endpunkte blieben dabei unverändert.
Für den primären Endpunkt Gesamtüberleben nach 3 Jahren lag kein Unterschied zwischen Arm A (Modifiziertes-MAGIC/FLOT-Gruppe) mit 56% gegenüber dem Arm B (CROSS-Gruppe) mit 57% vor. Die in der zweiten Futilitätsanalyse im Dezember 2020 erhobenen Daten ergaben mit 148 Todesfällen bei insgesamt 355 Studienpatienten keine Behandlungsunterschiede im Arm A gegenüber Arm B mit einer HR von 1,02 (95% CI: 0,74–1,42).
Bei den sekundären Endpunkten lag eine signifikant höhere Rate an R0-Resektionen und TRG zugunsten der CROSS-Gruppe vor. Hinsichtlich der postoperativen Komplikationen unterschieden sich die Gruppen bei den Raten von schweren respiratorischen Komplikationen respektive ARDS (0,6% in Arm A gegenüber 4,3% in Arm B). Die finale Auswertung wird im Juli 2022 erwartet.
Somit sind beide Therapien valide Optionen in der neoadjuvanten respektive perioperativen Behandlung des lokalen/lokal fortgeschrittenen Ösophaguskarzinoms. Interessant sind diese Daten gerade hinsichtlich der anschliessenden CM-577-Studie, da sich Patienten nach einer perioperativen Radiochemotherapie für eine adjuvante Checkpoint-Inhibition qualifizieren. Dies hatte in der NeoAEGIS-Studie keinen Einfluss, ist jedoch für unseren klinischen Alltag von Bedeutung.
Die Behandlung eines klassischen lokalen/lokal fortgeschrittenen Ösophaguskarzinoms erfolgte und erfolgt in der Schweiz überwiegend analog der CROSS-Studie, wohingegen Übergangskarzinome vermehrt mit einer perioperativen Behandlung versorgt werden. Zusätzlich sollte erwähnt werden, dass Checkpoint-Inhibition bei der perioperativen Behandlung von Magenkarzinomen und Übergangskarzinomen innerhalb von derzeit rekrutierenden Studien untersucht werden. Ein solcher Ansatz wird derzeit in der DANTE-Studie (NCT03421288) für das perioperative Management des Magenkarzinoms und auch der eingeschlossenen Übergangskarzinome untersucht und die Daten werden demnächst erwartet.
Update zu CheckMate 5773
Ein Update zur adjuvanten Therapie mit Nivolumab bei EC/GEJ wurde in der Oral Abstract Session von Ronan J. Kelly präsentiert. Einschlusskriterien waren Stadium II/III, histologisches Adeno- oder Plattenepithelkarzinom, vorangehende trimodale Therapie analog CROSS, ECOG Performance Status 0–1 sowie residueller Tumor ≥ypT1 oder ≥ypN1. Diese Tumoren wurden in einer 2:1-Randomisierung zugunsten des Studienarms A (Nivolumab 240mg alle 2 Wochen für insgesamt 16 Wochen gefolgt von 480mg Nivolumab alle 4 Wochen) gegenüber dem Kontrollarm (Placebo alle 2 Wochen, insgesamt 16 Wochen, gefolgt von Placebo alle 4 Wochen) verglichen.
Das mediane Kontrollintervall lag nun bei 24,4 Monaten. Der primäre Endpunkt DFS wurde bereits am Kongress der European Society of Medical Oncology (ESMO) 2020 präsentiert und demonstrierte eindrücklich eine Verdopplung des DFS mit 22,4 Monaten in der Nivolumab-Behandlungsgruppe gegenüber 11 Monaten in der Placebogruppe (HR: 0,69; 95% CI: 0,56–0,86; p=0,0003).
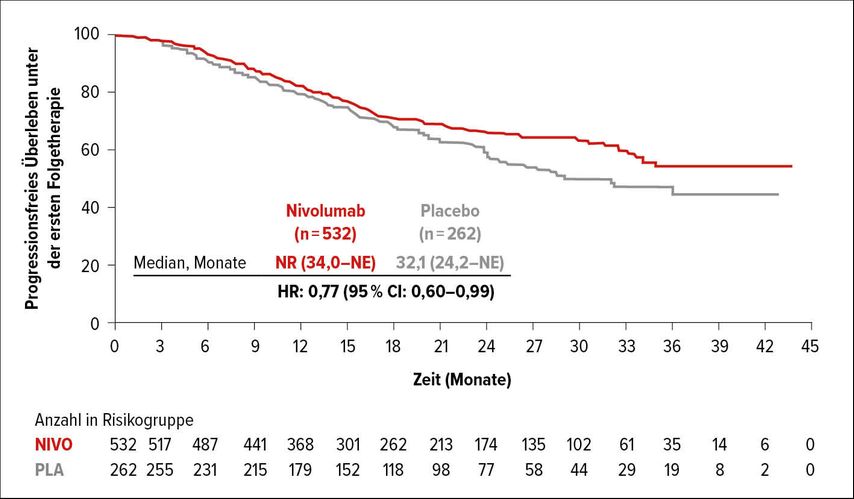
Am ASCO-Kongress 2021 wurden nun die Daten zum progressionsfreien Überleben unter der ersten Folgetherapie (PFS2) demonstriert. Dabei war in der Behandlungsgruppe mit Nivolumab der Median noch nicht erreicht worden. In der Placebo-Vergleichsgruppe lag das mediane PFS2 bei 32,1 Monaten (Abb. 1). Die detaillierte Auswahl einer Zweitlinientherapie nach Nivolumab oder nach Placebo wurde hierbei (noch) nicht genannt, wobei dies durchaus interessant ist, gerade nach Anwendung einer Checkpoint-Inhibitionstherapie.
Abb. 1: Progressionsfreies Überleben unter der ersten Folgetherapie in CheckMate 577 (nach Kelly et al.)3
Somit überträgt sich die Verlängerung des DFS unter Nivolumab auf eine zwar weniger ausgeprägte, aber dennoch signifikante Verlängerung des PFS2.
Die Daten zum Gesamtüberleben sind weiterhin noch ausstehend.
Ein weiterer sekundärer Endpunkt dieser Studie wurde mit dem konstanten Erhalt der Lebensqualität unter Nivolumab anhand des FACT-E-ECS-Erhebungsbogens demonstriert. Mit diesen «practice changing» Erkenntnissen adaptierte das NCCN (National Comprehensive Cancer Network) umgehend die Guidelines, sodass die adjuvante Therapie mit Nivolumab nach einer trimodalen Therapie des EC/GEJ bei einem residuellen Tumor ≥ypT1 oder ≥ypN1 mit aufgenommen wurde. Diese Therapie ist von der FDA und der EMA bereits zugelassen und im Juli 2021 erteilte auch die SwissMedic den Zulassungsstatus in der Schweiz.
Metastasierte Ösophagustumoren
CheckMate 6484
Innerhalb dieser dreiarmigen Studie (Randomisierung 1:1:1) mit der Kombination Nivolumab plus Chemotherapie (Nivo/Chemo) versus Nivolumab plus Ipilimumab (Nivo/Ipi) versus Chemotherapie alleine bei therapienaiven Patienten mit fortgeschrittenem, metastasiertem, rekurrentem oder inoperablem Plattenepithelkarzinom des Ösophagus (ESCC) wurde durch Ian Chau der Kombinationsarm Nivolumab (Nivo) plus Ipilimumab (Ipi) gegenüber dem Chemotherapie-Arm vorgestellt. Als primärer Endpunkt wurde eine kombinierte Analyse von Gesamtüberleben (OS) und progressionsfreiem Überleben (PFS) für die Population mit einer Expression von PD-L1 ≥1% gewählt. Als sekundäre Endpunkte wurden das OS und das PFS aller randomisierten Patienten sowie die objektive Ansprechrate (ORR) erneut für die Population mit PD-L1 ≥1% festgelegt.
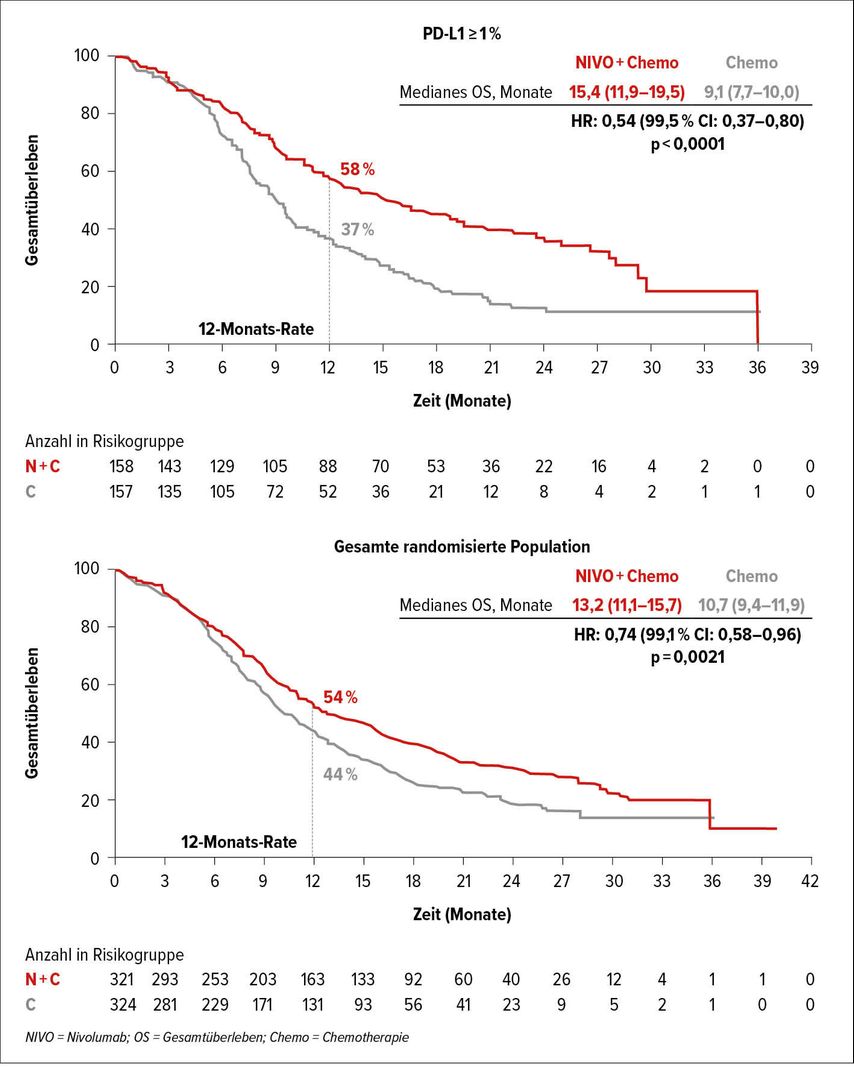
Die Studie hatte einen signifikanten primären Endpunkt (ESCC PD-L1 ≥1%) für das OS mit 13,7 vs. 9,1 Monate mit einer HR von 0,64 (95% CI: 0,46–0,9; p=0,0010) in der Gruppe Nivo/Ipi gegenüber dem Chemotherapie-Arm erreicht. Sowohl für das Gesamtüberleben aller randomisierten Patienten als auch für das PFS wiesen die Daten unabhängig vom PD-L1-Status keinen Benefit für die Nivo/Ipi-Gruppe auf (Abb. 2).
Abb. 2: Gesamtüberleben in der PD-L1-positiven Studienpopulation und der gesamten randomisierten Population in CheckMate 648 (nach Chau et al.)4
Auch müssen die ersten 6 Behandlungsmonate kritisch betrachtet werden, da sich die Kurven beider Gruppen kreuzten und der Eindruck entsteht, dass die Chemotherapie hier einen schnelleren Effekt erzielte. Dies warf viele Fragen auf, mitunter, wie man die Therapie auf die richtigen Biomarker abstimmt. Diese scheinen derzeit noch nicht vollumfänglich definiert zu sein, da auch in den bislang dargestellten Subgruppenanalysen rein negativ prädiktive Marker (PD-L1 <1% und weibliches Geschlecht) die Tendenz haben, nicht komplett von einer reinen Immuntherapie zu profitieren. Die positiv prädiktiven Biomarker fehlen indes weiter und sollten in zukünftigen Studien charakterisiert werden.
Bereits am ASCO-Kongress 2020 sowie am ESMO-Kongress 2020 wurde der Nivo/Chemo-Arm mit signifikanten Daten und klinischer Relevanz vorgestellt. Mitunter ist unabhängig vom PD-L1-Status Chemotherapie plus Immuntherapie beim ESCC in der Erstlinie ein Standard geworden. Aufgrund der KN-590-Studie mit der Kombination mit Pembrolizumab liegen somit gleich zwei Medikamente für die kombinierte Chemoimmuntherapie vor. Eine Chemotherapie-freie Alternative könnte nun auch die Kombination Nivo/Ipi sein, wobei die Biomarkerfrage zu einer richtigen Patientenselektion weiterhin unbeantwortet bleibt.
Metastasiertes Magenkarzinom
Update von CheckMate 6495
Für die Erstlinientherapie eines fortgeschrittenen Magenkarzinoms (GC), eines GEJ oder eines Ösophaguskarzinoms vom Typ eines Adenokarzinoms wurden von Markus Möhler bereits am ESMO-Kongress 2020 die Daten zum Ansprechen in der CM-649-Studie präsentiert. Hier war der primäre Endpunkt, das mediane OS, für die Subpopulation mit PD-L1-CPS ≥5 für die Kombination Nivolumab plus Chemotherapie (XelOX/FOLFOX) signifikant verlängert gegenüber Chemotherapie alleine (14,4 vs. 11,1 Monate; HR: 0,71; p<0,0001).
In dem nun präsentierten Update durch Markus Möhler wurden in der Oral Abstract Session die Lebensqualitätsdaten dieser Therapie demonstriert. In der Gesamtpopulation wurde die mediane Zeit bis zur Symptomverschlechterung in der Nivolumab+Chemotherapie-Gruppe noch nicht erreicht, wohingegen die unterlegene Chemotherapie-Gruppe den Median bei 22 Monaten erreichte. Auch wurde die Lebensqualität mit dem FACT-Ga GP 5 gemessen, mit einer konstanten guten Lebensqualität in den einzelnen Komponenten unter der Therapie mit Nivolumab plus Chemotherapie. Bei den Nebenwirkungen zeigten sich unter der Kombination keine zusätzlich erhöhten Schweregrade gegenüber Chemotherapie alleine. Bereits am 16. April 2021 hatte die FDA die Chemoimmuntherapie in dieser Indikation als Erstlinientherapie unabhängig vom PD-L1-CPS-Status zugelassen.
Erste Analyse von Keynote 8116
Diese laufende Studie wurde als Poster präsentiert. Dennoch finde ich diese Daten sehr spannend und auf Grundlage der hier demonstrierten Daten wurde bereits eine beschleunigte FDA-Zulassung für die Kombination Trastuzumab plus Pembrolizumab beim HER2-positiven, fortgeschrittenen Magenkarzinom (mGC) erreicht. Kleinere Studien (MSKCC und PANTHERA) haben die Kombination in Phase-II-Protokollen bereits als sehr potent dargestellt. Nun wurde eine randomisierte Phase-III-Studie im HER2-positiven mGC für die Kombination Trastuzumab + Pembrolizumab + Chemotherapie (Arm A) im Vergleich zur Standardtherapie Trastuzumab + Chemotherapie (Arm B) konzipiert. Als primärer dualer Endpunkt wurden OS und PFS gesetzt sowie als sekundäre Endpunkte ORR, Dauer des Ansprechens (DoR) und Sicherheitsanalysen. Insgesamt werden 692 Patienten 1:1 randomisiert.
In der ersten Interimsanalyse wurden 124 Patienten (Arm A) gegenüber 122 Patienten (Arm B) für die sekundären Endpunkte ORR und DoR vorgestellt. Hierbei liegt bezüglich der ORR ein hochsignifikanter Vorteil für Arm A mit 74,4% vs. 51,9% vor. Das entspricht einem Unterschied von 22,7% im Gesamtansprechen zugunsten von Arm A (p=0,00006).
Zu einem kompletten Ansprechen kam es bei 11% in Arm A gegenüber 3% in Arm B. Einen weniger deutlichen Unterschied in dieser Interimsanalyse wies die DoR auf mit 10,6 (Arm A) vs. 9,5 Monate (Arm B). Somit wird mit Spannung die Auswertung der primären Endpunkte erwartet sowie die Komplettanalyse der vorgesehenen 692 Patienten.
Dennoch hat diese Studie für mich bereits jetzt eine Bedeutung. Einerseits würde ich im klinischen Alltag diese Dreifachtherapiekombination nun auch bei den HER2-positiven mGC-Patienten wählen und andererseits liegt nun bei der HER2-positiven Population der Nachweis vor, dass Immuntherapie wirksam ist.
Pankreas- und Gallengangstumoren
NIFTY7
In der Oral Abstract Session wurde diese Phase-IIB-Studie im Bereich des fortgeschrittenen cholangiozellulären Karzinoms (aCCC) nach vorangehender Chemotherapie (GemCis) demonstriert. In einer 1:1-Randomisierung wurde anhand von 174 Patienten nanoliposomales Irinotecan (nal-Iri) in Kombination mit 5FU/Lv gegenüber der Standardtherapie 5FU/Lv alleine verglichen. Der primäre Endpunkt PFS war unter nal-IRI plus 5FU/Lv signifikant überlegen mit median 7,1 Monaten gegenüber 1,4 Monaten (HR: 0,54; p=0,0019). Das mediane OS lag bei der Kombination bei 8,6 Monaten gegenüber 5,5 Monaten in der Monotherapiegruppe (HR: 0,68; p=0,0349).
Somit besteht neben der FOLFOX-Zweitlinientherapie anhand der ABC-06-Studie auch eine weitere Therapiemöglichkeit beim aCCC. Eine Biomarkeranalyse fehlt in dieser Studie und das aCCC ist mit seinen molekularen Zielstrukturen wie z.B. HER-2, FGFR-2, MSI-h/PD-L1, NTRK auch eine Entität, bei der sich meiner Ansicht nach eine frühe und breite Testung lohnt, um eine personalisierte Therapiestrategie zu ermöglichen.
Zenocutuzumab bei fortgeschrittenem Pankreaskarzinom mit NRG1-Fusion8
Molekulare Therapieansätze beim Pankreaskarzinom (PDAC) waren bislang sehr limitiert und frustran mit fehlendem respektive geringem Benefit. Umso mehr überzeugt diese Studie mit Zenocutuzumab bei einer NRG1-Fusion im metastasierten PDAC. Neuroregulin 1 (NRG1) ist ein Ligand, welcher an HER-3 bindet und somit eine Heterodimerisierung von Her2/Her3 hervorruft. Dies hat zur Folge, dass der PI3CA-/AKT- und folgend der mTOR-Signalweg aktiviert wird. NRG1 wird besonders in PDAC mit KRAS-Wildtyp häufig gefunden. In dieser nun kleinen Phase-I/II-Studie wurden metastasierte PDAC-Patienten mit einer detektierten NRG1-Fusion nach Erhalt der Standardtherapie für eine intravenöse Therapie mit Zenocutuzumab eingeschlossen und das 1-Jahres-Überleben wurde analysiert.
Von den 12 bislang analysierten Patienten wiesen in der Evaluation des bestmöglichen Ansprechens 42% eine partielle Remission auf, 50% der Patienten eine stabile Erkrankungssituation und lediglich 8% eine Tumorprogression. Interessant ist auch, dass die überwiegende Anzahl dieser Patienten bereits zum ersten klinischen Assessment (8 Wochen unter Therapie) ein Ansprechen zeigte und dieses auch für weitere Monate anhielt.
Die Toleranz dieser Therapie war durchweg gut mit meistens Grad-1–2-Nebenwirkungen und dem Ausbleiben von schweren kardialen, gastrointestinalen oder kutanen Nebenwirkungen. Diese Therapie gibt somit eine positive Aussicht, dass eine zielgerichtete Therapie bei NRG1-Fusion beim metastasierten PDAC angewandt werden darf. Die finalen Analysen dieser Studie sollten noch abgewartet werden.
Literatur:
1 Reynolds JV et al.: Neo-AEGIS (Neoadjuvant Trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): preliminary results of phase III RCT of CROSS versus perioperative chemotherapy (modified MAGIC or FLOT protocol). (NCT01726452). ASCO 2021, Abstr. #4004 2 Al-Batran SE et al.: Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet 2019; 393(10184): 1948-57 3 Kelly RJ et al.: Adjuvant nivolumab (NIVO) in resected esophageal or gastroesophageal junction cancer (EC/GEJC) following neoadjuvant chemoradiotherapy (CRT): expanded efficacy and safety analyses from CheckMate 577. ASCO 2021, Abstr. #4003 4 Chau I et al.: Nivolumab (NIVO) plus ipilimumab (IPI) or NIVO plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced esophageal squamous cell carcinoma (ESCC): first results of the CheckMate 648 study. ASCO 2021, Abstr. #LBA4001 5 Moehler MH et al.: First-line (1L) nivolumab (NIVO) plus chemotherapy (chemo) versus chemo in advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): expanded efficacy and safety data from CheckMate 649. ASCO 2021, Abstr. #4002 6 Janjigian YY et al.: Pembrolizumab plus trastuzumab and chemotherapy for HER2+ metastatic gastric or gastroesophageal junction (G/GEJ) cancer: initial findings of the global phase 3 KEYNOTE-811 study. ASCO 2021, Abstr. #4013 7 Yoo C et al.: Liposomal irinotecan (nal-IRI) in combination with fluorouracil (5-FU) and leucovorin (LV) for patients with metastatic biliary tract cancer (BTC) after progression on gemcitabine plus cisplatin (GemCis): multicenter comparative randomized phase 2b study (NIFTY). ASCO 2021, Abstr. #4006 8 Schram AM et al.: Efficacy and safety of zenocutuzumab in advanced pancreas cancer and other solid tumors harboring NRG1 fusions. ASCO 2021, Abstr. #3003
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...