Hämatologie: neue Zulassungen und neue Kombinationen
Bericht:
Dr. Andreas Billich
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim diesjährigen OeGHO-Kongress fassten Expert:innen aktuelle Studien zusammen, die für die Zukunft neue Therapieoptionen bei malignen hämatologischen Erkrankungen eröffnen oder heute bereits die klinische Praxis ändern.
Myeloische Neoplasien
Myelodysplastisches Syndrom
Das Problem beim myelodysplastischen Syndrom mit niedrigem Risiko („Low risk“-MDS) sind Zytopenien, vor allem die Anämie und damit verbunden die Transfusionspflichtigkeit. Eine bewährte Methode, um Transfusionen hinauszuzögern, ist die Gabe von Erythropoetin (EPO). Nach EPO-Versagen war in der Zweitlinientherapie bislang schon Luspatercept zugelassen, ein TGFβ-Binder, der die Erythropoese anregt.
Assoc.Prof. PD Dr. Karoline Gleixner (MedUni Wien) stellte eine Studie vor, die EPO und Luspatercept bei unbehandelten MDS-Patient:innen mit sehr niedrigem, niedrigem oder intermediärem Risiko und Transfusionspflichtigkeit verglich.1 Luspatercept erhöhte die Rate der Erreichung von Transfusionsunabhängigkeit und höheren Hämoglobinspiegeln im Vergleich zu EPO. Daraufhin wurde die Zulassung von Luspatercept bereits auf die Erstlinie erweitert. Es stellt sich die Frage nach der besten Sequenz der beiden Therapien; eventuell wird man weiterhin mit EPO beginnen und bei Bedarf niederschwellig auf Luspatercept wechseln, meinte Gleixner. In der Subgruppe der Ringsideroblasten-negativen MDS waren Luspatercept und EPO äquipotent; hier braucht es weitere Daten, um die Therapiewahl anzuleiten.
Imetelstat, ein Telomerase-Inhibitor, wurde in einer Studie bei „Low risk“-MDS-Patient:innen untersucht, die EPO-refraktär oder für EPO ungeeignet waren.2 Im Vergleich zu Placebo verbesserte Imetelstat die Erreichung von Transfusionsunabhängigkeit und die Hämoglobinspiegel signifikant. Die Zulassung von Imetelstat bei MDS mit Transfusionsbedarf in der Zweitlinie wird für dieses Jahr erwartet. Aufhorchen lassen allerdings die Nebenwirkungen der Substanz (Neutro- und Thrombopenie), weshalb der Stellenwert dieser Therapie laut Gleixner noch unklar ist.
Akute myeloische Leukämie (AML): Therapie bei unfitten Patient:innen
Ein Ziel aktueller Forschung bei der akuten myeloischen Leukämie (AML) ist die Optimierung der nichtintensiven (palliativen) bzw. mittelintensiven Behandlung. Neben Azacitidin stellte bislang intravenöses Decitabin eine Therapieoption dar.
Jetzt zeigte die Phase-III-Studie ASCERTAIN, dass die Kombination von oralem Decitabin und Cedazuridin der intravenösen Decitabin-Monotherapie bezüglich Wirksamkeit und Nebenwirkungsprofil nicht unterlegen ist.3 Decitabin+Cedazuridin (Inaqovi) wurde deshalb im März 2024 in der EU zur Therapie unbehandelter und für die Chemotherapie (CTx) nicht geeigneter Patient:innen zugelassen.
Klar ist laut Gleixner der Vorteil dieser Darreichungsform von Decitabin, noch offen aber, wie sich das Präparat in Kombinationsschemata einreihen wird. Eine erste Antwort gab eine rezent publizierte Phase-II-Studie, in der bei älteren und unfitten AML-Patient:innen Decitabin/Cedazuridin mit Venetoclax kombiniert wurde.4 Auf diese rein orale Therapie sprachen 64% der Patient:innen mit neu aufgetretener AML und 46% derjenigen mit rezidivierter AML an, darunter auch Patient:innen mit TP53-Mutation. Das Gesamtüberleben (OS) lag bei 12,7 bzw. 7,6 Monaten.
Der Hedgehog-Signalweg-Inhibitor Glasdegib ist als Kombination mit niedrig dosiertem Cytarabin (LDAC) zugelassen für die Behandlung von AML-Patient:innen, die nicht für eine Standard-Induktionschemotherapie infrage kommen. Jetzt untersuchte eine Phase-III-Studie den Nutzen der Zufügung von Glasdegib einerseits zu einer nichtintensiven Therapie mit Azacitidin, andererseits zu einer intensiven Therapie (3+7-Schema).5 Gegenüber Placebo ergab sich hier in keiner Gruppe ein Unterschied im OS – leider eine gescheiterte Studie, wie Gleixner feststellte.
AML: neue Therapien
Menin ist ein kritischer epigenetischer Regulator bei der AML mit prognostisch ungünstigem KMT2A-Rearrangement oder mit NPM1-Mutationen, die 10% bzw. 30% aller AML-Fälle ausmachen. Revumenib hemmt die Menin-KMT2A-Interaktion und dadurch die leukämische Expansion der AML-Blasten.
In einer Phase-I-Studie wurde bei Patient:innen mit relapsierter AML mit Revumenib als Monotherapie eine komplette Remission (CR) bzw. eine CR mit partieller hämatologischer Regeneration (CRh) in 30% der Fälle mit rearrangiertem KMT2A bzw. mutiertem NPM1 erzielt.6 Ein Teil der Patient:innen konnte in der Folge einer allogenen Stammzelltransplantation (alloSZT) zugeführt werden. Das Nebenwirkungsprofil war günstig. Die Studie legt einen Mehrwert von Revumenib für eine Subgruppe von Patient:innen mit relapsierter AML nahe; doch vor allem sieht Gleixner mit Spannung weiteren Studien entgegen, die Revumenib in der Erstlinie und in Kombinationen untersuchen.
Tagraxofusp ist ein Fusionsprotein aus Interleukin 3 (IL-3) und Diphtherie-Toxin; es bindet über den IL-3-Teil an CD123, einem auf myeloiden und lymphoiden Neoplasmen überexprimierten Rezeptor, und setzt in den Zellen das Toxin frei. Tagraxofusp ist bei der blastischen plasmazytoiden dendritischen Zellneoplasie (BPCDN) zugelassen. In einer kleinen Studie bei älteren Patient:innen mit De-novo-Hochrisiko-AML sprachen 39% mit CR an.7 Auch hier stellt sich bei überschaubarem Ansprechen für Gleixner die Frage nach Kombinationspartnern.
Die Kombination von Venetoclax+Azacitidin (VenAza) mit dem FLT3-Inhibitor Gilteritinib zeigte in einer Phase-I/II-Studie bei FLT3-mutierter AML eine CR bzw. CR mit unvollständiger hämatologischer Erholung (CRi) in 96% der De-novo-Fälle und eine Rate des OS nach 18 Monaten von 72%.8 Hier stellte Gleixner die Frage nach dem kurativen Potenzial der Kombination, was in weiteren Studien abzuklären wäre.
VenAza wurde auch in einer kleinen Studie mit dem Exportin-1-Inhibitor Selinexor kombiniert.9 CR/CRi wurde bei 80% der unfitten Patient:innen erreicht, laut Gleixner ein vielversprechendes Resultat, wenn es sich in weiteren Studien bestätigt.
Lymphoide Neoplasien
Prof. Dr. Philipp Staber (MedUni Wien) fokussierte in seinem Vortrag auf Studien zu aggressiven Lymphomen, die bereits die klinische Praxis bei der Behandlung dieser Erkrankungen ändern.
Richter-Transformation
Die Richter-Transformation (RT) ist eine seltene Komplikation der chronisch lymphatischen Leukämie (CLL) und stellt einen Übergang in eine höher maligne Form dar, meist in ein diffuses großzelliges B-Zell-Lymphom (DLBCL). Die Prognose der RT ist mit einem OS von nur sechs Monaten sehr viel schlechter als beim De-novo-DLBCL. Eine retrospektive Studie in den USA bei Patient:innen mit RT zeigte einen Überlebensbenefit durch eine Anti-CD19-CAR-T-Zell-Therapie,10 ähnlich hoch wie beim De-novo-DLBCL. Staber berichtete, dass der Versuch, eine prospektive Studie mit CAR-T-Zellen in dieser seltenen Indikation zu starten, an mangelnder Finanzierung durch den Hersteller der Zellen scheiterte.
Pirtobrutinib, ein nichtkovalenter BTK-Inhibitor, zeigte bei RT in einer Phase-I/II-Studie Wirksamkeit mit einem Gesamtansprechen (ORR) von 52% und einer medianen Ansprechdauer (mDOR) von 8,6 Monaten.11 Staber führte aus, dass solch eine Therapie zur Überbrückung bis zur CAR-T-Zell-Therapie geeignet sein könnte.
Konzeptionell interessant ist auch die Kombination des Anti-PD-1-Antikörpers Tislelizumab mit dem BTK-Inhibitor Zanubrutinib bei RT, die in einer Phase-II-Studie eine ORR von fast 60%, ein medianes progressionsfreies Überleben (mPFS) von 10 Monaten und eine 12-Monats-OS-Rate von 75% erzielte.12 Der Erfolg dieser Kombinationstherapie wurde von Staber als potenziell „practice changing“ eingestuft. Allerdings solle noch der Ausgang einer geplanten RT-Studie zur Triple-Therapie (Tislelizumab+Zanubrutinib+BCL-2-Inhibitor) abgewartet werden.
Erstlinientherapie beim diffusen großzelligen B-Zell-Lymphom
CAR-T-Zellen sind beim diffusen großzelligen B-Zell-Lymphom (DLBCL) in der Zweitlinie bereits gut etabliert. Jetzt liegen auch 3-Jahres-Daten aus einer Phase-II-Studie in der Erstlinie bei Hochrisikopatient:innen vor: 80% der Patient:innen erreichten CR und die OS-Rate betrug 84%.13 Für eine Phase-III-Folgestudie (ZUMA-23) werden Patient:innen auch an österreichischen Zentren rekrutiert.
Ein Ansatz, um unfitten Patient:innen eine CTx zu ersparen, ist die Kombination von Mosunetuzumab (bispezifischer Anti-CD20/CD3-Antikörper) und Polatuzumab Vedotin (gegen CD79b gerichtetes Antikörper-Wirkstoff-Konjugat [ADC]). In einer ersten Studie bei älteren, unfitten DLBCL-Patient:innen in der Erstlinie lag nach einem noch recht kurzen Follow-up von 7,5 Monaten die ORR bei 80% mit einer CR-Rate von 61%.14 Auffällig war in der Studie das Auftreten von Todesfällen durch Covid-19-Infektion zu einem Zeitpunkt, als der Großteil der Patient:innen schon geimpft war. Staber ist an einer laufenden Studie mit ähnlichem Konzept beteiligt (R-Pola-Glo: Rituximab+Polatuzumab Vedotin+Glofitamab).
Rezidiviertes DLBCL
Wie erwähnt sind CAR-T-Zellen in der Zweitlinie etabliert (positive Studien mit Axi-Cel und Liso-Cel; dagegen Ausscheiden von Tisa-Cel aufgrund negativer Daten). Staber hob das bisher längste Follow-up mit dieser Therapieform beim DLBCL heraus: Mit Axi-Cel betrug nach fünf Jahren die Rate des ereignisfreien Überlebens 33% und die einer dauerhaften CR 56%.15 Bei Patient:innen mit zwei Jahren Progressionsfreiheit könne gewissermaßen eine Heilung angenommen werden.
Sekundäre ZNS-Lymphome bei DLBCL-Patient:innen sind schwer zu behandeln und durch eine 2-Jahres-Überlebensrate von nur 15% gekennzeichnet.16 Eine Registerstudie zeigte jedoch, dass eine CAR-T-Zell-Therapie auch bei diesen Lymphomen eine ähnliche Wirksamkeit wie bei nodalen Verlaufsformen haben kann.17 Ein anderer Ansatz ist das Hinzufügen von Ibrutinib zum TEDD-R-Regime (Temozolomid+Etoposid+Doxorubicin+Dexamethason+Rituximab); Vorbehandlung mit Ibrutinib alleine und bei Ansprechen Fortsetzung mit Ibrutinib+TEDD-R resultierte bei Respondern in einer 12-Monats-PFS-Rate von 56%.18
Morbus Hodgkin
Bei neu diagnostizierten Patient:innen mit fortgeschrittenen Morbus-Hodgkin(MH)-Lymphomen verglich eine Studie zwei Kombinationen: CTx(AVD-Regime)+Nivolumab vs. CTx+Brentuximab Vedotin (ein Anti-CD30ADC).19 Die Nivolumab/AVD-Kombination zeigte sich hinsichtlich PFS überlegen, bei allerdings noch begrenzter Nachverfolgungszeit. Dieses Ergebnis hat in einigen Zentren bereits zur Änderung der Behandlungspraxis beim MH in der Erstlinie geführt, wie Staber berichtete.
Die Therapie des fortgeschrittenen MH mit eBEACOPP (Bleomycin+Etoposid+Doxorubicin+Cyclophosphamid+Vincristin+Procarbazin+Prednison) erzielt sehr gute Überlebenswerte, ist jedoch mit therapieassoziierter Morbidität verbunden. Jetzt zeigte eine Studie, dass das BrECADD-Regime (Brentuximab Vedotin+Etoposid+Cyclophosphamid+Doxorubicin+Dacarbazin+Dexamethason) gegenüber eBEACOPP nicht unterlegen ist20 bzw. sogar Hinweise auf eine Überlegenheit lieferte, wie Staber anmerkte.
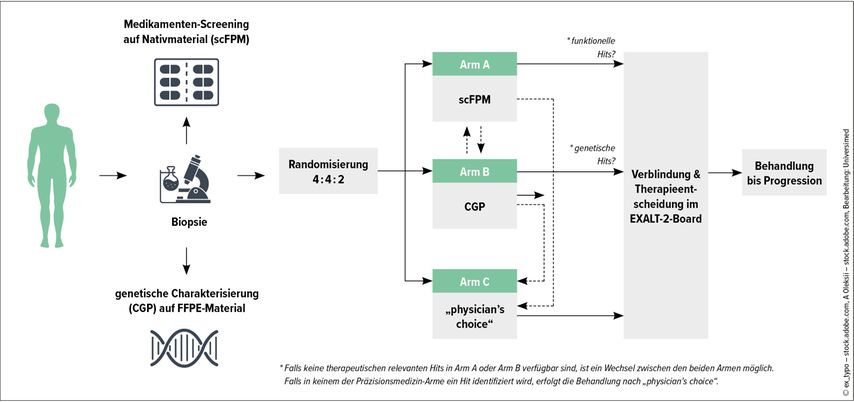
Abschließend wies Staber auf die noch laufende österreichische Studie EXALT-2 hin (Abb. 1), aus der beim ASH-Kongress 2023 erste Resultate präsentiert wurden.22 In der Studie wird untersucht, ob eine Therapie, die durch Genetik („comprehensive genomic profiling“ [CGP]) bzw. durch Einzelzell-Präzisionsmedizin (scFPM) geleitet wird, verglichen mit von klinischer Erfahrung geleiteter Therapie das Ergebnis bei aggressiven hämatologischen Malignitäten verbessert.Die Ergebnisse zeigen, dass CGP und scFPM effizient und sicher in die klinische Routine übernommen werden können.
Die Methoden helfen dabei, Rationale für innovative Optionen bei stark vorbehandelten Patient:innen zu finden. Behandlungsempfehlungen, die sich ausCGP und scFPM ergeben, können bei der Mehrzahl der Patient:innen in die klinische Anwendung übersetzt werden.
Quelle:
Session „Best of Hematology“ bei der Frühjahrstagung 2024 der Österreichischen Gesellschaft für Hämatologie & Medizinische Onkologie (OeGHO), 6.4.2024, Wien
Literatur:
1 Platzbecker U et al.: Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): interim analysis of a phase 3, open-label, randomised controlled trial. Lancet 2023; 402(10399): 373-85 2 Platzbecker U et al.: Imetelstat in patients with lower-risk myelodysplastic syndromes who have relapsed or are refractory to erythropoiesis-stimulating agents (IMerge): a multinational, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2024; 403(10423): 249-60 3 Geissler K et al.: Oral decitabine/cedazuridine vs intravenous decitabine for acute myeloid leukemia: final results of a randomized, crossover, registration-enabling, pharmacokinetics study. Blood 2023; 142(Suppl. 1): 1538 4 Bazinet A et al.: Oral decitabine and cedazuridine plus venetoclax for older or unfit patients with acute myeloid leukaemia: a phase 2 study. Lancet Haematol 2024; 11(4): e276-86 5 Sekeres MA et al.: Glasdegib plus intensive or non-intensive chemotherapy for untreated acute myeloid leukemia: results from the randomized, phase 3 BRIGHT AML 1019 trial. Leukemia 2023; 37(10): 2017-26 6 Issa GC et al.: The menin inhibitor revumenib in KMT2A-rearranged or NPM1-mutant leukaemia. Nature 2023; 615 (7954): 920-4 7 Lane AA et al.: Phase 1b trial of tagraxofusp in combination with azacitidine with or without venetoclax in acute myeloid leukemia. Blood Adv 2024; 8(3): 591-602 8 Short NJ et al.: Azacitidine, venetoclax, and gilteritinib in newly diagnosed and relapsed or refractory FLT3-mutated AML. J Clin Oncol 2024; 26: JCO2301911 9 Yang L et al.: Blood 2023; 142(Suppl. 1): 55 10 Kittai AS et al.: Anti-CD19 chimeric antigen receptor T-cell therapy for Richter’s transformation: an international multicenter retrospective study. ASH 2023; Abstr. #108 11 Wierda WG et al.: Pirtobrutinib in Richter transformation: updated efficacy and safety results with 18-month median survival follow-up from the phase 1/2 BRUIN study. ASH 2023; Abstr. #1737 12 Al-Sawaf O et al.: Tislelizumab plus zanubrutinib for Richter transformation: the phase 2 RT1 trial. Nat Med 2024; 30(1): 240-8 13 Chavez JC et al.: 3-year analysis of ZUMA-12: a phase 2 study of axicabtagene ciloleucel (axi-cel) as first-line therapy in patients with high-risk large B-cell lymphoma (LBCL). ASH 2023; Abstr. #894 14 Olszewski AJ et al.: Mosunetuzumab and polatuzumab vedotin demonstrates preliminary efficacy in elderly unfit/frail patients with previously untreated diffuse large B-cell lymphoma. ASH 2023; Abstr. #855 15 Neelapu SS et al.: Five-year follow-up of ZUMA-1 supports the curative potential of axicabtagene ciloleucel in refractory large B-cell lymphoma. Blood 2023; 141(19): 2307-15 16 Frontzek F et al.: Identification and clinical characterization of CNS relapse in DLBCL patients across 19 prospective phase 2 and 3 trials – a GLA/ DSHNHL and LYSA collaboration. Blood 2023; 142(Suppl. 1): 71 17 Saidy AO et al.: Efficacy of CD19-directed CAR T cell therapy in patients with primary or secondary CNS lymphoma – an analysis of the EBMT lymphoma WP and the Gocart Coalition. ASH 2023; Abstr. #1031 18 Simard J et al.: Phase 2 response-adapted study of ibrutinib with temozolomide, etoposide, liposomal doxorubicin, dexamethasone, and rituximab (TEDDI-R) for secondary CNS lymphoma. ASH 2023; Abstr. #854 19 Herrera AF et al.: SWOG S1826, arandomized study of nivolumab(N)-AVD versus brentuximab vedotin(BV)-AVD in advanced stage (AS) classic Hodgkin lymphoma (HL). J Clin Oncol 2023; 41(Suppl. 17): Abstr. #LBA4 20 Borchmann P et al.: Brecadd is non-inferior to ebeacopp in patients with advanced stage classical hodgkin lymphoma: efficacy results of the GHSG phase iii HD21 trial. Hematol Oncol 2023; 41(S2): 881-2 21 Forschungsprojekte MedUni Wien: https://innere-med-1.meduniwien.ac.at/unsere-klinischen-abteilungen/haematologie-und-haemostaseologie/mitarbeiterinnen/philipp-staber/forschungsprojekte/ 22 Kazianka L et al.: Functional precision medicine vs genomics vs clinical experience: feasibility results from the multicentric, prospective, randomized controlled Exalt-2 trial. ASH 2023; Abstr. #116
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...