Gynäkoonkologie: Wird die Chemotherapie obsolet?
Autorin:
Prof. Dr. med. Viola Heinzelmann-Schwarz
Gynäkologisches Tumorzentrum
Universitätsspital Basel
E-Mail: viola.heinzelmann@usb.ch
Am ASCO-Jahrestreffen wurden neue Ergebnisse zum Benefit der Checkpoint-Inhibitor-Immuntherapie beim Zervix- und Endometriumkarzinom vorgestellt. Auch weitere Resultate der KEYNOTE-826- und der RUBY-Studie wurden präsentiert.
KEYNOTE-826: Pembrolizumab+Chemotherapie vs. Placebo+Chemotherapie
Erstmals wurde die therapie- und prognoseverändernde KEYNOTE-826-Studie zum fortgeschrittenen persistierenden oder rezidivierten Zervixkarzinom am ESMO-Kongress 2021 in Paris von Nicoletta Colombo vorgestellt und kurz darauf publiziert.1 In dieser Studie wurden Patient:innen mit dem aktuellen Standard (Paclitaxel/Cisplatin oder Carboplatin±Bevacizumab) im Vergleich zu der Ergänzung mit dem Checkpoint-Inhibitor Pembrolizumab verabreicht. Die Randomisierung erfolgte 1:1 in einen der beiden Arme.
Die dieses Jahr am ASCO-Jahrestreffen gezeigte Analyse wurde an jenem präspezifizierten Zeitpunkt vorgenommen, an dem 378 Ereignisse, nämlich Todesfälle, eingetroffen waren (in der Population CPS≥1).2 Der mediane Follow-up-Rahmen lag bei 39,1 Monaten (32,1–46,5 Monate). Pembrolizumab wurde über bis zu 35 Zyklen, also bis zu über zwei Jahre verabreicht.
Die Resultate zeigten eine Reduktion in der Mortalitätsrate im Pembrolizumab-Arm um 40% (medianes Überleben 29 vs. 17 Monate). Das progressionsfreie Überleben (PFS) verlängerte sich um zwei Monate (10 vs. 8 Monate) und die Ansprechrate (RR) betrug 68% vs. 51%.
Eine brennende offene Frage ist die nach dem Benefit durch die Zugabe von Bevacizumab, das nicht bedingt vorgeschrieben war. Diese Analyse ist noch nicht vorgestellt worden; sie wird am ESGO-Kongress in Istanbul im September 2023 in der Sitzung «Best oral abstract in cervical cancer» vorgestellt werden.
Bisherige Resultate zum Benefit eines Anti-PD/L1-Checkpoint-Inhibitors mit Ergänzung durch antiangiogene Therapie in allerdings vortherapierten Endometriumkarzinomen zeigte ein Ansprechen von nur 25–44,4%, sodass eher von keinem Benefit auszugehen ist.3,4 Die grösste derartige Studie ist KEYNOTE-775 mit Pembrolizumab+Lenvatinib, die mit 411 Patient:innen durchgeführt wurde und einen Überlebensvorteil von 32% zeigte. Diese Kohorte enthielt jedoch nur 65 dMMR(«deficient mismatch repair»)-Patient:innen, sodass man von einem verbesserten Effekt in einer alleinigen dMMR-Gruppe ausgehen könnte.5
RUBY: Dostarlimab bei fortgeschrittenem oder rezidiviertem Endometriumkarzinom
Chemotherapie mit Carboplatin/Paclitaxel ist der Standard in der Erstlinientherapie des fortgeschrittenen oder rezidivierten Endometriumkarzinoms, wobei das Gesamtüberleben in dieser Gruppe von Patient:innen bisher unter drei Jahren liegt.
Die Phase-III-Studie RUBY untersuchte in dieser Population, ob die Ergänzung durch einen Checkpoint-Inhibitor (Dostarlimab) von Vorteil ist.6 Die den Standard verändernden Studienresultate in Bezug auf die Zunahme der progressionsfreien Zeit wurden von Mansoor Mirza bereits am SGO-Jahrestreffen gezeigt und publiziert.7
Am ASCO-Jahrestreffen wurden nun die Analysen zum progressionsfreien Überleben vorgestellt, die von einem unabhängigen Assessment-Team erhoben wurden. Dieser Prozess nennt sich «blinded independent central review» (BICR), wird bei Phase-III-Studien angewandt und sucht, möglichen Bias auszuschliessen. Diese neue Analyse zeigte nun also keine grossen Unterschiede in der dMMR-Population mit hochgradiger Mikrosatelliteninstabilität (MSI-H), die den grössten Vorteil durch die Therapieergänzung mit Dostarlimab hatte (HR: 0,28 [0,162–0,495], p<0,0001 vs. HR: 0,29 [0,158–0,543], p<0,0001). Es zeigte sich eine hohe Konkordanz zwischen beiden Analysemethoden, mit einem Benefit durch die Zugabe von Dostarlimab in der Reduktion der Rezidivrate oder Mortalitätsrate um 34% in der Gesamtpopulation und 71% in der dMMR/MSI-H-Population.
Aktuell gilt es, die reifen Überlebensdaten abzuwarten und weitere prädiktive Faktoren für den Benefit der Immuntherapie zu identifizieren. Eine weitere spannende Frage, deren Beantwortung uns bevorsteht, ist, ob man in der Erstlinientherapie beim fortgeschrittenen Endometriumkarzinom einen stärkeren Effekt als in der Zweitlinientherapie beim Rezidiv sehen kann.
«Patient-reported outcomes» in der RUBY-Studie
«Patient-reported outcomes» messen die Erfahrung der Patient:innen unter einer gegebenen Therapie aus der Patient:innenperspektive und erlauben daher eine Aussage zur Lebensqualität. Es wurden zwei validierte Fragebögen genutzt, die das allgemeine Funktionieren und die Symptomkontrolle sowie endometriumkarzinomspezifische Nebenwirkungen abfragen.8
Die Patient:innen füllten beide Fragebögen ähnlich aus, unabhängig davon, welche Therapie sie erhielten. Es zeigte sich ab dem siebten Zyklus der Therapie ein beginnender signifikanter Unterschied in der globalen und emotionalen Lebensqualität, insbesondere in der dMMR/MSI-H-Population. Der Unterschied bestand im physikalischen Funktionieren und im Ausmass des Schmerzempfindens im Rücken und kleinen Becken. Diese Veränderungen traten nicht mehr ab Zyklus 13 auf und auch nicht in der allgemeinen Population. Die Daten zeigen eindrücklich, dass der durch die Ergänzung von Dostarlimab erreichte Benefit in der rezidivfreien Zeit nicht auf Kosten der Lebensqualität erfolgt.
Eine Frage, die sich nun ergibt, ist, ob es die Chemotherapie in den Zeiten der Checkpoint-Blockade überhaupt noch braucht, zumal die Chemotherapie die Lebensqualität vermindert. Eine aktuell rekrutierende Studie wird hierzu Antworten liefern, indem sie Pembrolizumab mit einer Platinum/Taxol-Chemotherapie bei dMMR-Patient:innen mit fortgeschrittener oder rezidivierter Erkrankung untersucht.9 Die zweite Studie, die dies in gleicher Weise, aber mit Dostarlimab statt Pembrolizumab, in den Fokus nimmt, ist die Studie ENGOT-en13/GINECO/DOMENICA.10
Die zweite Frage, die sich bei den Checkpoint-Inhibitor-Studien aufdrängt, ist die zur Dauer der Immuntherapie. In der Studie RUBY wurden Patient:innen bis drei Jahre nach Chemotherapie immuntherapeutisch behandelt, in der vergleichbaren Studie mit Pembrolizumab hingegen nur 84 Wochen.
Neue wichtige Hoffnungsträger in der Therapie von schwierig zu behandelnden Ovarialkarzinompatient:innen mit schlechter Prognose werden bei Patient:innen ohne BRCA-Mutation (Studie DUO-O) und Patient:innen mit Rezidiv, bei denen Platin keine Option mehr darstellt (Studie STRO-002-GM2), gesucht.11,12
Die DUO-O/ENGOT-ov46/AGO-OVAR 23/GOG-3025-Studie13
Seit den Daten der Studie PAOLA-1 ist die Erhaltungstherapie mit dem PARP-Inhibitor Olaparib±Bevacizumab zum Meilenstein der Erhaltungstherapie bei Patient:innen mit BRCA-Mutation mit fortgeschrittenem epithelialem Ovarialkarzinom geworden.14 Die Ergänzungen durch Immuntherapien haben bislang keinen Benefit gezeigt.
Einzig in der Phase-II-Studie MEDIOLA, in der eine Kombination von Durvalumab, Bevacizumab und Olaparib bei Patient:innen ohne Germline-BRCA-Mutation bei einem platinsensitiven Rezidiv gegeben wurde, zeigte sich eine positive klinische Aktivität.15
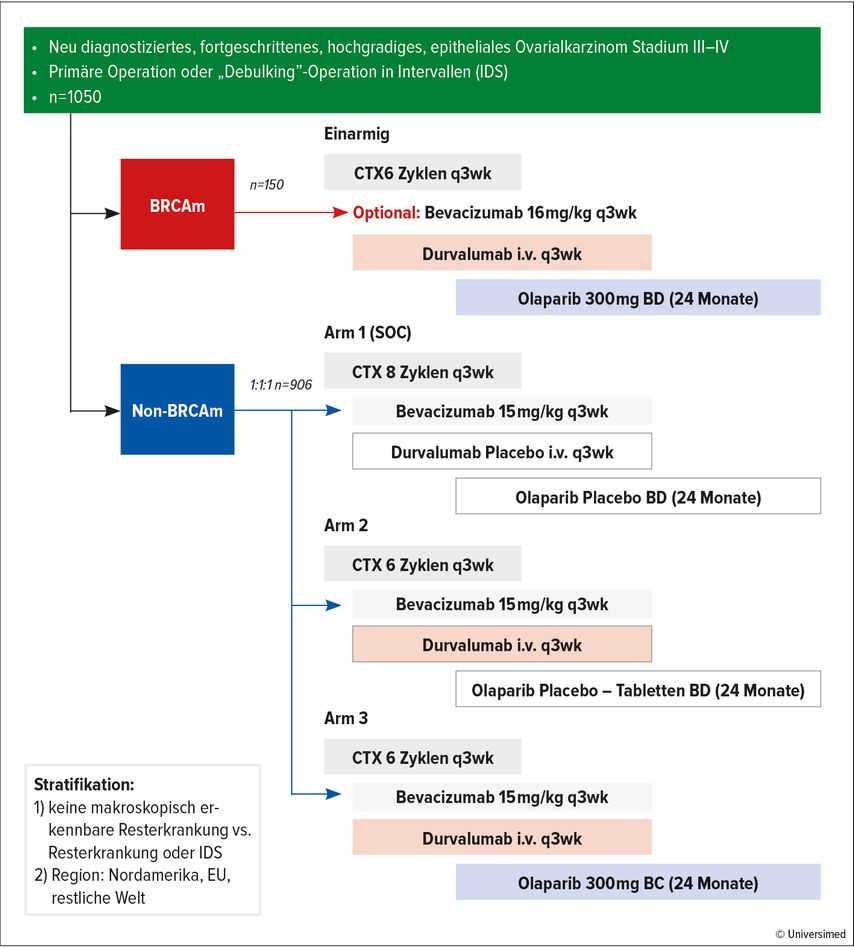
Am ASCO-Jahrestreffen wurden nun die vorgeplanten Interimsdaten zum progressionsfreien Überleben in der Kohorte der Patient:innen mit neu diagnostiziertem, fortgeschrittenem «High-grade»-Ovarialkarzinom ohne BRCA-Mutation im FIGO-Stadium III–IV vorgestellt.
Diese Gruppe von Patient:innen wurde in drei Arme randomisiert (Abb. 1). Im ersten Arm erhielten die Patient:innen Chemotherapie+Bevacizumab, im zweiten Arm Chemotherapie+Bevacizumab+Durvalumab und im dritten Arm Chemotherapie+Bevacizumab+Durvalumab+Olaparib, wobei hier Olaparib erst in der Erhaltung nach Ende der Chemotherapie gegeben wurde.
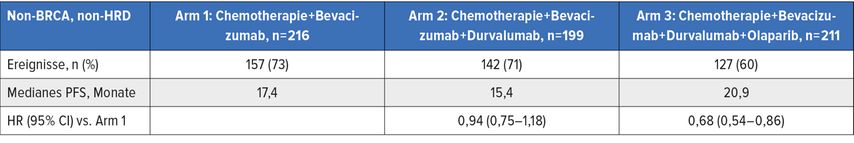
Der Vergleich von Arm 1 und Arm 3 zeigte in der nicht-BRCA-mutierten, aber HRD-positiven Population eine HR von 0,49 (0,39–0,69) mit einem p<0,0001 und einem medianen progressionsfreien Überleben von 37,3 Monaten (in der Vierfachkombination) gegenüber 23 Monaten (in der Zweifachkombination). In der schlechteren, nicht-HRD- und nicht-BRCA-mutierten Kohorte zeigte das mediane progressionsfreie Überleben im selben Vergleich nur eine HR von 0,68 (0,54–0,86; 20,9 vs. 17,4 Monate) (Tab. 1).
Tab. 1: Medianes progressionsfreies Überleben (PFS) in der DUO-O/ENGOT-ov46/AGO-OVAR23/GOG-3025-Studie. Modifiziert nach Harter P et al.13
Nach zwei negativen Immuntherapie-Studien zum Ovarialkarzinom ist DUO-O die erste positive Checkpoint-Inhibitor-Studie beim Ovarialkarzinom.16,17 Sie zeigt auch als erste Studie einen Benefit in der BRCA- und HRD-negativen Patient:innen-Gruppe, im Gegensatz zu anderen Studien davor, die hier keinen Vorteil aufwiesen.14,18 Anders als bei diesen beiden Studien wurde bei DUO-O die Randomisierung bereits zu Beginn der Chemotherapie durchgeführt, das heisst, dass auch Patient:innen mit stabiler Erkrankung in die Studie kamen.
Wir warten nun sehr gespannt auf die Ergebnisse anderer ausstehender Studien zu Immuntherapien in der Erstlinie (FIRST [Dostarlimab+Niraparib], ATHENA-COMBO/GOG-3020 [Nivolumab+Rucaparib], ENGOT-ov43/GOG-3036/KEYLYNK-001 [Pembrolizumab+Olaparib]).19–21
STRO-002: Patient:innen mit FOLRalpha-Expression
Es wurden am ASCO-Jahrestreffen die Daten der Phase-I-Studie STRO-002 zur Dosiseskalation in einer Gruppe von platinresistenten Patient:innen mit bisher aussichtslosen Fallgeschichten vorgestellt.22 Diese Patient:innen haben ein medianes PFS von drei bis vier Monaten und ein medianes Gesamtüberleben von etwa zwölf Monaten.
Zielgerichtete Therapie mit einem Antikörper-Wirkstoff-Konjugat hat grosses Potenzial. Hier wird als Zielstruktur der Folatrezeptor-alpha gewählt, der beim Ovarialkarzinom im Vergleich zu normalem Gewebe überexprimiert ist.
Die Patient:innen wurden in zwei Dosisgruppen randomisiert. Der primäre Endpunkt war die Gesamtansprechrate (ORR). Die Mehrheit der Patient:innen (61%) erhielt fünf oder mehr Zyklen der Therapie. Nur ein kleiner Prozentsatz stoppte die Therapie wegen Nebenwirkungen. In der unselektierten Kohorte wurde eine ORR von 32% demonstriert, und in der Gruppe der Patient:innen mit einer Folatrezeptor-Expression TPS >25% betrug die mediane Dauer des Ansprechens 5,5 Monate und das progressionsfreie Überleben 6,1 Monate.
Die häufigsten Nebenwirkungen waren Neutropenie, Nausea, Fatigue und Arthralgie. Sie führten bei 61,4% der Patient:innen zu einer Dosisreduktion und bei nur 6,8% zu einem Absetzen der Therapie. Die Studie demonstrierte einen sinnvollen Cut-off für die Folatrezeptor-alpha-Expression von >25%. Eine Nachfolgestudie wird demnächst als Phase-II/III-Studie rekrutieren.23
Literatur:
1 Colombo N et al.: Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med 2021; 385: 1856-67 2 Monk BJ et al.: KEYNOTE-826: final overall survival results from a randomized, double-blind, phase 3 study of pembrolizumab + chemotherapy vs placebo + chemotherapy for first-line treatment of persistent, recurrent, or metastatic cervical cancer. J Clin Oncol 2023; 41(Suppl 16): Abstr. #5500 3 Lheureux S et al.: Translational randomized phase II trial of cabozantinib in combination with nivolumab in advanced, recurrent, or metastatic endometrial cancer. J Immunother Cancer 2022; 10(3): e004233 4 Wang H et al.: Camrelizumab plus apatinib in patients with advanced or recurrent endometrial cancer after failure of at least one prior systemic therapy: a single-arm phase II trial. J Clin Oncol 2023; 41(Suppl 16): Abstr. #5516 5 Makker V et al.: Lenvatinib plus pembrolizumab in previously treated advanced endometrial cancer: updated efficacy and safety from the randomized phase III study 309/KEYNOTE-775. J Clin Oncol 2023; 41(Suppl 16): 2904-10 6 Powell MA et al.: Dostarlimab for primary advanced or recurrent (A/R) endometrial cancer (EC): outcomes by blinded independent central review (BICR) of the RUBY trial (ENGOT-EN6-NSGO/GOG-3031/RUBY). J Clin Oncol 2023; 41(Suppl 16): Abstr. #5503 7 Mirza MR et al.: Dostarlimab for primary advanced or recurrent endometrial cancer. N Engl J Med 2023; 388(23): 2145-58 8 Mirza MR et al.: Patient-reported outcomes (PROs) in primary advanced or recurrent endometrial cancer (pA/rEC) for patients (pts) treated with dostarlimab plus carboplatin/paclitaxel (CP) as compared to CP in the ENGOT-EN6/GOG3031/RUBY trial. J Clin Oncol 2023; 41(Suppl 16): Abstr. #5504 9 Slomowitz BM et al.: KEYNOTE-C93/GOG-3064/ENGOT-en15: a phase 3, randomized, open-label study of first-line pembrolizumab versus platinum-doublet chemotherapy in mismatch repair deficient advanced or recurrent endometrial carcinoma. J Clin Oncol 2022; 40(Suppl 16): Abstr. #TPS5623 10 Joly F et al.: Randomized phase III trial in MMR deficient (MMRd) endometrial cancer (EC) patients comparing chemotherapy (CT) alone versus dostarlimab in first line advanced/metastatic setting: DOMENICA study (GINECO-EN105b/ENGOT-en13 study). J Clin Oncol 2023; 41(Suppl 16): Abstr. #TPS5630 11 Harter P et al.: DUO-O: a randomized phase III trial of durvalumab (durva) in combination with chemotherapy and bevacizumab (bev), followed by maintenance durva, bev and olaparib (olap), in newly diagnosed advanced ovarian cancer patients. J Clin Oncol 2019; 37(Suppl 15) 12 Naumann RW et al.: STRO-002-GM2: a phase 1, open-label, safety, pharmacokinetic, and preliminary efficacy study of STRO-002, an anti-folate receptor alpha (FolRα) antibody-drug conjugate (ADC), in combination with bevacizumab in patients with advanced epithelial ovarian cancer (EOC, including fallopian tube or primary peritoneal cancers). J Clin Oncol 2022; 40(Suppl 16): Abstr. #TPS5622 13 Harter P et al.: Durvalumab with paclitaxel/carboplatin (PC) and bevacizumab (bev), followed by maintenance durvalumab, bev, and olaparib in patients (pts) with newly diagnosed advanced ovarian cancer (AOC) without a tumor BRCA1/2 mutation (non-tBRCAm): results from the randomized, placebo (pbo)-controlled phase III DUO-O trial. J Clin Oncol 2023; 41(Suppl 17): Abstr. #LBA5506 14 Ray-Coquard I et al.: Olaparib plus bevacizumab first-line maintenance in ovarian cancer: final overall survival results from the PAOLA-1/ENGOT-ov25 trial. Ann Oncol 2023; 34(8): 681-92 15 Banerjee S et al.: Phase II study of olaparib plus durvalumab with or without bevacizumab (MEDIOLA): final analysis of overall survival in patients with non-germline BRCA-mutated platinum-sensitive relapsed ovarian cancer. Ann Oncol 2022; 33(Suppl 7): S235-82 16 Monk BJ et al.: Chemotherapy with or without avelumab followed by avelumab maintenance versus chemotherapy alone in patients with previously untreated epithelial ovarian cancer (JAVELIN Ovarian 100): an open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22(9): 1275-89 17 Moore KN et al.: Atezolizumab, bevacizumab, and chemotherapy for newly diagnosed stage III or IV ovarian cancer: placebo-controlled randomized phase III trial (IMagyn050/GOG 3015/ENGOT-OV39). J Clin Oncol 2021; 39(17): 1842-55 18 González-Martín A et al.: Niraparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2019; 381: 2391-402 19 Hardy-Bessard AC et al.: ENGOT-OV44/FIRST study: a randomized, double-blind, adaptive, phase III study of platinum-based therapy with dostarlimab (TSR-042) + niraparib versus standard-of-care (SOC) platinum-based therapy as first-line treatment of stage 3/4 non-mucinous epithelial ovarian cancer (OC). J Clin Oncol 2019; 37(Suppl 15) 20 Monk BJ et al.: ATHENA (GOG-3020/ENGOT-ov45): a randomized, phase III trial to evaluate rucaparib as monotherapy (ATHENA-MONO) and rucaparib in combination with nivolumab (ATHENA-COMBO) as maintenance treatment following frontline platinum-based chemotherapy in ovarian cancer. Int J Gynecol Cancer 2021; 31(12): 1589-94 21 Vergote I et al.: ENGOT-OV43/KEYLYNK-001: A phase III, randomized, double-blind, active- and placebo-controlled study of pembrolizumab plus chemotherapy with olaparib maintenance for first-line treatment of BRCA-nonmutated advanced epithelial ovarian cancer. J Clin Oncol 2019; 37(Suppl 15): Abstr. #TPS5603 22 Oaknin A et al.: Luveltamab tazevibulin (STRO-002), an anti-folate receptor alpha (FolRα) antibody drug conjugate (ADC), safety and efficacy in a broad distribution of FolRα expression in patients with recurrent epithelial ovarian cancer (OC): update of STRO-002-GM1 phase 1 dose expansion cohort. J Clin Oncol 2023; 41(Suppl. 16): Abstr. #5508 23 REFRaME-O1: A study to investigate the efficacy and safety of luveltamab tazevibulin in women with ovarian cancer (including fallopian tube or primary peritoneal cancers) expressing FOLR1. ClinicalTrials.gov Identifier: NCT05870748
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...