Guidelines-Update Urologie 2021
Autor:
Dr. Sebastian Graf1,2
1 Abteilung für Urologie und Andrologie
Kepler Universitätsklinikum, Linz
2 Medizinische Fakultät Johannes Kepler Universität Linz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In unserem Fachgebiet konnten wir zuletzt in immer kürzeren Abständen bahnbrechende Neuerungen in Diagnostik und Therapie beobachten. Dies findet nun Abbildung in einigen relevanten Leitlinien, welche rezent überarbeitet oder neu herausgebracht wurden. In diesem Artikel werden die Highlights der im letzten Jahr erschienenen Guidelines zusammengefasst.
Keypoints
-
Die Erkenntnislage ändert sich ständig. Zuletzt wurden viele relevante Leitlinien mit dem neuesten Wissen überarbeitet.
-
Relevante Neuigkeiten sind unter anderem die Keimbahnmutationen bei Prostatakarzinom, die Empfehlung der EAU zur transperinealen Prostatastanzbiopsie, eine neue Definition von oligometastasiertem Prostatakarzinom sowie PSMA-PET/CT zum Primärstaging.
-
Beim Blasentumor wurde die Risikoklassifikation mit weiteren Parametern ergänzt.
In den letzten beiden Jahren sind einige Leitlinien urologischer Fachgesellschaften überarbeitet oder neu erstellt worden. Dies bildet die neue Realität der sich rasch ändernden und zunehmend komplexer werdenden diagnostischen und therapeutischen Landschaft ab. Am Jahreskongress der österreichischen Gesellschaft für Urologie (ÖGU) in Linz im November 2021 wurden die Highlights der neuesten Guidelines der European Association of Urology (EAU) und der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. (AWMF) präsentiert. Im folgenden Artikel werden einige relevante Auszüge aus dieser Präsentation beleuchtet. Alle Neuerungen aufzuzeigen, würde den Rahmen sprengen, daher liegt der Fokus auf denjenigen Änderungen, welche den größten Einfluss auf die Behandlung der meisten Patienten haben werden.
Die Guidelines der EAU werden jedes Jahr im Frühjahr zum Jahreskongress neu herausgebracht. Dabei werden manche völlig überarbeitet, teils überarbeitet oder auch ohne Änderung aus den Vorjahren übernommen. Manche erscheinen auch völlig neu, wie die Guideline Management of Non-Neurogenic Female Lower Urinary Tract Symptoms (LUTS), welche aus der alten Leitlinie für Harninkontinenz hervorgegangen ist. Viele Änderungen gibt es natürlich jedes Jahr in den Leitlinien, in denen Karzinome hoher Inzidenz behandelt werden. Die Updatezyklen der AWMF-Leitlinien folgen zwar keiner jährlichen Rhythmik wie jene der EAU, aber auch von der AWMF sind in letzter Zeit einige relevante Leitlinien überarbeitet worden.
Prostatakarzinom
Neues aus der Therapie
Vor mittlerweile einem Jahr, im November 2020, wurde mit Olaparib (Lynparza®) der erste PARP-Inhibitor bei metastasiertem Prostatakarzinom zugelassen.
Für welche Patienten ist dies nun relevant? Der Zulassung zugrunde liegt die sogenannte PROfound-Studie, wo metastasierte Patienten im progredienten Status nach einer Vortherapie mit Taxanen oder einem „androgen receptor targeting agent“ (ARTA) randomisiert entweder Olaparib oder ein anderes ARTA (in 2:1-Allokation) erhalten haben. Eingeschlossen wurden nur Patienten mit Mutationen in Tumorsuppressorgenen. Letztlich zeigte sich in derjenigen Subgruppe an Probanden, in welchen eine BRCA1/2- oder ATM-Mutation nachgewiesen wurde, ein beeindruckender Vorteil in der Ansprechrate und im progressionsfreien Überleben einerseits, andererseits auch im Gesamtüberleben.1,2
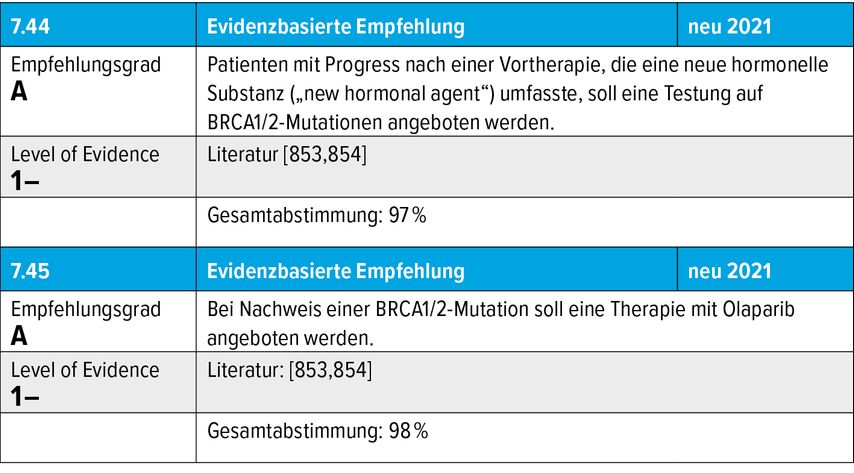
Welchen Einfluss hat dies nun auf die neuen Leitlinien? Die EAU empfiehlt, dass alle metastasierten Patienten nun auf die sogenannten High-Risk-Mutationen untersucht werden sollen.3 Die AWMF empfiehlt das nur bei metastasierten Patienten, die auf ein ARTA progredient werden (Tab.1).4 Die Inzidenz dieser Keimbahnmutationen beläuft sich in diesem Kollektiv auf 11,8% (BRCA1/2, ATM, CHEK2, PALB2).5 Und wie untersucht man nun diese Patienten auf die genannten Mutationen? Am besten mit einer Biopsie aus einer Metastase. Liegt die Prostatektomie nicht lange zurück, kann die Bestimmung auch aus dem Präparat erfolgen. Dafür gibt es derzeit nur ein diagnostisches Tool, das eine FDA-Zulassung hat, FoundationOne, aber die Diagnostik kann auf allen molekularpathologischen Wegen geschehen.
Tab. 1: Therapiesequenz nach Vortherapie mit mindestens einer neuen hormonellen Substanz, zusammengefasst nach S3-Leitlinie Prostatakarzinom4
Prostatabiopsie, quo vadis?
Ein seit kurzer Zeit sehr heiß diskutiertes Thema ist die Prostatabiopsie. Derzeit werden europaweit die allermeisten Stanzbiopsien transrektal durchgeführt. Dennoch empfiehlt die EAU in den neuen Leitlinien nachdrücklich die transperineale Biopsie als Standardmethode (Tab. 2). In der Rechtfertigung dafür werden große Übersichtsarbeiten angeführt, welche ein signifikant reduziertes Sepsisrisiko sowie weniger ungeplante Rehospitalisierungen festgestellt haben.6,7 Auch gibt es Hinweise, dass damit um ca. 10% mehr klinisch signifikante Karzinome gefunden werden.
Prof. Nicolas Mottet, Vorsitzender des Prostataguideline-Panels der EAU, sagt dazu, dass bis zum Ende dieses Jahres die transrektale Biopsie völlig verschwunden sein wird.8
Auch wenn die perineale Biopsie problemlos in lokaler Anästhesie und Hautkeimprophylaxe durchgeführt werden kann, hat sich diese in Österreich und Deutschland bei Weitem nicht flächendeckend durchgesetzt.
In unserem Kontext lohnt ein Blick auf die hintergründlichen Studien, um zu sehen, wie es zu dieser konkreten Empfehlung kam: Bezug genommen wird einerseits auf einen Review, welcher schon 2015 publiziert wurde.6 In diesem wurden Studien von den Jahren 1971 bis 2013 eingeschlossen – mit insgesamt über 160000 Patienten aus der ganzen Welt. Es wurde keine Aussage zur Infektionsprophylaxe während der Stanzbiopsien gemacht – wohl aufgrund der extremen Zeitspanne und örtlichen Unterschiede. Zusätzlich war ein „publication bias“ nur bei US-amerikanischen Studien untersuchbar, da die Anzahl der sonstigen eingeschlossenen Arbeiten zu gering war. Der Knackpunkt findet sich in den Supplementary Tables: Insgesamt wurden nur drei Arbeiten aus Deutschland oder Österreich eingeschlossen. In diesen Arbeiten wurden überhaupt keine transperinealen Biopsien betrachtet, das Kollektiv bestand nur aus transrektalen Biopsien. Darüber hinaus war die Sepsis- und Rehospitalisationsrate bei diesen transrektalen Stanzbiopsien sogar niedriger als jene insgesamt bei transperinealen Biopsien, welche jetzt als Rechtfertigung für flächendeckende transperineale Stanzen angeführt werden.
Eine zweite Studie ist eine Populationsstudie aus dem Vereinigten Königreich mit über 70000 Patienten. Hier wurden nahezu alle Patienten eingeschlossen, welche im NHS einer Stanzbiopsie zugeführt wurden.7 Dort zeigten sich für die perineale Biopsie zwei Dinge: einerseits eine signifikant niedrigere Rate an Sepsis, andererseits eine signifikant höhere Anzahl an Harnverhalt, und zwar in folgender Größenordnung: Man müsste 278 perineale Biopsien durchführen, um eine Sepsis aufgrund einer transrektalen Biopsie zu verhindern. Gleichzeitig würden dabei drei Patienten mit Harnverhalt wieder vorstellig werden, die diesen nicht gehabt hätten, wären sie transrektal biopsiert worden.
Andere Populationsstudien kommen zum selben Ergebnis, jedoch mit jeweils niedrigerer statistischer Aussagekraft.
Ob diese Rechtfertigungsgründe ausreichen, um flächendeckend auf transperineale Biopsien umzusteigen, bleibt zu diskutieren. Vor einer solchen Empfehlung auf nationaler Ebene sollte die lokale Komplikationsrate systematisch erhoben werden. Die neue S3-Leitlinie gibt daher auch zur Art der Prostatabiopsie keine Empfehlung ab.
Auch zur transrektalen Biopsie wird in den neuen EAU-Guidelines Stellung genommen: Dass Fluorchinolone zur Prophylaxe tot sind, ist seit der EMA-Warnung 2018 bekannt.9 Während sich Fosfomycin de facto als neues Antibiotikum der Wahl bei der Stanze etabliert hat, wird eher zu einer individuellen Prophylaxe auf Basis eines Rektalabstriches geraten. Zusätzlich ist nun auch die rektale Säuberung mit einer Iodlösung empfohlen.
Stellenwert der MRT
Neuigkeiten gibt es auch zum Stellenwert der Magnetresonanztomografie (MRT) in der Primärdiagnostik: Die S3-Leitlinien empfehlen nun auch vor jeder Biopsie eine MRT. Das deckt sich jetzt mit den EAU-Leitlinien, welche dies seit 2019 anführen. Dort ist zuletzt die Stärke der Empfehlung aufgrund der besseren Datenlage gestiegen. Bei PIRADS 4 und 5 sollte zusätzlich zu systematischen Biopsien auch eine gezielte Punktion erfolgen (Expertenkonsens). Grund dafür sind rezente Übersichtsarbeiten, welche der Kombination aus MR und Stanze eine um 10% bessere Detektionsrate an klinisch signifikanten Karzinomen attestieren.10 Dennoch werden auch mit dieser Kombination bis zu 20% klinisch signifikanter Karzinome nicht detektiert, wie Studien aus Prostatektomiepräparaten gezeigt haben. Erwähnt wird auch, dass weder die kognitive noch die technische Fusion der jeweils anderen Methode überlegen ist.
Dilemma PSMA-PET/CT – wie Patienten zur Therapie einstufen?
Zur Prostata-Membranantigen-Positronenemissionstomografie/Computertomografie (PSMA-PET/CT) gibt es auch eine relevante Änderung: Eine rezente, gute, randomisierte Kontrollstudie (der sogenannte proPSMA trial) attestiert dem PSMA-PET/CT in Kombination mit MRT wesentlich höhere Spezifität und Sensitivität in der Detektion von Lymphknotenmetastasen als die konventionelle Bildgebung mittels CT und Knochenszintigrafie.11 Diese Erkenntnis wird nun in der neuen S3-Leitlinie abgebildet, in der zum Primärstaging von Patienten mit High-Risk-Prostatakarzinom mit PSMA-PET/CT nun eine „Kann“-Empfehlung ausgesprochen wurde. Das führt uns aber in ein Dilemma: Alle Empfehlungen, auch jene der aktuellen Leitlinien, basieren auf prognostischen Daten, die mithilfe dieser konventionellen Bildgebung erarbeitet wurden. Sollten wir diese Patienten also behandeln wie metastasierte oder nicht metastasierte?
Neu in der S3-Leitlinie ist eine einheitliche Definition für Oligometastasierung, und zwar sind das maximal 4 ossäre Metastasen. Diese Definition richtet sich recht pragmatisch nach den Kriterien der großen Studien, wie zum Beispiel der Low-Risk-Definition bei LATITUDE oder der „Low volume“-Definition bei CHAARTED. Eine Radiotherapie der Prostata zusätzlich zum Hormonentzug bringt keinen Überlebensvorteil bei unselektionierten metastasierten Patienten, aber einen signifikanten Unterschied bei oligometastasierten Patienten.12,13 Aus diesem Grund findet sich sowohl in der aktuellen S3-Leitlinie als auch in der EAU-Guideline die Empfehlung, eine solche Befundkonstellation mit einer Radiotherapie der Prostata zusätzlich zum Hormonentzug zu behandeln. Nicht unerwähnt bleiben darf hier, dass die diagnostischen Kriterien wieder einmal anhand konventioneller Bildgebung mit Knochenszintigrafie und CT erstellt wurden. In Zeiten von flächendeckendem PSMA-PET bleiben diese Kriterien noch zu überprüfen.
Urothelkarzinom
Bisher wurden Patienten mit nicht muskelinvasivem Urothelkarzinom der Harnblase anhand der altbekannten EORTC-Tabelle in drei Risikogruppen zu Progression und Rezidiv eingeteilt. Dies hat Einfluss auf die Empfehlungen zum Follow-up, zu adjuvanten Therapien oder sogar zur Frühzystektomie. Low-Risk-Tumoren und High-Risk-Tumoren haben hier ihre definierenden Eigenschaften und die intermediäre Gruppe war alles, was nicht in eine der beiden Kategorien passte.
2021 wurde eine neue Risikoklassifikation vorgestellt, welche eigentlich nur eine Präzisierung der alten darstellt. Zusätzlich zu den bekannten Determinanten werden nun auch das Alter, die Tumorgröße, die Anzahl der Tumoren und die Frage, ob es sich um einen Erstbefund oder um ein Rezidiv handelt, in die Rechnung aufgenommen (Tab. 3). Es stellte sich nämlich in immer besseren Daten heraus, dass diese Faktoren jeweils auch unabhängige Risikofaktoren für Progression und Rezidiv sind. Vielerorts sind diese Faktoren allein schon aus dem klinischen Erfahrungsschatz heraus in die Therapieempfehlung eingeflossen. Dies wurde nun in den EAU-Leitlinien abgebildet. Die EAU hat dazu einen praktischen Risikorechner erstellt, welchen man auf der Website https://nmibc.net abrufen kann. Gleichzeitig kann dieser Rechner als App heruntergeladen werden.
Weitere Leitlinien
Abseits des Dauerbrenners Onkologie hat sich auch in anderen Leitlinien einiges getan. Das Kapitel Priapismus wurde zum Beispiel in den Infertility-Guidelines der EAU auf ganzen 21 Seiten neu erstellt. Dazu wurden im letzten Halbjahr systematische Reviews durchgeführt.
Zum Thema LUTS bei Männern wurde das Kapitel chirurgische Therapie der BPH überarbeitet und bildet nun die zunehmenden Therapieformen ab. Die Inkontinenz-Guideline heißt nun LUTS bei der Frau und wurde neu gegliedert.
Und zu guter Letzt hat die AWMF nun endlich eine Leitlinie zum Peniskarzinom herausgegeben.14
Literatur:
1 de Bono J et al.: Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med 2020; 382(22): 2091-102 2 Hussain M et al.: Survival with olaparib in metastatic castration-resistant prostate cancer. N Engl J Med 2020; 383(24): 2345-57 3 EAU Guidelines. Edn. presented at the EAU Annual Congress, Milan 2021. ISBN: 978-94-92671-13-4 4 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft DK, AWMF). S3-Leitlinie Prostatakarzinom, Langversion 6.2, 2021, AWMF-Registernummer: 043/022OL p. 365 5 Pritchard CC et al.: Inherited DNA-repair gene mutations in men with metastatic prostate cancer. N Engl J Med 2016; 375(5): 443-53 6 Bennett HY et al.: The global burden of major infectious complications following prostate biopsy. Epidemiol Infect 2016; 144(8): 1784-91 7 Berry B et al.: Comparison of complications after transrectal and transperineal prostate biopsy: a national population-based study. BJU International 2020; 126(1): 97-103 8 EAU Podcasts: Prof. Nicolas Mottet on new guideline recommendations for prostate cancer 9 FDA updates warnings for fluoroquinolone antibiotics on risks of mental health and low blood sugar adverse reactions | FDA July 10, 2018 10 Drost FH et al.: Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database Syst Rev 2019; 25(4): CD012663 11 Hofman MS et al.: Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 2020; 395(10231): 1208-16 12 Parker CC et al.: Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet 2018; 392(10162): 2353-66 13 Burdett S et al.: Prostate radiotherapy for metastatic hormone-sensitive prostate cancer: a STOPCAP systematic review and meta-analysis. Eur Urol 2019; 76(1): 115-24 14 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft DK, AWMF). S3-Leitlinie Diagnostik, Therapie und Nachsorge des Peniskarzinoms, Langversion 1.0, 2020; AWMF-Registernummer: 043-042OL [Internet]. 2020 [cited 2021 Nov 10]
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...