GIST-Diagnostik: Bildgebung, Endoskopie und Biopsie
Autor:
Assoc. Prof. PD Dr. Erwin Rieder, FACS
Universitätsklinik für Chirurgie
Medizinische Universität Wien
E-Mail: erwin.rieder@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Gastrointestinale Stromatumoren (GIST) sind die häufigsten malignen mesenchymalen Tumoren, die endophytisch oder exophytisch im Gastrointestinaltrakt wachsen können. Typische endoskopische Merkmale führen gemeinsam mit der endosonografischen Biopsie meist bereits zur richtigen Diagnose. Der kontrastmittelunterstützten Computertomografie (CT) kommt allerdings die größte Bedeutung hinsichtlich des präoperativen Stagings zu. Gleichzeitig erlaubt das CT durch genau definierte Größen- und Dichtekriterien, zwischen Remission oder Progression während einer medikamentösen Therapie unterscheiden zu können.
Gastrointestinale Stromatumoren (GIST) sind die häufigsten malignen mesenchymalen Tumoren des Gastrointestinaltrakts. Die meisten GIST zeigen Mutationen im Bereich des c-KIT-Proto-Onkogen oder – weniger häufig – im Bereich des PDGF(„platelet-derived growth factor“)-Rezeptors alpha, was sie sensitiv für eine eventuell notwendige medikamentöse Therapie mit Imatinib macht.
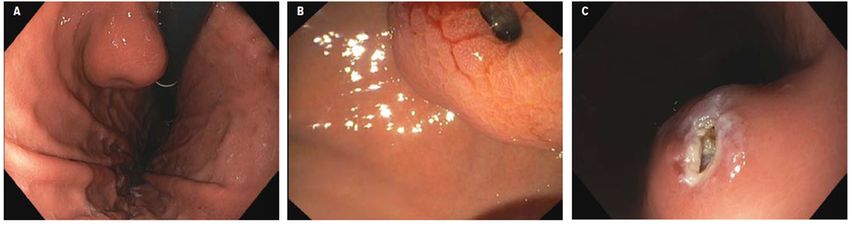
Die publizierte Inzidenz beträgt nur 0,4–2 Fälle pro 100000 pro Jahr, mit einem medianen Alter der Patienten von 60–65 Jahren bei einer nahezu ausgeglichenen Geschlechterverteilung.1 Am häufigsten sind gastrointestinale Stromatumoren im Magen (40–60%) beziehungsweise im Dünndarm (20–30%) zu finden, deren Symptomatik, abhängig von der genauen Lokalisation, meist unspezifisch ist. GIST können aber auch durch akute gastrointestinale Blutungen oder als akuter chirurgischer Notfall auffällig werden. Zu einem großen Anteil werden GIST inzidentell im Rahmen von Endoskopien (Abb. 1A und B) oder von anderen Operationen entdeckt.1
Dieser Artikel soll kurz die derzeitigen Empfehlungen der GIST-Diagnostik zusammenfassen.
Empfehlungen zu Endoskopie und Biopsie bei kleinen Tumoren <2cm
Laut aktuellen Richtlinien2 sind der endoskopische Ultraschall (EUS) und die endosonografische Biopsie ein wichtiger Teil der Standarddiagnostik bei ösophagogastralen oder duodenalen Tumoren dieser Größe. Die Biopsie erweist sich allerdings unter Umständen als nicht suffizient, woraufhin die chirurgische Exzision zur Sicherung der Histologie und damit der Diagnose notwendig wird.
Grundsätzlich soll nach aktuellen Richtlinien auch ein kleiner (<2cm), histologisch verifizierter GIST reseziert werden, wenn dies ohne relevante Morbidität aufgrund der Lokalisation möglich ist. Bei einem derartig kleinen GIST im Magen ist allerdings auch das „watchful waiting“ eine Therapieoption und die Resektion erfolgt erst bei einer eventuellen Größenzunahme. Eine exakte evidenzbasierte Strategie bezüglich der Häufigkeit und Art dieser Vorsorge gibt es hierbei nicht.
Im Gegensatz zu kleinen GIST im Magen oder Dünndarm, deren Risiko meist als sehr niedrig oder niedrig eingeschätzt wird, wird die Prognose im Rektum als signifikant schlechter eingeschätzt und eine Biopsie oder Exzision gefordert.
Abb. 1: A) Endoskopisches Bild eines endophytisch wachsenden GIST im Magen, mit der typischen Einziehung als Zeichen eines derzeit abgeheilten oberflächlichen Ulkus. B) Endoskopisches Bild eines GIST mit einem tiefen Ulkus an der Oberfläche. C) Endoskopisches Bild eines GIST während einer Schlüsselloch-Biopsie
Empfehlungen zu Endoskopie und Biopsie bei Tumoren >2cm
Das empfohlene Vorgehen2 bei Tumoren >2cm ist grundsätzlich die endosonografische Biopsie und hiermit die Sicherung der oft suspizierten Diagnose. Falls keine EUS-Biopsie verfügbar bzw. nicht durchführbar ist, kann bei einem endophytisch wachsenden Tumor auch eine „Schlüssellochbiopsie“ (Abb. 1C) durchgeführt werden, um entsprechendes Gewebe zu akquirieren.3 Hierbei kann nach Entfernung der Mukosa das darunter gelegene, potenzielle GIST-Gewebe biopsiert werden. Eine perkutane Biopsie war aufgrund der möglichen Tumorzell-Aussaat bis dato nicht empfohlen. Obwohl kontroversiell diskutiert, konnten rezente Arbeiten allerdings zeigen, dass das Rezidivrisiko bei Patient*innen, die nach der subsequenten Resektion aufgrund der Prognose ohnehin eine adjuvante Standardtherapie mit Imatinib erhielten, nicht erhöht war.4
Nach Diagnosesicherung wird bei diesen größeren Tumoren aufgrund des höheren Progressionsrisikos die Exzision empfohlen.
Die endgültige Prognose des GIST kann durch histologische Aufarbeitung der Biopsie grundsätzlich schlecht bestimmt werden und wird daher an der endgültigen Histologie des resezierten Tumors diagnostiziert. Hierbei wird anhand der Tumorgröße und der histopathologischen Bestimmung der Mitosenanzahl in 5mm2-Sichtfeldern je nach GIST-Lokalisation das Rezidivrisiko bestimmt. Hierdurch wird auch die Notwendigkeit einer adjuvanten medikamentösen Therapie abgeleitet. Zur Risikostratifizierung wird hierbei die Klassifikation nach Miettinen oder die modifizierte WHO(World Health Organization)-Klassifikation angewandt.5,6
Schnittbildgebung
Die kontrastmittelunterstützte Computertomografie (CT) ist in einem wichtigen Konsensus-Report der German GIST Imaging Working Group als Standardmethode der GIST-Bildgebung definiert.7 Die Magnetresonanztomografie (MRT) wird hierin lediglich bei speziellen Indikationen wie z.B. Kontrastmittelallergie oder bei leberspezifischen Fragstellungen empfohlen. Auch die 18-Fluor-Deoxyglukose-Positronen-Emissionstomografie (FDG-PET) zeigte sich vor einer chirurgischen Resektion zunächst nicht sinnvoll. Im initialen Staging hat die FDG-PET im Vergleich zum CT eine vergleichbare Sensitivität.
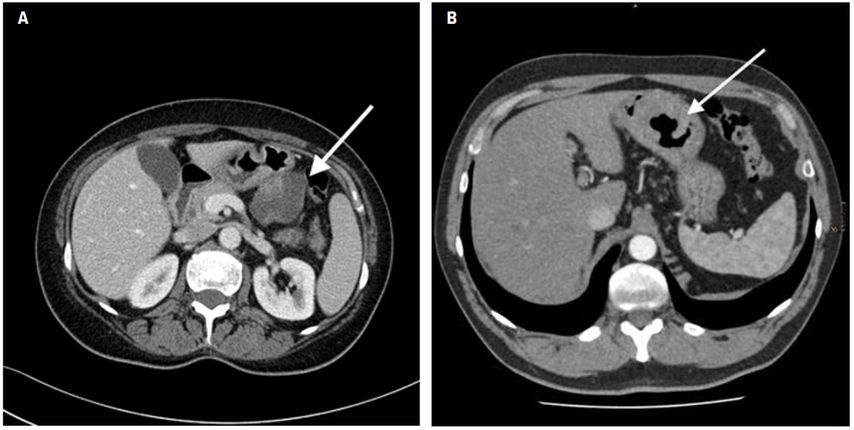
In der CT ist ein GIST als hypodenser Tumor zu erkennen, welcher teilweise komplexe Strukturen innerhalb der Tumormasse zeigen kann (Abb. 2A). Insbesondere bei größeren GIST bilden sich oftmals Nekrose- oder hämorrhagische Areale, welche im CT das inhomogene Bild des GIST erzeugen. Das oft typische endoskopische Merkmal eines endophytisch wachsenden GIST des Magens, der oberflächliche tiefe Ulkus, ist im CT manchmal als Torricelli-Bernoulli-Zeichen zu erkennen.8 Dieses zeigt Luft innerhalb des nekrotischen Ulkus in einem gastrointestinalen Tumor (Abb. 2B), sichtbar in einem axialen CT.
Zur genaueren Beurteilung des GIST während medikamentöser Therapie gibt es spezielle Merkmale. Hierbei haben sich zwei Schemata zur radiologischen Beurteilung etabliert, welche die GIST-Läsionen anhand verschiedener Kriterien evaluieren. Im Allgemeinen basiert die CT-Beurteilung des medikamentösen Therapieerfolges auf Veränderungen des Tumorvolumens, der Tumordichte sowie dem Auftreten von neuen Läsionen. Hierbei kann es auch zu neuen Läsionen innerhalb von zunächst bildgebend stabilen Läsionen kommen.
Bei Ansprechen des Tumors auf die medikamentöse Therapie kann einerseits eine Größenreduktion des GIST auftreten, es kann aber auch zu einer verringerten Tumordichte kommen, welche sich gemessen durch die „Houndsfield units“ (HU) im CT definieren lassen. Andererseits kann es bei einer Tumorprogression zu einer Zunahme des Durchmessers des Tumors oder aber zu einer höheren Tumordichte kommen. Hierfür werden einerseits die RECIST-(„Response Evaluation Criteria in Solid Tumors“)-Kriterien beziehungsweise die Kriterien nach Choi et al. benutzt.7
Da die RECIST-Kriterien bei einzelnen Läsionen ausschließlich den längsten axialen Durchmesser evaluieren, kann hiermit das Tumoransprechen oft nicht suffizient bestimmt werden. Choi et al. beschrieben daraufhin Kriterien, welche auch die Tumordichte involvieren, um somit zuverlässigere quantitative Mittel für das Tumor-Monitoring zu bieten.
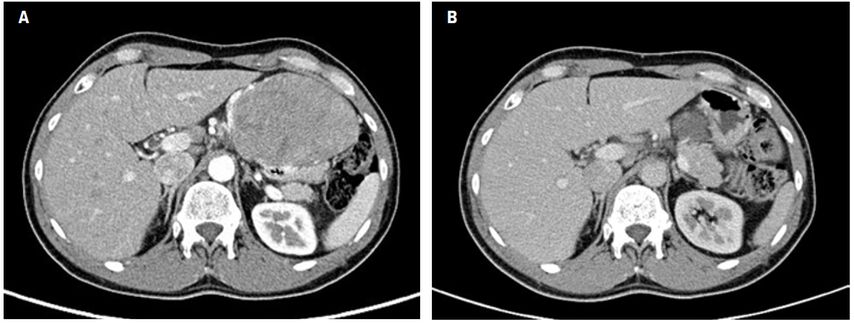
Das CT ist suffizient, um die Plateauphase des Tumoransprechens während einer neoadjuvanten Therapie und somit den optimalen Zeitpunkt für eine Resektion zu detektieren (Abb. 3). Allerdings werden von mehreren Studien Limitationen dieser Kriterien im adjuvanten fortgeschrittenen Setting beschrieben. Im Speziellen kann die Morphologie von Lebermetastasen oder die zystische Degeneration von GIST-Läsionen unter Therapie oft nicht hinlänglich beurteilt werden und die Verwendung beziehungsweise klinische Korrelation der unterschiedlichen Kriterien und deren Einteilung in Progression oder stabile Erkrankung wird derzeit kontroversiell diskutiert. Das FDG-PET, gleich sensitiv wie das CT im initialen Staging, zeigt allerdings Vorteile in der Früherkennung eines medikamentösen Ansprechens. Dadurch erscheint das FDG-PET die bessere Bildgebung für Patient*innen unter Imatinib zu sein. Vielversprechende neue CT-basierte Kriterien mit dem „dual energy CT“ sowie dem „dynamic perfusion CT“ müssen allerdings noch in größeren Studien evaluiert werden.
Abb. 3: Staging eines großen GIST vor neoadjuvanter Therapie mit Imatinib und Re-Staging nach gutem Ansprechen vor chirurgischer Resektion
Fazit
Ein gastrointestinaler Stromatumor wird oft als Zufallsbefund in der Endoskopie oder bei unspezifischen Beschwerden in einer Computertomografie entdeckt. Ein endophytisch wachsender GIST zeigt sich in der Endoskopie oft als typische Läsion mit einem oberflächlichen Ulkus, während der exophytische wachsende GIST auch oft ein typisches Bild in der CT zeigt. Die Diagnose soll durch eine endosonografische Biopsie verifiziert werden und die Resektion wird auch bei kleinen Tumoren empfohlen. Das CT erscheint suffizient, um ein Ansprechen der neoadjuvanten Therapie evaluieren zu können, falls der Organerhalt nicht gewährleistet werden kann. Während die MRT nur in speziellen Situationen indiziert ist, kann das FDG-PET den Erfolg einer medikamentösen Langzeitherapie früher detektieren.
Literatur:
1 Rieder E et al.: ACO-ASSO Manual update 2020. Online unter aco-asso.at. Abgerufen am 3. Februar 2022 2 Casali PG et al.: Gastrointestinal stromal tumours: ESMO–EURACAN–GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2022; 33: 20-33 3 Zoundjiekpon V et al.: Endosonography-Guided Fine-needle Aspiration versus ”Key-Hole Biopsy” in the diagnostics of upper gastrointestinal subepithelial tumors. Aprospective RCT. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2020; 164(1): 63-70 4 Erikson M et al.: Needle biopsy through the abdominal wall for the diagnosis of gastrointestinal stromal tumour. Does it increase the risk for tumour cell seeding and recurrence? Eur J Cancer 2016; 59: 128-33 5 Miettinen M, Lasota J: Gastrointestinal stroma tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006; 23: 70-83 6 Joensuu H: risk stratification of patients with gastrointestinal stroma tumor. Hum Pathol 2008; 39: 1411-9 7 Kalkman J et al.: Consensus report on the radiological management of patients with gastrointestinal stroma tumors (GIST): recommendations of the German GIST Imaging Working Group. Cancer Imaging 2012; 12: 126-135 8 Fortman BJ: Toricelli-Bernoulli sign in an ulcerating gastric leimyosarcoma. Am J Roentggenology 1999; 173: 199-200
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...