Genotypen beim Blasenkarzinom: Gibt es neue Therapieoptionen?
Spitalzentrum Biel, Schweiz
Department of Biosystems Science<br>and Engineering,<br>ETH Zürich, Schweiz
Departement für Urologie,<br/> Inselspital Bern, Schweiz<br/> E-Mail: roland.seiler@insel.ch
Nach Jahrzehnten unveränderter Diagnostik, Therapie und Nachsorge des Urothelkarzinoms der Blase möchten wir einen einfach verständlichen Einblick geben in die sich aktuell schnell entwickelnde Thematik der Kategorisierung in Genotypen. Diese werden in Zukunft einen grossen Einfluss auf das Screening, die Therapie und die Nachkontrolle haben.
Keypoints
-
Molekulare Phänotypen verbessern unser Verständnis des Urothelkarzinoms.
-
Konsensus-Subtypen sollten für weitere Studie als Referenz verwendet werden.
-
Die Tumorheterogenität limitiert höhere Ansprechraten selbst in stark präselektierten Patientengruppen.
Grundlagen
Um dem Anspruch einer spezifischeren Therapie näherzukommen, wird versucht,das Urothelkarzinom in verschiedene Klassen einzuteilen. Eine erste einfache makroskopische Unterscheidung des Tumors gelingt bei der Zystoskopie und Mikroskopie mit der Unterteilung in papillär und nicht papillär.
Wu XR hat vor 15 Jahren aufgrund dieser Differenzierung zwei Entstehungswege beschrieben.1 Zum einen den selteneren nichtpapillären Tumor, welcher über Carcinoma in situ und Dysplasie zu einem invasiven High-Grade-Tumor führt; zum anderen den häufigeren papillären Tumor, welcher über eine Hyperplasie zu einem nicht invasiven Low-Grade-Tumor führt. Dieser kann bei einem Rezidiv und nach Erwerben von weiteren genetischen Schäden in einen invasiven High-Grade-Tumor übergehen.
Mit wachsendem onkogenetischem Verständnis sind über die Zeit neue mögliche Einteilungen entdeckt und beschrieben worden.2 McConkey et al. haben die bisherigen von verschiedenen Gruppen vorgeschlagenen Klassifikationen zusammengefasst.3 Allen gemein war eine Unterscheidung zwischen luminal und basal mit weiteren verschiedenen Kategorien.
Eine internationale Gruppe von Blasenkarzinomforschern hat eine gemeinsame Klassifikation erstellt, welche sechs Kategorien unterscheidet.4 Die sechs definierten Kategorien mit ihrer Häufigkeit beim muskelinvasiven Urothelkarzinom sind in der Abbildung 1 dargestellt. Diese Klassifikation hat das Ziel, die bisherigen Klassifikationen zu konsolidieren, und soll durch die internationale Nutzung dieses Standards zukünftige Studienresultate vergleichbarer machen.5
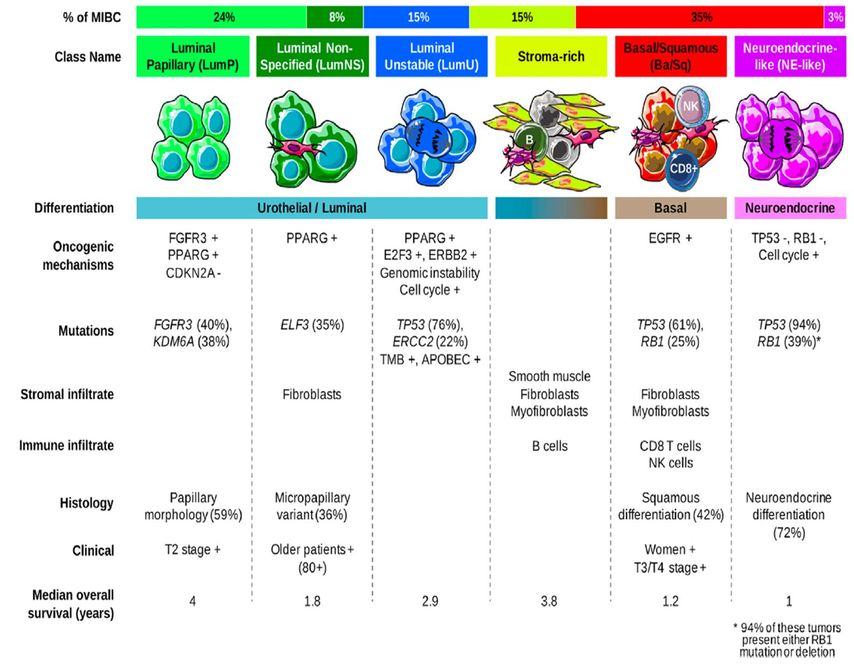
Abb. 1: Konsensus-Subtypen-Klassifikation4
Klinische Signifikanz und Nutzen von Genotyp-Einteilungen
Damit eine Klassifikation Sinn macht, muss langfristig eine klinische Signifikanz gezeigt werden können. Eine Validierung dieser Klassifikation für die Vorhersage von Ansprechraten oder spezifischen Behandlungen steht zurzeit noch aus. Allerdings konnte bereits gezeigt werden, dass innerhalb der Subtypen die luminalen Tumoren ohne neoadjuvante Chemotherapie mit der höchsten Überlebensrate verbunden sind. Zudem wird angenommen, dass die basalen Subtypen die Gruppe mit dem grössten Nutzen einer neoadjuvanten Chemotherapie sind.6 Somit wurde gezeigt, dass die Klassifikation bezüglich Prognose richtungsweisend ist. Ein weiterer möglicher Nutzen der Klassifikation dieser Genotypen ergibt sich durch das Verständnis von Biomarkertests, auf welche wir im nächsten Abschnitt eingehen.
Nachsorge mit Biomarkertest
Bereits heute wird versucht, mittels Biomarkeranalysen in Urinproben Krebsmonitoring/-überwachung durchzuführen. Zum Verständnis der Wertigkeit ist es wichtig, zu analysieren, welche Parameter die entsprechenden Produkte messen.7, 8 Auch kann nur mit dem Verständnis verschiedener molekularer Subgruppen des Urothelkarzinoms eine kritische Betrachtung der aktuellen Bladder Cancer Kits wie zum Beispiel desUroVysion® von Abbott oder des Xpert® von Cepheid stattfinden.
So misst zum Beispiel der Xpert® Bladder Test ANXA10, IGF2, CRH, UPK1B und ABL1 mittels Real-Time-PCR im Urin.7 Wenn man die Abbildung 2 betrachtet, fällt auf, dass mit diesem Test zwar gegebenenfalls luminal-papilläre, luminal nichtspezifische und luminal instabile Tumoren gefunden werden können, aber schon die Stroma-reiche Gruppe nur noch grenzwertig abgedeckt wird und die Basal-/Plattenepithelzell- sowie die neuroendokrin-ähnlichen Gruppen möglicherweise nicht erkannt werden.
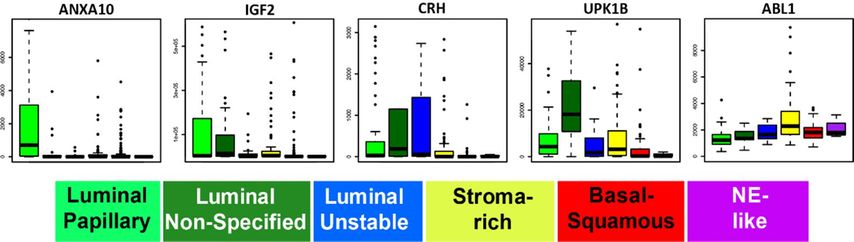
Abb. 2: Verteilung der Expression der einzelnen Marker des Xpert® Bladder Test in Urothelkarzinomen aus der TCGA-Datenbank
FGFR-Mutation als Schlüssel zum Therapieerfolg?
Gezielte Therapie am Beispiel von Erdafitinib
In einer kürzlich publizierten Studie über die Verwendung des Fibro-blasten-Wachstumsfaktor-Rezeptor(FGFR)-spezifischen Tyrosinkinaseinhibitors Erdafitinib bei lokal fortgeschrittenem oder metastasiertem Urothelkarzinom wurden Tumoren mit FGFR3-Mutationen oder FGFR-2/3-Fusionen selektioniert.9 Damit fand eine Auswahl von Tumoren vom luminal-papillären Subtyp statt. Trotz hochselektionierter Patienten konnte allerdings nur eine Ansprechrate von 40% gezeigt werden.
Verschiedene Ursachen könnten erklären, warum keine höhere Ansprechrate erreicht werden konnte. Zum einen könnte die Varianz in der Dynamik der Progression eine Rolle gespielt haben. Einige Patienten haben möglicherweise eine schnelle Progression und Metastasierung im Vergleich zu anderen Patienten mit langsamerer Progression und weniger Metastasierungstendenz. Somit besteht möglicherweise ein Unterschied im natürlichen Krankheitsverlauf. Zum anderen haben Loriot et al. in ihrer Studie Bulk-Profile von einer Probe untersucht.9 Faltas et al. haben jedoch bereits früher gezeigt, dass verschiedene Metastasen verschiedene Mutationen aufweisen können.10 Dies würde bedeuten, dass zwar die untersuchte Probe die Mutation aufweist und gezielt therapiert werden kann, aber die anderen Lokalisationen diese Mutation möglicherweise nicht aufweisen. Weitersist die intratumorale Heterogenität zu beachten, auf welche wir im nächsten Abschnitt eingehen.
Intratumorale Heterogenität
Auch ein FGFR-mutierter Tumor kann Regionen aufweisen, welche die FGFR-Mutation nicht enthalten oder in denen der Signalweg wenig aktiv ist. Um dies zu zeigen, haben wir aus einer Tumorbiopsie eine Einzelzellanalyse auf Transkriptionsebene durchgeführt (Einzelzell-RNA-Sequenzierung, Abb. 3).
Im hier angegebenen Beispiel wurden 3852 Zellen analysiert. Es zeigte sich, dass die Biopsie mit einem Karzinomanteil von 97% fast ausschliesslich aus Tumor bestand. Die übrigen 3% waren überwiegend Fibroblasten. Die Karzinomzellen waren überwiegend vom luminal-papillären Subtyp. Wenn man das gesamte Transkriptom betrachtet, konnten 17 verschiedene Zellsubpopulationen identifiziert werden. Eine Pathway-Analyse zeigte, dass in etwa der Hälfte der Tumorzellen der FGFR3-Pathway erhöht war. Somit wird deutlich, dass Heterogenität nicht nur zwischen verschiedenen Metastasen, sondern auch innerhalb des Primarius vorliegt. Die intratumorale Heterogenität stellt somit eine weitere Hürde für eine erfolgreiche Therapie dar.
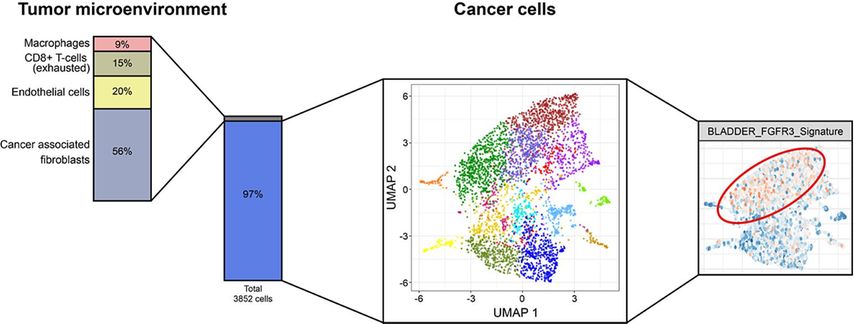
Abb. 3: Einzelzell-RNA-Sequenzierung aus einer Tumorbiopsie eines FGFR3-mutierten Blasenkarzinoms zur Illustration der intratumoralen Heterogenität
Nectin-4-gezielte Therapie
Nectin-4 ist ein Oberflächenprotein, welches auf Karzinomzellen verschiedener Entitäten exprimiert wird. Es liegt auf dem Genom in einer häufig amplifizierten Region, sodass eine Positivität bei bis zu 97% der Tumorentitäten gefunden wurde und ein Prescreening vor Therapie nicht mehr notwendig ist.11 Für eine zielgerichtete Karzinomtherapie wird ein Nectin-4-Antikörper mit konjugiertem Toxin (Enfortumab Vedotin) genutzt, welcher den Wirkstoff direkt an und in den Tumor bringen soll.12
Eine Analyse aus der TCGA-Datenbank (Abb. 4) zeigt für das Urothelkarzinom jedoch eine heterogene Expression von Nectin-4 je nach Subtyp.13
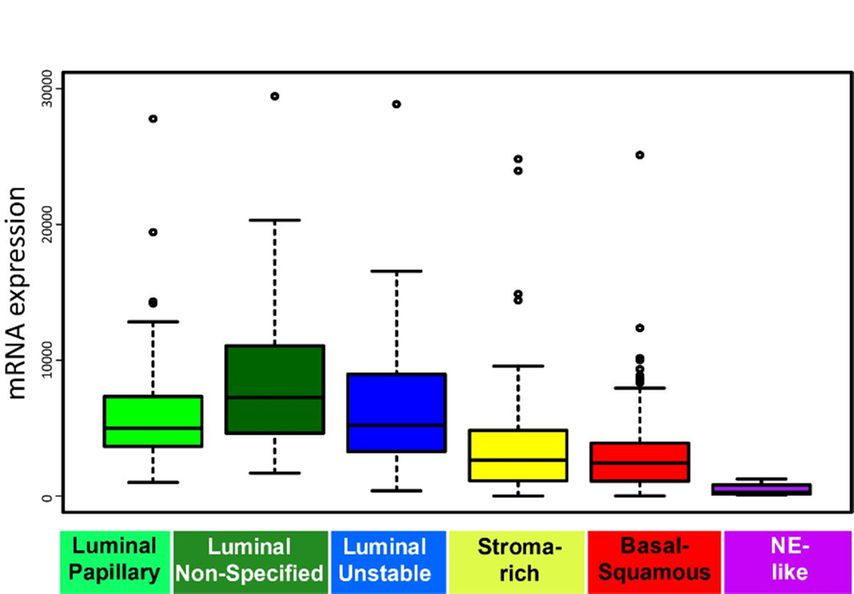
Abb. 4:Subtyp-spezifische Nectin-4-Expression
Unsere Analyse der TCGA-Datenbank deckt sich mit dem Resultat der Studie von Hoffmann-Censits et al., welche mittels Immunhistochemie eine negative Expression bei 100% der kleinzelligen und sarkomatoiden Urothelkarzinome gezeigt hat.14 In der Kategorie der urothelialen Urothelkarzinome zeigte sich die Expression bei 5,9% stark, bei 17,6% moderat, bei 58,8% schwach und bei 17,6% negativ.
Rosenberg et al. untersuchten die Wirksamkeit von Enfortumab Vedotin bei Urothelkarzinompatienten nach Platinum-basierter und PD-1/PD-L1-Therapie in der Drittlinientherapie.12 Dabei fanden sie eine bestätigte Ansprechrate bei 44% und ein komplettes Ansprechen bei 12% der Patienten. Leider gibt es bisher noch keine Daten zu molekularen Klassen in Abhängigkeit von den Ansprechraten. Zu erwarten wäre, dass die luminalen Subtypen höhere Ansprechraten haben.
Literatur:
1 Wu XR: Urothelial tumorigenesis: a tale of divergent pathways. Nat Rev Cancer 2005; 5(9): 713-25 2 Jalanko T et al.: Genomic subtyping in bladder cancer. Curr Urol Rep 2020; 21(2): 9 3 McConkey DJ et al.: SIU-ICUD consultation on bladder cancer: basic science. World J Urol 2019; 37(1): 15-29 4 Kamoun A et al.: A consensus molecular classification of muscle-invasive bladder cancer. Eur Urol 2020; 77(4): 420-33 5 Minoli M et al.: Evolution of urothelial bladder cancer in the context of molecular classifications. Int J Mol Sci 2020;21 (16): E5670 6 Seiler R et al.: Impact of molecular subtypes in muscle-invasive bladder cancer on predicting response and survival after neoadjuvant chemotherapy. Eur Urol 2017; 72(4): 544-54 7 Pichler R et al.: Increased accuracy of a novel mRNA-based urine test for bladder cancer surveillance. BJU Int 2018; 121(1): 29-37 8 Kamat AM et al.: Considerations on the use of urine markers in the management of patients with high-grade non-muscle-invasive bladder cancer. Urol Oncol2014; 32(7): 1069-77 9 Loriot Y et al.: Erdafitinib in locally advanced or metastatic urothelial carcinoma. N Engl J Med 2019; 381(4): 338-48 10 Faltas BM et al.: Clonal evolution of chemotherapy-resistant urothelial carcinoma.Nat Genet2016; 48(12): 1490-9 11 Targeting nectin-4 in bladder cancer. Cancer Discov 2017; 7(8): OF3 12 Rosenberg JE et al.: Pivotal trial of enfortumab vedotin in urothelial carcinoma after platinum and anti-programmed death 1/programmed death ligand 1 therapy. J Clin Oncol 2019; 37(29): 2592-600 13 Robertson AG et al.: Comprehensive molecular characterization of muscle-invasive bladder cancer. Cell 2017; 171(3): 540-56.e525 14 Hoffman-Censits JH et al.: Expression of nectin-4 in bladder cancer with variant histology. JClin Oncol2020; 38(6suppl): 546
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


