Genom, Therapie, Resektabilität
Autoren:
Dr. Mohamed Salem
Prim. Prof. Dr. Thomas Grünberger
Klinik Favoriten – Abteilung für Chirurgie
Referenzzentrum HPB-Tumore, 1100 Wien
Wiener Gesundheitsverbund
Korrespondenz:
Alle zwei Jahre öffnet der Kongress der European-African Hepato-Pancreato-Biliary Association (E-AHPBA) seine Tore – diesmal in Dublin, wo führende Expert:innen der Leber-, Pankreas- und Gallenwegschirurgie sich über neueste Erkenntnisse und innovative Techniken austauschen.
Anhand von vier Abstracts möchten wir unsere Eindrücke und Highlights beleuchten, um exemplarisch Neuerungen in der hepato-pankreato-biliären Chirurgie (HPB-Chirurgie) greifbar zu machen. Wir beginnen mit der Debatte um neoadjuvante Therapien beim resektablen Pankreaskopfkarzinom, gefolgt von präoperativen Überlegungen zu kolorektalen Lebermetastasen. Anschließend thematisieren wir das Management „verschwindender“ kolorektaler Lebermetastasen und abschließend analysieren wir den Einfluss der Resektionsränder auf das Überleben bei Cholangiokarzinomen.
Management des resektablen Pankreaskarzinoms
In seinem Vortrag zum Management des resektablen Pankreaskarzinomsbeantwortet Prof. Dr. K. J. Labori, Oslo University Hospital, Norwegen, die polarisierende und eifrig diskutierte Frage, ob die Option einer neoadjuvanten Systemtherapie mit FOLFIRINOX zu besseren Behandlungsergebnissen führen könnte.1Hierfür bezieht er sich auf die NORPACT-1-Studie,eine multizentrische, randomisierte Phase-II-Studie, die die Wirksamkeit und Sicherheit einer neoadjuvanten FOLFIRINOX-Therapie im Vergleich zur Standardbehandlung (primäre Resektion, gefolgt von adjuvanter FOLFIRINOX-Therapie) bei Patient:innen mit primär resektablem Pankreaskopfkarzinom (PDAC) untersucht.2 Neoadjuvante Ansätze könnten eine frühere systemische Kontrolle und günstigere histopathologische Parameter versprechen (R0-Resektionsraten, N0-Status).
In zwölf nordischen Zentren wurden 140 Patient:innen rekrutiert (1:1-Randomisierung) und der primäre Endpunkt als das Gesamtüberleben (OS) nach 18 Monaten festgesetzt. Die neoadjuvante Gruppe erhielt vier Zyklen FOLFIRINOX, gefolgt von Operation und acht weiteren adjuvanten Zyklen, die Kontrollgruppe hingegen wie gewohnt die primäre Resektion mit zwölf adjuvanten Zyklen.
Die Ergebnisse zeigten keinen signifikanten Überlebensbenefit durch neoadjuvante Therapie (OS-Rate bei 18 Monaten: 54% vs. 60%; Abb.1). Die Implementierung der neoadjuvanten Therapie war herausfordernd, mit niedrigerer Resektionsrate (82% vs. 89%) und höherer Toxizität. Dennoch verbesserten sich histopathologische Outcome-Parameter (R0-Rate: 56% vs. 39%; N0-Status: 39% vs. 21%). Langzeitdaten werden 2026 erwartet.
Abb. 1: Neoadjuvante Therapie vs. primäre Resektion (modifiziert nach Labori KJ et al.)2
Take-Home-Message
Beim primär resektablen Pankreaskarzinom bietet die neoadjuvante FOLFIRINOX-Therapie keinen Überlebensvorteil, trotz histopathologischer Vorteile. Der Standard bleibt die Upfront-Resektion mit adjuvanter Chemotherapie.
Die Studie unterstreicht die Komplexität der Therapiesequenzierung bei resektablem PDAC und plädiert für Biomarker-gesteuerte Ansätze, um die Patient:innenselektion zu optimieren und Toxizitäten zu vermeiden.
Präoperative kolorektale Lebermetastasen: Genom & Therapie
Kolorektale Lebermetastasen (CRLM) stellen die führende Indikation für Leberresektionen dar und erfordern eine graduelle, multidisziplinäre Strategie unter Einbeziehung genomischer und klinischer Faktoren. Das molekulare Profil variiert je nach Primärtumor, wie Prof. Dr. A. Gulla, Vilnius University Hospital, Litauen, in ihrem Vortrag hervorragend aufzeigen konnte: Linksseitige Kolonkarzinome zeigen häufiger chromosomale Instabilitäten und TP53- sowie SMAD4-Mutationen, mit geringerer Wahrscheinlichkeit für BRAF-Mutationen, was insgesamt die Prognose verbessert.3
Bei rechtsseitigen metastasierten Tumoren hingegen zeigt sich eine schlechtere Prognose – hier häufen sich Mikrosatelliteninstabilitäten, schlecht differenziertes Gewebe (G3) sowie KRAS-, BRAF- und PIK3CA-Mutationen. Rektumkarzinome haben eine höhere Rate an HER2-Amplifikationen und eine insgesamt günstigere Prognose im Vergleich zu Kolonkarzinomen.
Das zentrale Behandlungsziel ist eine parenchymsparende R0-Resektion, um den „future liver remnant“ (FLR) groß zu halten und möglichst ein Post-Hepatectomy-Leberversagen (PHLF) zu vermeiden. Patient:innen mit oligometastatischer Erkrankung profitieren von lokalen Therapien wie Thermoablation (RFA oder MWA), besonders bei Läsionen <5cm. Bei primär nichtresektablen Metastasen (ca. 20% der Patient:innen) dient die systemische Chemotherapie der Konversion, um eine Resektabilität zu erzielen. Regelmäßige radiologische Kontrollen alle zwei Monate zur Beurteilung anhand der RECIST-Kriterien und Wiedervorstellung im Tumorboard für die Reevaluation einer Resektion sind essenziell.
Cave: Bei Langzeitchemotherapie muss auf die Lebertoxizität und die konsekutive Notwendigkeit größerer FLR geachtet werden!
Immer wichtiger in der Behandlungsstrategie werden genomische Marker:
-
RAS-Mutationen korrelieren mit höheren Rezidivraten und erfordern wohl breitere Resektionsränder (>10mm).
-
BRAF-Mutationen kommen relativ selten vor, implizieren jedoch eine schlechtere Prognose, allerdings ohne eine absolute Kontraindikation für Resektionen darzustellen.
Für grenzwertig resektable Fälle bieten Techniken wie die Two-Stage-Hepatektomie, Doppelvenenembolisation oder gar Lebertransplantation kurative Optionen an. Letztere ist Thema laufender Studien, wenn auch strikte Indikationsstellungen und genaue Patient:innenselektion vor einer Transplantation von extremer Wichtigkeit sind (vgl. TRANSMET-Studie).4
Postoperativ bleibt die Chemotherapie kontrovers: NCCN-Leitlinien empfehlen sechs Monate Oxaliplatin-basierte Regime (z.B. FOLFOX) bei Hochrisiko, während andere Therapeutika (Irinotecan, Cetuximab, Bevacizumab) keinen Benefit zeigen.
Take-Home-Message
Eine R0-Resektion ist zu priorisieren, Oligometastasen sollten im interdisziplinären Tumorboard hinsichtlich kurativer Therapie (Resektion vs. Thermoablation oder Kombination) diskutiert werden, während nichtresektable Metastasen von konvertierender Chemotherapie profitieren. Die adjuvante Therapie ist weiterhin umstritten und sollte genomisch (RAS/BRAF) individualisiert werden, um die Prognose zu optimieren.
Die Lebertransplantation bleibt eine sich entwickelnde, nichtstandardisierte Behandlungsoption – hier versprechen wir uns mehr Evidenz von laufenden Studien (SECA III, COLT).
Single-Center-Trial: verschwundene kolorektale Lebermetastasen
In einer retrospektiven Analyse am Humanitas Research Hospital beschreibt Dr. G. Costa, Italien, das Management von „disappearing colorectal liver metastases“ (dCRLM) anhand von 152 Patient:innenfällen.5 Nach neoadjuvanter Chemotherapie (inklusive EGFR- oder VEGF-Inhibitoren) zeigten sich in einigen Fällen magnetresonanz- und computertomografisch nicht mehr detektierbare Metastasen.
Ziele der Studie waren die Evaluation chirurgischer Outcomes und die langfristige Prognose. Von den eingeschlossenen Patient:innen zeigten 33 dCRLM, wobei 93% zuvor Biologika erhalten hatten. Im Vergleich zu Patient:innen ohne dCRLM ergaben sich keine signifikanten Unterschiede bei perioperativen Komplikationen oder Resektionsraten. Die 5-Jahres-Gesamtüberlebensrate betrug 27% für resezierte dCRLM, vergleichbar mit Fällen ohne Verschwinden der Metastasen (Abb.2).
Abb. 2: 5-Jahres-Überleben bei „disappearing colorectal liver metastases“ (dCRLM) vs. kolorektale Lebermetastasen (CRLM) (modifiziert nach Costa G et al.)5
Diese Studie unterstreicht die klinische Relevanz von dCRLM, da residuelle vitale Tumoren trotz radiologischer Remission rezidivieren können.6,7 Die strikte parenchymsparende Resektion ermöglicht sichere Resektionen und gute Outcomes.
Take-Home-Message
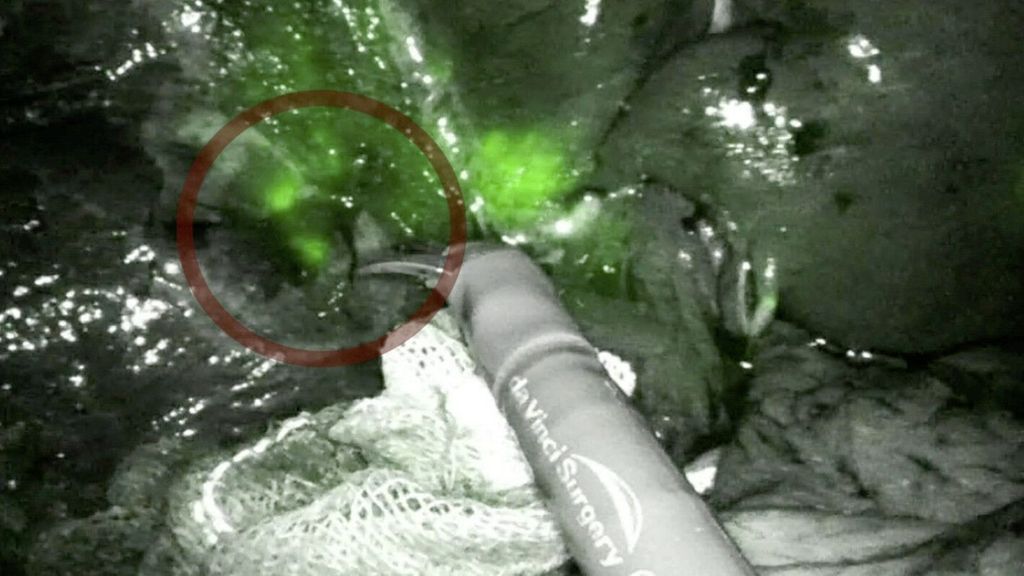
Bei dCRLM sollte eine parenchymsparende Leberresektion priorisiert werden, um Rezidive zu minimieren, ohne einen prognostischen Nachteil zu bewirken. Es wird postuliert, dass sich durch Biologika dCRLM häufen. Dies kann intraoperativ zu Schwierigkeiten in der Identifikation der dCRLM führen – hier kann evtl. eine präoperative i.v. Gabe von Indocyaningrün Abhilfe verschaffen (Abb.3).
Abb. 3: Intraoperativ aufleuchtende Lebermetastasen nach ICG-Applikation, die ohne ICG nicht sichtbar waren
Minimaler Resektionsrand und das Überleben beim Cholangiokarzinom
Seit Jahrzehnten besteht eine anhaltende Debatte darüber, wie umfangreich reseziert werden muss, um bei cholangiozellulären Karzinomen eine sichere R0-Resektion und ein langes rezidivfreies Überleben zu erreichen. Die vollständige Tumorresektion (pR0) gilt als einzige potenziell kurative Therapie für Cholangiokarzinome, doch ist der Einfluss der Breite des Resektionsrandes auf das onkologische Outcome unklar. Eine retrospektive Studie aus dem Universitätsklinikum Münster evaluiert dies bei 92 Patient:innen mit kurativer Resektion.8
Die Fälle wurden von Dr. V. Kogut in drei Gruppen unterteilt: R1 (positiver Rand), R0-narrow (<1mm) und R0-wide (>1mm). Das mediane Gesamtüberleben (OS) war in der R0-wide-Gruppe signifikant länger (70 Monate) als in der R0-narrow-Gruppe (41 Monate; p=0,039). Überraschenderweise bestand zwischen R0-narrow und R1 (23 Monate) kein signifikanter Unterschied (p=0,310). Für das krankheitsfreie Überleben (DFS) zeigte sich allerdings kein signifikanter Vorteil zwischen R0-wide und R0-narrow (29 vs. 16 Monate; p=0,657). Hier widerspricht das Ergebnis (vermutlich aufgrund der geringen Fallzahl) großen retrospektiven Studien und auch den aktuellen Leitlinien der American Association for the Study of Liver Diseases, die zeigen, dass Patient:innen nach R0-Resektion ein deutlich längeres DFS und OS aufweisen als nach R1-Resektion, mit 5-Jahres-Überlebensraten von 20–56% bei R0- vs. 0–7% bei R1-Resektionen.9–11
Take-Home-Message
Bei Cholangiokarzinomen verlängert ein breiter Resektionsrand (>1mm) das Gesamtüberleben signifikant im Vergleich zu Resektionsrändern <1mm. Die Studie plädiert für ein aggressiveres chirurgisches Vorgehen, um breitere Ränder zu erreichen. Insbesondere bei Klatskin-Tumoren, bei denen anatomische Gegebenheiten die Resektion technisch erschweren, stellt dies eine große Herausforderung dar.
Conclusion
Für uns onkologische Chirurg:innen war der E-AHPBA-Kongress einmal mehr mit diversen technischen Erkenntnissen gespickt, die uns eine Reihe von möglichen Adaptationen unseres aktuellen Vorgehens nähergebracht haben. Wichtig in unserem multidisziplinären Vorgehen bei allen HPB-Tumoren waren jedoch die Diskussionen über die besten Zugangsmethoden, Therapieabfolgen, die Länge von perioperativen Therapien und die Bedeutung der „second opinion“. Somit sind wir für unsere wöchentlichen Tumorboards angehalten, die Meinung derer einzuholen, die die größte Erfahrung in der Behandlung des jeweiligen Tumors haben, um das Maximum für jede:n einzelne:n Patient:in zu ermöglichen.
Literatur:
1 Labori KJ: Vortrag E-AHPBA 2025 2 Neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer (NORPACT-1): a multicentre, randomized, phase 2 trial. Lancet Gastroenterol Hepatol 2024; 9(3): 205-17 3 Gulla A: Vortrag E-AHPBA 2025 4 Adam R et al.: Liver transplantation plus chemotherapy versus chemotherapy alone in patients with permanently unresectable colorectal liver metastases (TransMet). Lancet 2024; 404(10458): 1107-18 5 Costa G et al.: Resecting disappeared colorectal liver metastases: results from a single center (noch nicht publiziert) 6 Adams RB et al.: Selection for hepatic resection of colorectal liver metastases: expert consensus statement. HPB Oxford 2013; 15(2): 91-103 7 Ansari D et al.: The challenge of disappearing colorectal liver metastasis: balancing considerations between tumor biology and clinical consequence for liver surgery. Clin & Exp Met 2025; 42(4): 39 8 Kogut V et al.: Impact of the minimal resection margin on survival of cholangiocarcinoma patients (noch nicht publiziert) 9 Bowlus CL et al.: AASLD practice guidance on primary sclerosing cholangitis and cholangiocarcinoma. Hepatology 2023; 77(2): 659-702 10 Sarkhampee P et al.: Resectability and survival outcome in real world practice of 720 cholangiocarcinoma patients. World J Surg Oncol 2024; 22(1): 314 11 Farges O et al.: Influence of surgical margins on outcome in patients with intrahepatic cholangiocarcinoma. Ann Surg 2011; 259(2): e37-8
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...



