EXALT-2: Hämatoonkologische Präzisionsmedizin mit Tumorboard
Autor*innen:
Dr. Johanna Schreiber
Univ.-Prof. Dr. Dominik Wolf
Ao. Univ.-Prof. Dr. Peter Neumeister
Assoc. Prof. Priv.-Doz. Philipp Staber, MD PhD
E-Mail: philipp.staber@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der österreichischen EXALT-2-Studie wird für Proband*innen mit aggressiven hämatologischen Erkrankungen über die Methoden der „Single-cell functional precision medicine“ und des „Comprehensive genomic profiling“ eine individuelle Therapie konzipiert, die das progressionsfreie Überleben verlängern soll. Eine Studienteilnahme erfolgt nach zwei Vortherapien oder mit nach Erstlinientherapie fehlender evidenzbasierter Weiterbehandlung. Zwei Fallbeispiele illustrieren die Ergebnisse der Studie.
Das übergeordnete Ziel der Präzisionsmedizin ist es, für betroffene Patient*innen das richtige Medikament zum richtigen Zeitpunkt zu finden. Hämatoonkologische Therapien, die auf dem Konzept der Präzisionsmedizin beruhen, reichen von zielgerichteten niedermolekularen Inhibitoren und Biologika über Immuncheckpoint-Inhibitoren bis hin zu CAR(„Chimeric antigen receptor“)-T-Zell-Therapie und bispezifischen Antikörpern.1
Diese Therapien verbessern die Prognose und werden demnach immer häufiger bei unterschiedlichen hämatoonkologischen Erkrankungen eingesetzt. Ein Paradebeispiel ist die chronische myeloische Leukämie, bei der vor dem Einsatz zielgerichteter Therapien Patient*innen in der chronischen Phase ein medianes Überleben von unter neun Jahren aufwiesen. Durch niedermolekulare Inhibitoren, wie Imatinib, gleicht heutzutage die Lebenserwartung jener nicht erkrankter Menschen.2
Herausforderungen der Präzisionsmedizin
Einer Krebserkrankung liegt ein komplexer evolutionärer Prozess zugrunde. Genetische und funktionelle Veränderungen führen durch Selektionsvorteile zu Tumorprogression und Therapieresistenz.3 Um wirksame therapeutische Konzepte zu Arzneimitteln beziehungsweise deren Kombinationen zu entwickeln, die der Dynamik und Heterogenität der Tumorbiologie gerecht werden, spielt die Gewinnung von Tumorzellen in Form von Echtzeitbiopsien, im Englischen „real-time biopsies“, eine zentrale Rolle.
In den letzten 30 Jahren wurde eine Vielzahl von Methoden der Präzisionsmedizin entwickelt, welche suzkessive ihren Eingang in den klinischen Alltag finden. Möglichst breite Proteom-, RNA- und molekulargenetische Analysen – wie etwa durch „next-generation sequencing“ (NGS) – können dabei das individuelle Therapieansprechen indirekt vorhersagen. Demgegenüber messen funktionelle Tests in Form von Hochdurchsatz-Screening-Verfahren ex vivo das direkte Ansprechen der Tumorzellen auf eine Vielzahl von antineoplastischen Medikamenten. Dies ist angesichts einer wachsenden Zahl an Therapeutika von Relevanz.4
Die niedrige Inzidenz mancher hämatologischer Erkrankungen, wie etwa des peripheren T-Zell-Lymphoms (PTCL), erschwert oft eine ausreichende Rekrutierung von Proband*innen, um aussagekräftige Studien durchzuführen und Behandlungsleitlinien zu erstellen. Ebenso kann die Therapiewahl bei stark vorbehandelten Patient*innen erschwert sein. Sind evidenzbasierte Behandlungsoptionen erschöpft, muss man bei der Therapiewahl daher auf mitunter begrenzte Erfahrungen zurückgreifen. Gerade hier können die Methoden der Präzisionsmedizin sowie eine enge Zusammenarbeit von Expert*innen mit langjähriger Erfahrung einen wichtigen Beitrag leisten.
Von EXALT zu EXALT-2
In der kürzlich publizierten und international sehr beachteten Pionierstudie EXALT (EXtended Analysis for Leukemia/Lymphoma Treatment) wurde die Effektivität von „ex-vivo functional drug screening“ (FDS) bei relapsierten hämatologischen Neoplasien untersucht. Die dabei verwendete Methode ist unter dem Namen „single-cell functional precision medicine“ (scFPM) oder auch „next-generation functional drug screening“ (ngFDS)bekannt. In der EXALT-Studie konnte ein klar messbarer klinischer Vorteil durch den Einsatz funktioneller Präzisionsmedizin gezeigt werden.5
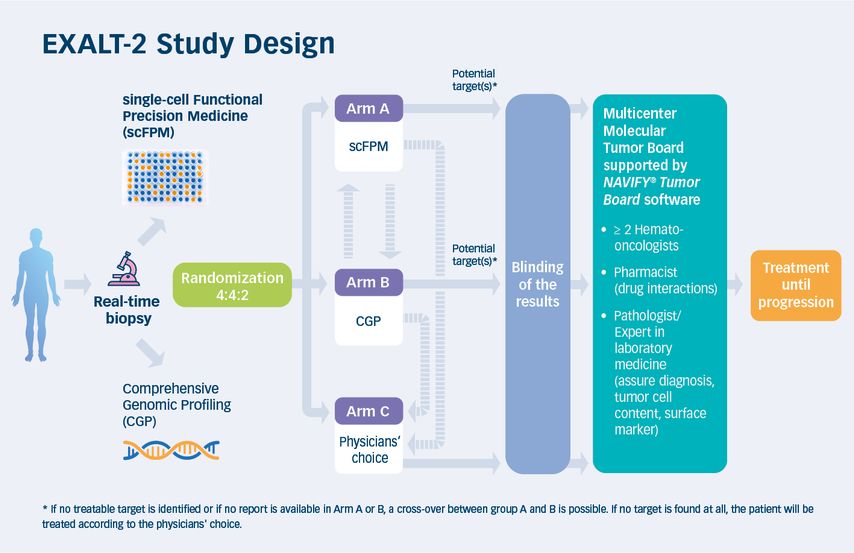
Die Ergebnisse dieser Studie bildeten die Grundlage für die Initiierung der EXALT-2-Studie, einer multizentrischen, prospektiven, randomisierten, dreiarmigen Studie. In dieser werden das „ex-vivo drug screening“, scFPM und „comprehensive genomic profiling“ (CGP) basierend auf NGS mit dem Standardarm „physicians’ choice“ verglichen (nähere Informationen zu den Methoden scFPM und CGP siehe Tab. 1). Die EXALT-2-Studie ist weltweit die erste Studie, die dieses Studiendesign verwendet. Eine schematische Darstellung des Studiendesigns zeigt Abbildung 1.
Tab. 1: „Single-cell functional precision medicine“(scFPM) und „comprehensive genomic profiling“ (CGP)
Das Studiendesign
Einschlussberechtigt sind erwachsene Patient*innen, die an einer aggressiven hämatologischen Erkrankung leiden, mindestens zwei Vortherapien hatten oder für die nach einer Erstlinientherapie keine weitere evidenzbasierte Behandlung existiert. Primäres Studienziel ist es, festzustellen, ob das progressionsfreie Überleben (PFS) von Patient*innen mit aggressiven hämatologischen Erkrankungen durch den Einsatz von scFPM oder CGP im Vergleich zu „physicians’ choice“ verlängert werden kann. Zunächst wird im Rahmen der klinischen Routine frisches Tumormaterial gewonnen – bei Lymphomerkrankungen meist durch eine Lymphknotenbiopsie, bei Leukämien durch Blut- oder Knochenmarkspunktion. In seltenen Fällen kann auch eine Punktion eines malignen Ergusses für die weiteren Analysen vorgenommen werden. Ein Teil des Gewebes wird anschließend für Routineaufarbeitungen durch Pathologie und/oder Labormedizin verwendet (Immunhistochemie, Bestimmung des Tumoranteils, „fluorescence-activated cell sorting“ etc.).
Dies ermöglicht die Bestimmung der tumorspezifischen Oberflächenmerkmale und in weiterer Folge die Auswahl der Immunfluoreszenz-gekoppelten Antikörper für das scFPM und stellt somit die Grundlage für die Interpretation der scFPM-Ergebnisse dar. Nach makroskopischer Begutachtung durch die Pathologie wird fixiertes Material an Foundation Medicine zur Durchführung des CGP versendet sowie unfixiertes (viables) Material zur Durchführung des scFPM bereitgestellt. Im Falle einer Knochenmarksaspiration oder einer peripheren Blutabnahme wird das Material direkt zur weiteren Analyse an Foundation Medicine verschickt.
Die molekularen Untersuchungen für das scFPM erfolgen zum Teil im Forschungslabor von Prof. Staber, zum Teil über die Biotechnologiefirma Exscientia. Bei allen Patient*innen wird, sofern die Gewebemenge und -qualität es zulassen, eine Untersuchung mit scFPM und CGP durchgeführt. Die Patient*innen werden nach erfolgter Biopsie in eine der drei Studienarme in einem Verhältnis von 4:4:2 randomisiert (seit 21.10.2021; davor 1:1:1). Die Ergebnisse aus den scFPM und CGP werden verblindet und an ein multizentrisches Tumorboard(=EXALT-2 molekulares Tumorboard) übermittelt. In Arm A und Arm B wird ein Therapievorschlag auf Basis der scFPM- beziehungs- weise der CGP-Ergebnisse erstellt. In Arm C wird nach „physicians’ choice“ behandelt.
Sollte bei Patient*innen in Arm A oder B kein therapierbares Target gefunden werden oder keine Analyse möglich sein, ist ein Wechsel in den anderen experimentellen Arm möglich. Falls weder mit scFPM noch mit CGP ein behandelbares Target identifiziert werden kann oder mit beiden Methoden keine Analyse möglich ist, wird eine Behandlungsempfehlung nach „physicians’ choice“ ausgesprochen.
Wie auch in anderen Studien der Präzisionsmedizin dienen Patient*innen als ihre eigene interne Kontrolle, um den klinischen Vorteil beziehungsweise den primären Endpunkt zu bestimmen.6–8 Der Therapieerfolg wird durch einen Vergleich des PFS unter der EXALT-2-Therapie (Arm A/B/C) mit der zuletzt verabreichten anti-neoplastischen Therapie bestimmt. Eine Verlängerung des PFS um ≥1,3 in Relation zum PFS unter der Vortherapie wird dabei als klinischer Vorteil bewertet. Primärer Studienendpunkt ist der Prozentsatz der Patient*innen, die ein PFS(EXALT-2 A/B/C)/PFS (letzte antineoplastische Therapie) ≥1,3 erreichen.
In der nicht randomisierten EXALT-1-Studie wurden insgesamt 76 Patient*innen ausgewertet, wovon 56 nach scFPM-Empfehlungen und 20 nach „physicians’ choice“ behandelt wurden. Bei der medianen Verlaufskontrolle nach 23,9 Monaten zeigte sich bei 54% der Patient*innen (30/56) ein klinischer Nutzen einer mehr als 1,3-fach verlängerten PFS im Vergleich zur Vortherapie. Interessanterweise zeigten 40% der Responder (12/30) ein außergewöhnliches Ansprechen (definiert als PFS mindestens dreimal länger als für die Erkrankung erwartet).5
Gebündelte Erfahrung im Tumorboard
Der erfolgreiche Einsatz des FDS in der EXALT-1-Studie beruht unter anderem auf der engen Zusammenarbeit zwischen Grundlagenforschung und klinischen sowie diagnostischen Fachgebieten. Nicht zu unterschätzen sind dabei die Komplexität und Menge der Daten, die die Methoden der Präzisionsmedizin liefern. Statt einzelner Ergebnisse, wie etwa bei einer immunhistochemischen Untersuchung, liefert jede Analyse mehrere Billionen Datenpunkte. Dies eröffnet neue Möglichkeiten, birgt jedoch auch neue Herausforderungen. Es bedarf der Zusammenarbeit unterschiedlichster Disziplinen, um die Fülle an erhobenen Daten zu interpretieren und in eine für die Patient*innen optimale Therapie zu übersetzen. Diese Vorschläge müssen von Ärzt*innen und Wissenschaftler*innen mit Erfahrung in Präzisionsmedizin bewertet werden. Mögliche Medikamenteninteraktionen müssen beachtet und die Verträglichkeit abgewogen werden. Eine enge Zusammenarbeit der Klinik mit Pharmakologie, Pathologie, Molekularbiologie und Labormedizin ist erforderlich.
Die EXALT-2-Studie stellt sich nun der Herausforderung, das Konzept eines multizentrischen molekularen Tumorboards in der Praxis umzusetzen. Zum Erstellen einer Therapieempfehlung bilden Expert*innen aus allen teilnehmenden Studienzentren ein gemeinsames Tumorboard. Dessen Aufbau ist in Abbildung 2 zu sehen. Neben der Medizinischen Universität Wien sind auch Zentren an den Universitätskliniken in Graz, Innsbruck, Salzburg und Linz an der Studie beteiligt. Die Implementierung eines solchen Tumorboards erfordert die Integration passender Informatikwerkzeuge und die Optimierung klinischer Arbeitsabläufe, um die gesammelten Befunde und Analyseergebnisse rasch zu erfassen und zu interpretieren. In der EXALT-2-Studie werden alle entscheidungsrelevanten Befunde sowie Resultate aus bildgebenden Verfahren mit der NAVIFY-Tumorboard-Software dargestellt. Sie werden den Tumorboard-Teilnehmer*innen bereits im Vorfeld zur Verfügung gestellt.
Durch die Softwareunterstützung kann das Tumorboard als Hybridveranstaltung abgehalten werden. Sowohl eine Teilnahme vor Ort als auch eine virtuelle Teilnahme ist möglich. Dies hat sich besonders in der derzeitigen Covid-19-Pandemie sehr bewährt. Während des Tumorboards kann die Therapieempfehlung direkt im System dokumentiert werden. Die Entscheidung betreffend die Umsetzung der Therapieempfehlung obliegt den behandelnden Ärzt*innen.
Fallbeispiele aus der EXALT-2-Studie
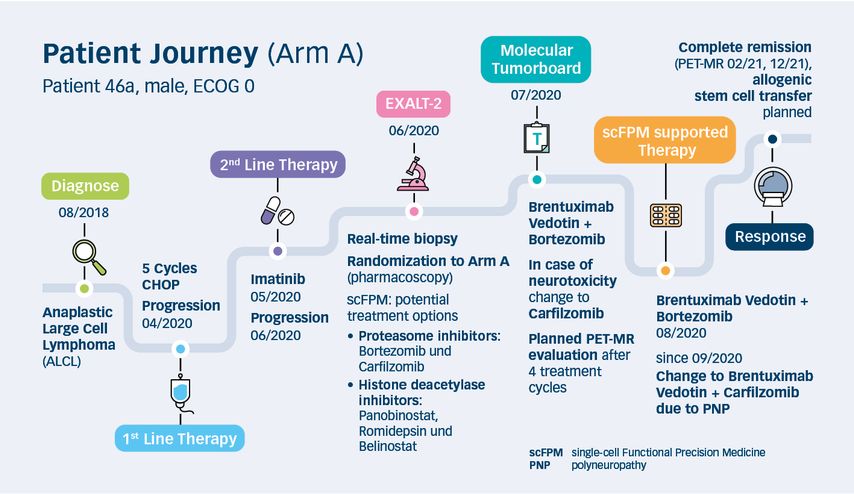
Die folgenden zwei Fallbeispiele illustrieren eine typische „patient journey“. Fall eins wurde in Arm A nach den scFPM-Ergebnissen behandelt und ist grafisch in Abbildung 3 dargestellt. Der zweite Patientenfall stammt aus Arm B und beschreibt eine Behandlung nach den CGP-Ergebnissen.
Fall 1 (Arm A): scFPM
Bei einem bisher gesunden 46-jährigen Patienten wird im August 2018 ein ALK(anaplastische Lymphomkinase)-negatives anaplastisches großzelliges Lymphom (ALCL) diagnostiziert. Gemäß den damaligen österreichischen Leitlinien erhält der Patient als Erstlinientherapie eine Chemotherapie mit Cyclophosphamid, Doxorubicin, Vincristin und Prednisolon (CHOP).9,10
Im April 2020 bestätigt eine Lymphknotenbiopsie eines subkutanen Knotens ein Rezidiv der Erkrankung. Dem Patienten wird eine Standard-Salvage-Therapie gefolgt von autologer Stammzell-Transplantation angeboten. Diese lehnt der Patient jedoch aus privaten Gründen ab. Aufgrund von PDGF(„Platelet-derived growth factor“)-R-Positivität wird ein individueller Heilversuch mit Imatinib als Monotherapie gestartet.11 Darunter zeigt sich die Erkrankung bereits nach einem Monat deutlich progredient. In einer Positronenemissionstomografie/Magnetresonanztomografie (PET/MR)finden sich eine Zunahme der Lymphadenopathie sowie neu aufgetretene Fluordesoxyglucose(FDG)-avide Lymphknoten. Der Patient wird daraufhin in die EXALT-2-Studie eingeschlossen. Zum Zeitpunkt der Aufnahme in die Studie ist der Patient in einem guten Allgemeinzustand (Eastern Cooperative Oncology Group [ECOG]-Status) 0). Die Real-Time-Biopsie mit Lymphknotenexstirpation kann komplikationslos durchgeführt werden. Das Gewebe wird anschließend routinemäßig von der Hämatopathologie aufgearbeitet sowie ein fixierter Anteil an Foundation Medicine und ein unfixierter Anteil an Exscientia zur Durchführung des CGP beziehungsweise der scFPM versendet. Der Patient wird in Arm A (scFPM) randomisiert und die Ergebnisse von CGP werden verblindet.
Im Rahmen des multizentrischen molekularen Tumorboards werden die Ergebnisse des Drug-Screenings sowie die immunhistochemischen Befunde des Patienten gemeinsam mit Patholog*innen, Labormediziner*innen, Molekularbiolog*innen, klinischen Pharmakolog*innen und Hämatolog*innen intensiv diskutiert. Immunhistochemisch zeigen die Tumorzellen eine starke spezifische Expression von CD30. Im Ex-vivo-Drug-Screening weisen insbesondere die Proteasom-Inhibitoren Bortezomib und Carfilzomib sowie die Histondeacetylase-Inhibitoren Panobinostat, Romidepsin und Belinostat antineoplastische Wirkung auf. Es wird eine Therapie mit Brentuximab-Vedotin, einem CD30-gerichteten monoklonalen Antikörper, in Kombination mit Bortezomib subkutan empfohlen. Im Falle einer Neurotoxizität wird ein Wechsel auf Carfilzomib vorgeschlagen. Im August 2020 wird die Therapie mit der neuartigen Kombination von Brentuximab-Vedotin und Bortezomib eingeleitet. Da der Patient nach wenigen Wochen unter Bortezomib eine Grad-2-Polyneuropathie in den Händen entwickelt, wird die Therapie entsprechend der Empfehlung des Tumorboards auf Carfilzomib umgestellt. Zwei Monate später zeigt sich eine komplette metabolische Remission, die im Dezember 2021 immer noch nachweisbar ist. Der Patient stimmt nun einer allogenen Stammzelltransplantation als konsolidierender Therapie zu, sodass eine entsprechende Spendersuche gestartet wird.
Fall 2 (Arm B): CGP
Anfang 2021 wird ein zuvor gesunder 60-jähriger männlicher Patient aufgrund eines Ikterus sowie leicht blutiger Stühle erstmals vorstellig. Im Rahmen einer endoskopisch retrograden Cholangiopankreatikografie (ERCP) zeigt sich histologisch eine Infiltration eines Burkitt-Lymphoms im Bereich des Duodenums mit konsekutiven intra- und extrahepatischen Cholangiektasien. In der extern durchgeführten FISH(Fluoreszenz-in-situ-Hybridisierung)-Analyse findet sich ein MYC-Rearrangement. Es erfolgt rasch die Einleitung einer antineoplastischen Therapie nach dem GMALL(German Multicenter Study Group for Adult Acute Lymphoblastic Leukemia)-Protokoll.12
Nach der zweiten Konsolidierung entwickelt der Patient jedoch erneut blutige Stühle, weshalb der Verdacht eines Progresses besteht. Daraufhin wird Kontakt mit dem hämatologischen Studienteam bezüglich eines Einschlusses des Patienten in die EXALT-2-Studie aufgenommen. Nach Prüfung der Ein- und Ausschlusskriterien wird der Patient noch am selben Tag in die Studie eingeschlossen und eine Biopsie organisiert. In der extern durchgeführten Gastroskopie mit Real-Time-Biopsie sowie in derPET/CT bestätigt sich der Verdacht eines Progresses. Der Patient wird anschließend in den Arm A (scFPM) randomisiert. Das scFPM kann jedoch aufgrund einer Kontamination der Gewebeprobe nicht durchgeführt werden. Gemäß dem Studienprotokoll erfolgt daher ein Einschluss in den Arm B (CGP).
Zwischenzeitlich muss der Patient aufgrund von Abdominalgie und einem erneuten Ikterus stationär aufgenommen werden. Nach Stentimplantation im Rahmen einer ERCP bessern sich die Cholestaseparameter, sodass bei dringender Therapieindikation eine Vorphase mit Cyclophosphamid und Prednisolon gestartet werden kann. Nach Erhalt des Befundergebnisses des CGP zwei Wochen nach der Biopsie werden die Ergebnisse im Zuge des EXALT-2-Tumorboards diskutiert. Im FoundationOne-Heme-Report zeigt sich überraschenderweise neben einer MYC-Translokation auch eine BCL-2-Translokation. Da bei einem Burkitt-Lymphom nur eine MYC-Translokation besteht, wird die Primärdiagnose eines Burkitt-Lymphoms auf ein „double-hit high-grade B-cell lymphoma“ (HGBCL) korrigiert. Eine erneute Analyse des histologischen Gewebes bei Erstdiagnose bestätigt, dass es sich zu beiden Zeitpunkten bereits um ein HGBCL und um eine Entität gehandelt hat.
Im FoundationOne Heme-Report wird der BCL-2-Inhibitor Venetoclax empfohlen. Eine Indikation für eine Routine-CAR-T-Zell-Therapieoder einen CAR-T-Zell-Therapie-Studieneinschluss ist bei den gegebenen Kriterien nicht erfüllt, sodass der Patient in der EXALT-2-Studie belassen wird. Im Rahmen des Tumorboards wird entsprechend der FoundationOne-Heme-Empfehlung eine Therapie mit Venetoclax in Kombination mit Rituximab, Cyclophosphamid, Doxorubicin, Vincristin und Prednisolon (R-CHOP) analog der CAVALLI-Studie beschlossen.13 Bei guter Verträglichkeit und klinischer Besserung kann nach drei Zyklen R-CHOP plus Venetoclax eine Größenregredienz des Primums nachgewiesen werden. Es wurden keine weiteren pathologisch vergrößerten oder FDG-aviden Lymphknoten festgestellt.
Diskussion: Vorteile der Präzisionsmedizin
Die biotechnologischen Fortschritte, die Möglichkeiten zur Erstellung eines molekularen Tumorprofils mittels NGS, Proteom- und RNA-Analysen sowie ein besseres Verständnis der Funktionsweise des Immunsystems haben in den letzten Jahren zu einer Optimierung der Krebstherapie geführt. Die Herausforderung liegt in der Heterogenität und Komplexität von Tumorerkrankungen. Methoden der Präzisionsmedizin sollen helfen, sich dieser Herausforderung zu stellen, und finden nach und nach Eingang in die klinische Praxis. Im Zentrum steht die bestmögliche Versorgung von Patient*innen nach dem neuesten Stand von Wissenschaft und Forschung bei gleichzeitiger höchstmöglicher Behandlungsqualität und Patient*innensicherheit.
Bisherige Studien zum Nutzen präzisionsmedizinischer Methoden kommen zu keinem eindeutigen Ergebnis.6,7,14,15 Um zu beurteilen, ob und, wenn ja, welche Auswirkungen der Einsatz von Präzisionsmedizin auf den Behandlungserfolg hat, sind weitere kontrollierte Studien notwendig. Das Studiendesign erfährt hierbei eine kontinuierliche Weiterentwicklung: weg von einem tumortypzentrierten Ansatz, hin zu einem genorientierten, funktionellen, personalisierten Ansatz mit innovativem adaptivem Design. In Österreich wurde mit der EXALT-2-Studie eine prospektive, randomisierte Studie mit einem neuartigen Studiendesign gestartet.
In dieser wird nun eine mögliche Verbesserung des Therapieerfolgs durch den Einsatz von Präzisionsmedizin im Vergleich zu „physicians’ choice“ bei Patient*innen mit aggressiven hämatologischen Erkrankungen untersucht. Anders als bei häufig auftretenden Formen von Krebserkrankungen, bei welchen es gut etablierte Therapierichtlinien gibt, kann das Finden einer zielgerichteten Therapie bei seltenen bösartigen Erkrankungen und/oder stark vorbehandelten Patient*innen komplexer sein. Es bedarf einer genauen Analyse und Bewertung der generierten Daten sowie der Involvierung von erfahrenen Expert*innen unterschiedlicher Fachgebiete und Standorte.
In der EXALT-2-Studie besteht nun die Chance, sich im Rahmen des multizentrischen molekularen Tumorboards über Krankenhaus- und Bundeslandgrenzen hinaus auszutauschen und Expert*innen aus ganz Österreich zu bündeln, um für alle Patient*innen die optimale Therapie planen zu können. Zukünftig wäre die Etablierung eines standortübergreifenden nationalen Tumorboards auch außerhalb von klinischen Studien wünschenswert. Dies wird mit neuen Herausforderungen verbunden sein, etwa der Klärung von Datenschutzfragen sowie der Schaffung der technischen Voraussetzungen an allen teilnehmenden Kliniken.
Letztlich sollte das Patient*inneninteresse im Mittelpunkt stehen und es sollte sichergestellt sein, dass – unabhängig vom Wohnort – alle Patient*innen in Österreich die gleichen Chancen auf eine optimale Therapie haben.
Literatur:
1 Valent P et al.: Precision medicine in hematology 2021: definitions, tools, perspectives and open questions. Hemasphere 2021; 5(3): e536 2 Kantarjian H et al.: Improved survival in chronic myeloid leukemia since the introduction of imatinib therapy. Blood 2012; 119(9): 1981-7 3 Nam A et al.: Integrating genetic and non-genetic determinants of cancer evolution by single-cell multi-omics. Nat Rec Genet 2021; 22(1): 3-18 4 Snijder B et al.: Image-based ex-vivo drug screening for patients with aggressive haematological malignancies: interim results from a single-arm, open-label, pilot study. Lancet Haematol 2017; 4(12): e595-606 5 Kornauth C et al.: Functional precision medicine provides clinical benefit in advanced aggressive hematologic cancers and identifies exceptional responders. Cancer Discov 2022; 12(2): 372-87 6 Sicklick J et al.: Molecular profiling of advanced malignancies guides first-line N-of-1 treatments in the I-PREDICT treatment-naïve study. Genome Med 2021; 13: 155 7 Rodon J et al.: Genomic and transcriptomic profiling expands precision cancer medicine.: the WINTHER-trial. Nat Med 2019; 25(5): 751-8 8 Von Hoff D et al.: Pilot study using molecular profiling of patients‘ tumors to find potential targets and select treatments for their refractory cancers. J Clin Oncol 2010; 28(33): 4877-83 9 Fisher R et al.: Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin‘s lymphoma. N Engl J Med 1993; 328(14): 1002-6 10 Hapgood G et al.: The biology and management of systemic anaplastic large cell lymphoma. Blood 2015; 126(1): 17-25 11 Laimer D et al.: PDGFR blockade is a rational and effective therapy for NPM-ALK-driven lymphomas. Nat Med 2012; 18(11): 1699-704 12 Hoelzer D et al.: Improved outcome of adult Burkitt lymphoma/leukemia with rituximab and chemotherapy: report of a large prospective multicenter trial. Blood 2014; 124(26): 3870-9 13 Morschhauser F et al.: A phase 2 study of venetoclax plus R-CHOP as first-line treatment for patients with diffuse large B-cell lymphoma. Blood 2021; 137(5): 600-9 14 Le Tourneau C et al.: Molecularly targeted therapy based on tumour molecular profiling versus conventional therapy for advanced cancer (SHIVA): a multicentre, open-label, proof-of-concept, randomised, controlled phase 2 trial. Lancet Oncol 2015; 16(13): 1324-34 15 Rothwell D et al.: Utility of ctDNA to support patient selection for early phase clinical trials: the TARGET study. Nat Med 2019; 25(5): 738-43
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...