ESMO Breast Cancer: Kombinationen auf dem Prüfstand und Daten zur Fertilität
Bericht:
Dr. Judith Moser
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mehr als 3400 Teilnehmer:innen aus über 100 Ländern kamen von 15. bis 17. Mai 2024 in Berlin sowie auf der virtuellen Kongressplattform zusammen, um im Rahmen des ESMO Breast Cancer 2024 rezente Entwicklungen im Bereich von Diagnostik und Therapie des Mammakarzinoms zu diskutieren. Einige der 279 präsentierten Abstracts werden in der Folge zusammengefasst.
Anhaltende Benefits unter Capivasertib/Fulvestrant
Die randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie CAPItello-291 prüfte den AKT-Inhibitor Capivasertib in Kombination mit Fulvestrant bei Patient:innen mit Hormonrezeptor(HR)-positivem/HER2-negativem fortgeschrittenem Mammakarzinom, die innerhalb von zwölf Monaten nach der adjuvanten Aromataseinhibitor(AI)-Therapie oder unter dieser bzw. einer AI-Behandlung im metastasierten Setting eine Progression erlitten hatten. Im fortgeschrittenen Stadium bestand eine Vortherapie mit ≤2 endokrinen Linien und ≤1 Chemotherapielinie. Verglichen mit der Fulvestrant-Monotherapie fanden sich signifikante Verlängerungen des progressionsfreien Überlebens (PFS) in der Gesamtpopulation sowie in der Gruppe mit PIK3CA-/AKT1-/PTEN-aberranten Tumoren.1
Am ESMO Breast Cancer 2024 vorgestellte Ergebnisse weisen auf lang anhaltende Vorteile der Kombination hin.2 Nach dem Absetzen der Studienmedikation kam als erste Behandlungsform meist Chemotherapie zum Einsatz. Das PFS2 (d.h. die Zeit zwischen Randomisierung und zweiter Progression) war im Prüfarm länger als im Kontrollarm, was sowohl auf die Gesamtpopulation (medianes PFS2: 14,7 vs. 12,5 Monate; HR: 0,70) als auch die PIK3CA-/AKT1-/PTEN-alterierte Gruppe (15,5 vs. 10,8 Monate; HR: 0,52) zutraf.
Der Benefit durch die Zugabe von Capivasertib blieb somit über das Ende der Studientherapie hinaus erhalten. Ebenso bewirkte die Kombination eine deutliche Verlängerung der Zeit bis zur ersten nachfolgenden Chemotherapie im Gesamtkollektiv (11,0 vs. 6,8 Monate; HR: 0,63) und in der Gruppe mit PIK3CA-/AKT1-/PTEN-Aberrationen (11,0 vs. 6,0 Monate; HR: 0,56).
CDK4-selektive Inhibition nach CDK4/6-Versagen
Ebenfalls im HR-positiven/HER2-negativen fortgeschrittenen Setting wird PF-07220060 evaluiert, ein selektiver First-in-Class-Inhibitor von CDK4. Das Aussparen der CDK6-Hemmung ermöglicht eine Senkung der Neutropenieraten.3 In den Parts 1B und 1C einer Phase-I/IIA-Multikohortenstudie gelangt PF-07220060 in Kombination mit Letrozol bzw. Fulvestrant bei Patient:innen zum Einsatz, die unter einer CDK4/6-Inhibition+endokriner Therapie eine Metastasierung entwickelt haben.
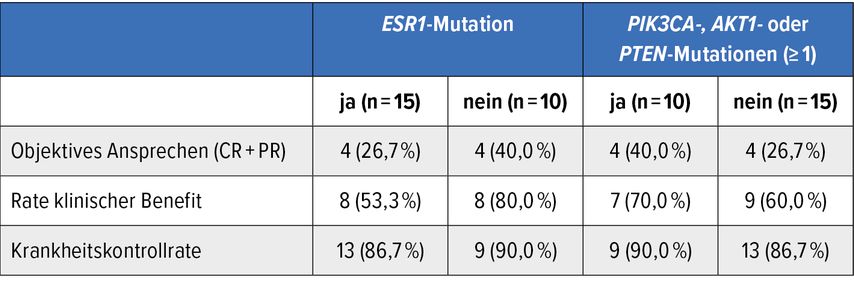
Gemäß den aktualisierten Daten erreichten 32,0% von 25 Personen mit messbarer Erkrankung ein objektives Ansprechen, wobei es in einem Fall zur Komplettremission (CR) kam (3,0%).4 Ein klinischer Benefit (CR+partielle Remission [PR] und Krankheitsstabilisierung [SD] ≥24 Wochen) resultierte in 64,0%. In der Gesamtpopulation beider Kohorten (n=33) wurde eine Krankheitskontrolle (CR+PR, SD sowie Ansprechen ohne CR und ohne Krankheitsprogression) in 81,8% erzielt. Das mediane PFS betrug 8,1 Monate. Auch Patient:innen mit prognostisch ungünstigen Mutationen profitierten von der Therapie (Tab. 1).
Tab. 1: Ansprechen auf PF-07220060 bei Patient:innen mit prognostisch ungünstigen Mutationen (modifiziert nach Guiu S et al.)4
PF-07220060 legte ein vorteilhaftes Verträglichkeitsprofil mit hauptsächlich niedriggradigen Toxizitäten an den Tag. Als häufigste therapieassoziierte Grad-3-Nebenwirkung fanden sich Zytopenien, diese konnten jedoch mittels Therapiepausen und Dosisreduktionen beherrscht werden. Dosismodifikationen waren selten und es traten keine therapiebedingten Ereignisse der Schweregrade ≥4 auf. In ihrer Gesamtheit untermauern diese Daten die im Laufen befindliche randomisierte Phase-III-Studie, die PF-07220060+Fulvestrant beim fortgeschrittenen HR-positiven/HER2-negativen Mammakarzinom nach Progression unter einer CDK4/6-Inhibitor-basierten Behandlung untersucht (NCT06105632).
DOLAF: Olaparib, Durvalumab & Fulvestrant
Patient:innen mit fortgeschrittenem Östrogenrezeptor-positivem, HER2-negativem Mammakarzinom und Defizienz der homologen Rekombinationsreparatur (HRR) bzw. Mikrosatelliteninstabilität (MSI) gingen in die internationale, einarmige Phase-II-Studie DOLAF ein, die den PARP-Inhibitor Olaparib in Kombination mit dem PD-L1-Antikörper Durvalumab und Fulvestrant testete. Bei prämenopausalen Personen wurde zusätzlich Goserelin verabreicht.
Die Patient:innen zeigten eine endokrine Resistenz, nachdem vor Studieneinschluss hauptsächlich CDK4/6-Inhibitoren verabreicht worden waren. In der Gesamtgruppe von 172 Personen wiesen 62 BRCA1/2-Keimbahnmutationen und 53 HRR-Mutationen auf. Auch ein Einschluss auf der Basis von Target-Genen, die eine endokrine Resistenz vermitteln (z.B. PIK3CA, ESR1), war erlaubt (n=47).
Die Kombination Olaparib+Durvalumab und Fulvestrant demonstrierte vielsprechende klinische Aktivität. Die PFS-Rate nach 24 Wochen (primärer Endpunkt) betrug 66,7%, das mediane PFS 9,3 Monate, die objektive Ansprechrate (ORR) 41% und das mediane Gesamtüberleben (OS) 30,0 Monate.5 Besonders ausgeprägt war der Benefit in der Gruppe mit BRCA1/2-Keimbahnmutationen (medianes PFS: 12,6 Monate; PFS-Rate nach 24 Wochen: 76,3%).
Die Autor:innen weisen darauf hin, dass sich die Ergebnisse mit den aktuellen Therapiestandards in der Zweit- und Drittlinie messen können, was auch auf das Kollektiv mit HRR-Mutationen zutraf. Weitere Studien sind erforderlich, um diese Resultate zu bestätigen und die Subgruppe zu identifizieren, die von der Triplette am meisten profitieren könnte.
Atezolizumab+SG beim tripelnegativen Karzinom
Im Setting des PD-L1-positiven, fortgeschrittenen tripelnegativen Mammakarzinoms (TNBC) erhalten 31 Patient:innen in der offenen, multizentrischen, randomisierten Phase-IB/II-Plattformstudie MORPHEUS-panBC randomisiert Atezolizumab in Kombination mit dem Trop-2-gerichteten Antikörper-Wirkstoff-Konjugat Sacituzumab Govitecan (SG) als Erstlinientherapie. Im Kontrollarm wird das Standardschema aus Atezolizumab und nab-Paclitaxel verabreicht (n=11).
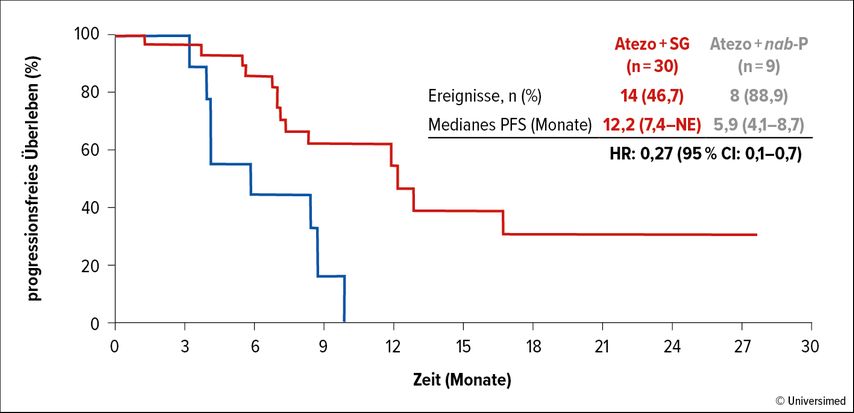
Gemäß der am ESMO Breast Cancer 2024 präsentierten Interimsanalyse bewirkte Atezolizumab+SG eine ORR von 76,7% (vs. 66,7% unter Atezolizumab+ nab-Paclitaxel).6 Komplettremissionen wurden nur im Prüfarm beobachtet (16,7%). Ein klinischer Benefit (objektives Ansprechen und/oder mindestens Krankheitsstabilisierung über ≥24 Wochen) resultierte in 83,3% vs. 66,7%. Für das PFS waren die Daten noch nicht reif, die Analyse zeigte jedoch einen beeindruckenden Vorteil im Prüfarm (12,2 vs. 5,9 Monate; HR: 0,27; Abb. 1). Mit 14,0 Monaten fiel die mediane Ansprechdauer unter der SG-basierten Kombination noch länger aus (vs. 7,1 Monate; HR: 0,17), obwohl auch hier die Daten noch nicht reif sind.
Abb. 1: MORPHEUS-panBC – progressionsfreies Überleben unter Atezolizumab plus Sacituzumab Govitecan (SG) vs. Atezolizumb plus nab-Paclitaxel (modifiziert nach Schmid P et al.)6
Tumorreduktionen manifestierten sich bei allen Trop-2-Expressionslevels, wenngleich bei höherer Expression ein Trend zu höheren Ansprechraten bestand. Weiters zeigten Responder eine vergleichsweise stärkere Infiltration mit CD8-positiven T-Zellen und stromalen tumorinfiltrierenden Lymphozyten.
Das Sicherheitsprofil der Kombination aus Atezolizumab und SG entsprach den Profilen der Einzelkomponenten. Als häufigste Toxizitäten fanden sich Übelkeit, Neutropenie, Diarrhö, Erbrechen und Hautausschläge. In beiden Armen starben keine Patient:innen aufgrund von unerwünschten Ereignissen. Dosismodifikationen oder Therapiepausen aufgrund von behandlungsbezogenen Nebenwirkungen wurden in 83,3% vs. 33,3% verzeichnet.
IMpassion132: keine Verbesserung durch Atezolizumab
Rund die Hälfte aller Patient:innen, die eine Progression eines TNBC nach der (neo-)adjuvanten Chemotherapie entwickeln, erleiden ihr Rezidiv innerhalb von zwölf Monaten nach Abschluss der Behandlung.7,8 Das frühzeitig rezidivierende TNBC stellt eine biologisch und klinisch eigenständige Erkrankung mit hoher Aggressivität und intrinsischer Resistenz gegenüber den aktuellen Standardtherapien dar.9,10
Die doppelblinde Phase-III-Studie IMpassion132 prüfte daher die Zugabe von Atezolizumab zur Erstlinien-Chemotherapie bei Patient:innen mit nichtresektablem lokal fortgeschrittenem oder metastasiertem TNBC, die innerhalb von zwölf Monaten nach der letzten mit kurativer Intention durchgeführten Therapie eine Progression entwickelt hatten. Allerdings konnten das OS und andere Endpunkte durch die Zugabe von Atezolizumab im Vergleich zur alleinigen Chemotherapie nicht verbessert werden.11
Wie die Autor:innen festhalten, sind neue Behandlungsformen und Studiendesigns in dieser therapieresistenten, mit einer extrem ungünstigen Prognose behafteten Population dringend notwendig. Auch sollten translationale Forschungen Licht auf die potenziell vielfältigen Resistenzmechanismen nach Vortherapie werfen. Insgesamt unterstreichen die Daten die Wichtigkeit der Heterogenität des TNBC für die Prognose, speziell im Erstliniensetting.
Sicherheit der assistierten Reproduktion nach BC
Bekanntermaßen beeinflusst eine Schwangerschaft nach überstandener Mammakarzinomerkrankung die Prognose nicht nachteilig, was auch auf Patient:innen zutrifft, die pathogene BRCA-Keimbahnvarianten aufweisen.12,13 Eine wachsende Datenmenge weist auf die Sicherheit von assistierten Reproduktionstechniken (ART) vor oder nach Antikrebstherapien hin.14 Zur Anwendung und Sicherheit von ART bei BRCA-Träger:innen mit einer Mammakarzinomanamnese existierte bisher nur limitierte Evidenz.
Lambertini et al. präsentierten Daten zum prognostischen Effekt von ART bei jungen BRCA-Träger:innen nach Mammakarzinom auf der Basis der globalen retrospektiven Kohortenstudie BRCA BCY Collaboration.15 In diese gingen Menschen mit invasiven Tumoren im Stadium I–III und pathogenen Keimbahnvarianten von BRCA1 und/oder BRCA2 ein, die nach ihrer Erkrankung eine Schwangerschaft durchliefen. Es erfolgte eine Einteilung in zwei Gruppen, wobei die Patient:innen in der einen Gruppe mithilfe von ART schwanger geworden waren (n=107) und die in der anderen ohne ART (n=436). ART umfasste kontrollierte ovarielle Stimulation (COS) zwecks Kryokonservierung von Eizellen und/oder Embryonen zum Zeitpunkt der Mammakarzinomdiagnose (Fertilitätserhaltung; 45,5%), COS nach der Antikrebstherapie (33,3%) sowie Eizellspende (21,2%).
Vergleichbare Ergebnisse
In der ART-Gruppe waren die Patient:innen zum Zeitpunkt der Empfängnis signifikant älter als in der Nicht-ART-Gruppe (37,1 vs. 34,3 Jahre), und die Zeit zwischen der Karzinomdiagnose und der Konzeption war länger (4,2 vs. 3,3 Jahre). Die beiden Gruppen erzielten vergleichbare Schwangerschafts-Outcomes.
In 81,6% vs. 87,0% verliefen die Schwangerschaften komplikationslos und Kinder wurden in 83,0% vs. 79,8% geboren. Fehlgeburten fanden sich in der ART-Gruppe etwas häufiger (11,3 % vs. 8,8%), während Schwangerschaftsabbrüche häufiger in der Nicht-ART-Gruppe erfolgten (0,9 % vs. 8,3%).
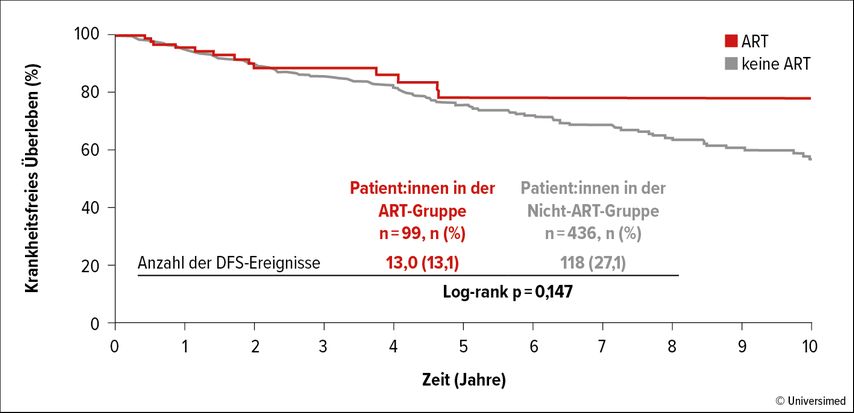
Auch die mütterliche Prognose erfuhr keine Verschlechterung durch ART. Ereignisse, die das krankheitsfreie Überleben (DFS) herabsetzten, traten in der ART-Gruppe sogar seltener auf (13,1% vs. 27,1%; Abb. 2). Sie umfassten hauptsächlich lokoregionale Rezidive (6,1% vs. 5,0%) sowie sekundäre Primärmalignome der Mamma (2,0% vs. 14,9%).
Abb. 2: Krankheitsfreies Überleben (DFS) nach Schwangerschaft mithilfe assistierter Reproduktion vs. ohne assistierte Reproduktion (modifiziert nach Lambertini M et al.)15
Im Hinblick auf das Mammakarzinom-spezifische Überleben wurden Ereignisse in 1,0% bzw. 4,8% dokumentiert, und es verstarben 1,0% bzw. 5,3% der Patient:innen. Wie eine exploratorische Analyse nahelegt, variierte das DFS zwischen den einzelnen ART-Verfahren nicht und war bei allen Verfahren länger als in der Nicht-ART-Gruppe.
In ihrer Zusammenfassung weisen die Autor:innen darauf hin, dass diese Ergebnisse für die Onkofertilitätsberatung junger Mammakarzinompatient:innen essenziell sind. Auch wenn sie erst prospektiv bestätigt werden müssen, sollten allen interessierten Patient:innen einschließlich BRCA-Träger:innen mit frühem Mammakarzinom zum Diagnosezeitpunkt fertilitätserhaltende Maßnahmen angeboten werden.
Quelle:
ESMO Breast Cancer 2024, 15.–17. Mai 2024, Berlin
Literatur:
1 Turner NC et al.: Capivasertib in hormone receptor-positive advanced breast cancer. N Eng J Med 2023; 388(22): 2058-70 2 Rugo H et al.: ESMO Breast Cancer 2024; Abstr. #183MO 3 Yap TA et al.: J Clin Oncol 41; 2023 (Suppl. 16): Abstr. #3009 4 Yap TA et al.: ESMO Breast Cancer 2024; Abstr. #184MO 5 Guiu S et al.: ESMO Breast Cancer 2024; Abstr. #1790 6 Schmid P et al.: ESMO Breast Cancer 2024; Abstr. #1810 7 Grinda T et al.: Real-world clinical and survival outcomes of patients with early relapsed triple-negative breast cancer from the ESME national cohort. Eur J Cancer 2023; 189: 112935 8 Kim H et al.: Cancers (Basel) 2021; 13: 5835 9 Zhang Y et al.: Genomic features of rapid versus late relapse in triple negative breast cancer. BMC Cancer 2021; 21(1): 568 10 Karaayvaz M et al.: Unravelling subclonal heterogeneity and aggressive disease states in TNBC through single-cell RNA-seq. Nat Commun 2018; 9(1): 3588 11 Dent RA et al.: ESMO Breast Cancer 2024; Abstr. #180O 12 Lambertini M et al.: Pregnancy after breast cancer: a systematic review and meta-analysis. JClin Oncol 2021; 39(29): 3293-305 13 Lambertini M et al.: Pregnancy after breast cancer in young BRCA carriers: an international hospital-based cohort study. JAMA 2024; 331(1): 49-59 14 Arecco L et al.: Safety of fertility preservation techniques before and after anticancer treatments in young women with breast cancer: a systematic review and meta-analysis. Hum Reprod 2022; 37(5): 954-68 15 Lambertini M et al.: ESMO Breast Cancer 2024; Abstr. #2660
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...