Erster mutationsspezifischer Therapieansatz & neue JAK2-Inhibitoren
Autoren:
Prof. Dr. med. Sara C. Meyer, PhD
Chefärztin Hämatologie
Michael Liu
Assistenzarzt
Klinik für Hämatologie und Hämatologisches Zentrallabor
Inselspital, Universitätsspital Bern
Korrespondenz:
E-Mail: sara.meyer@insel.ch
Myeloproliferative Neoplasien und ihr therapeutisches Management waren ein wichtiger Bestandteil des 64. ASH-Kongresses. Einblicke gab es u.a. zu bald erwarteten neuen Therapeutika, innovativen Targets und der molekularen Pathogenese der MPN. Besondere Aufmerksamkeit galt dabei neuen Erkenntnissen zum Potenzial einer effektiven Krankheitsmodifikation, die mit bisherigen Therapiemodalitäten nur in begrenztem Umfang erzielt werden konnte.
Keypoints
-
Der ASH-Jahreskongress 2022 hat beeindruckt durch die neuen Therapieoptionen mit Potenzial für eine Krankheitsmodifikation der MPN.
-
Mit dem monoklonalen Antikörper gegen das CALR-Onkogen wurde erstmalig ein mutationsspezifischer Therapieansatz vorgestellt.
-
Weitere JAK2-Inhibitoren mit vorteilhaftem Profil bei Zytopenien stehen kurz vor der Zulassung und werden in der Behandlung von Patienten mit Myelofibrose mehr Handlungsspielraum erlauben.
-
Positive Signale gab es für das Potenzial von pegylierten Formen von Interferonalpha sowie für Kombinationstherapien mit JAK2-Inhibitoren.
-
Die vorgestellten Therapieansätze werden unsere Behandlungsmöglichkeiten für Patienten mit MPN in den nächsten Jahren massgeblich erweitern.
Mutiertes Calretikulin als therapeutisches Target
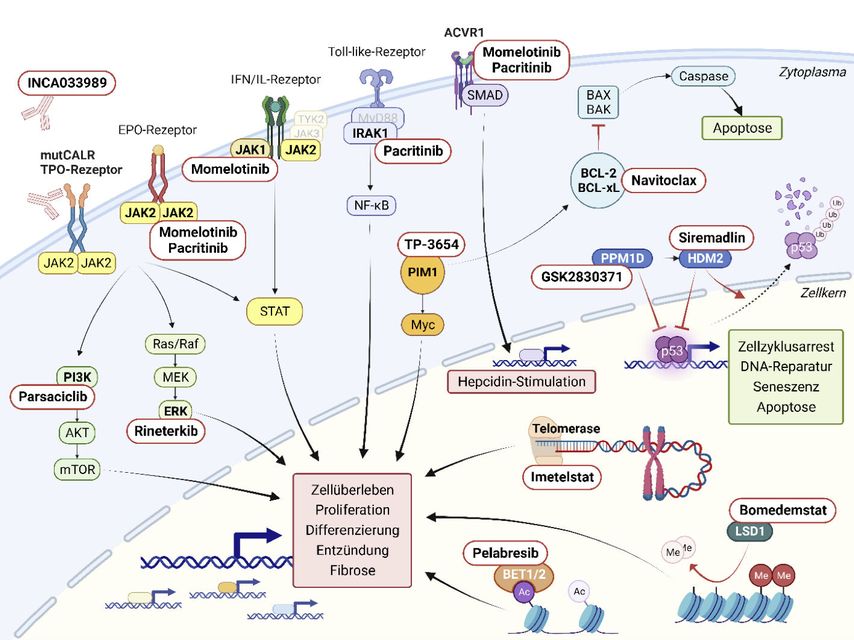
Erstmals wurde mit dem monoklonalen Antikörper INCA033989, der gegen das Onkogen Calretikulin (CALR) gerichtet ist, ein mutationsspezifischer Therapieansatz für die MPN vorgestellt. Dieser Ansatz stösst auf besonderes Interesse, da er grosses Potenzial für einen krankheitsmodifizierenden Effekt hat. Dieser könnte MPN-Patienten mit mutiertem Calretikulin, der zweithäufigsten Driver-Mutation bei MPN-Patienten, zugutekommen.
CALR-Mutationen liegen bei ca. 30% der Patienten mit essenzieller Thrombozythämie und Myelofibrose vor. Durch Insertion/Deletion im Exon 9 des CALR-Gens resultiert ein Frameshift mit veränderter Proteinstruktur und Bindung von mutiertem CALR an den Thrombopoietin-Rezeptor (TPO-R oder MPL) und Exposition des CALR/MPL-Komplexes an der Zelloberfläche. Dies führt einerseits zu einer konstitutiven Aktivierung des JAK2-Signaling, das für die Pathogenese bei MPN zentral ist, und macht andererseits das CALR-Onkogen an der Zelloberfläche für therapeutisches Targeting zugänglich.1,2
Der monoklonale IgG1-Antikörper INCA033989 erlaubt, über eine selektive Bindung an mutiertes CALR, das an der Zelloberfläche exponiert ist, die JAK2-Überaktivierung zu unterdrücken. Vorgestellt wurden vorerst präklinische Daten basierend auf In-vitro- und In-vivo-Modellen von CALR-mutierten MPN. Es konnten eine Spezifität des monoklonalen Antikörpers für mutiertes CALR und eine Inhibition der JAK2-Signalkaskade belegt werden. Dies resultierte in einer verminderten Proliferation sowie Induktion von Zyklusarrest und Zelltod von CALR-mutierten MPN-Zellen sowie auch einer selektiven Reduktion von CALR-mutierten zirkulierendenThrombozyten und CALR-mutierten Stammzellen im Knochenmark.1
Mit INCA033989 wurde somit erstmals ein mutationsspezifischer Therapieansatz für MPN entwickelt, der das Potenzial für eine effektive Krankheitsmodifikation durch selektives Targeting des CALR-mutierten Klons bis auf Stammzellebene hat und aufgrund der Spezifität für CALR-mutierte Zellen auch eine gute Tolerabilität aufweisen könnte.1 Dies unterstreicht auch die Wichtigkeit eines analogen, mutationsspezifischen Behandlungsansatzes für die JAK2-V617F-mutierten MPN, um eine effektive Krankheitsmodifikation bei JAK2-mutierten MPN erreichen zu können.
Neue JAK2-Inhibitoren: Pacritinib und Momelotinib
JAK2-Inhibitoren mit einem vorteilhaften Profil bei Zytopenien sind für die Behandlung der Myelofibrose von grossem Interesse. Einerseits weisen Patienten mit fortgeschrittener Myelofibrose (MF) häufig Zytopenien, insb. Anämie und/oder Thrombozytopenie, auf. Andererseits können bisherige JAK2-Inhibitoren wie Ruxolitinib und Fedratinib durch die nichtmutationsspezifische Hemmung von JAK2 die Hämatopoese generell hemmen und Zytopenien dadurch aggravieren. Mit Pacritinib und Momelotinib stehen zwei JAK2-Inhibitoren kurz vor der Zulassung, die sich aufgrund ihres Wirkprofils bei der Behandlung von MPN-Patienten mit Zytopenien, insb. auch nach Versagen von Ruxolitinib, als wichtig erweisen könnten.
Pacritinib inhibiert neben JAK2 auch IRAK1, FLT3 und ACVR1. Randomisierte Phase-III-Studien (PERSIST-1, PERSIST-2) hatten einen klinischen Nutzen mit reduzierter Symptomlast und Splenomegalie bei Patienten mit MF und Thrombozytopenie gezeigt.3 Entsprechend wird von einer guten Verträglichkeit von Pacritinib bei Patienten mit Thrombopenie ausgegangen.
Präsentiert wurden jetzt neue Daten zur Wirkung von Pacritinib auf den Hepcidin-Spiegel über Inhibition von ACVR1 und den Effekt bei bestehender Anämie. ACVR1 beeinflusst u.a. die Transkription von Hepcidin, das den Eisenstoffwechsel und damit die Erythropoese beeinflusst, sodass durch Inhibition von ACVR1 eine Verbesserung der Anämie bewirkt werden soll.4,5 In vitro konnte für Pacritinib sogar eine stärkere ACVR1-Inhibition als durch Momelotinib gezeigt werden, während Fedratinib und Ruxolitinib bekannterweise keine nennenswerte ACVR1-Hemmung vermitteln.
Eine Post-hoc-Analyse der PERSIST-2-Studie konnte einen deutlichen Effekt von Pacritinib auf Anämie und Transfusionsbedürftigkeit zeigen, inkl. einer signifikant höheren Transfusionsunabhängigkeit initial transfusionspflichtiger Patienten nach 24 Wochen (37% vs. 7%).5
Momelotinib inhibierte neben JAK2 und JAK1 ebenfalls ACVR1, mit den erwähnten Effekten auf den Hepcidin-Spiegel. Ein günstiger Effekt auf die Anämie von Patienten mit MF wurde bereits berichtet. Ein Update zur Phase-III-Studie MOMENTUM, die den mildernden Effekt von Momelotinib auf die Anämie im Vergleich zu Danazol bei Patienten mit MF untersucht hat, konnte diesen Verdacht erhärten.
195 JAK-Inhibitor-vorbehandelte MF-Patienten mit konstitutionellen Symptomen, Anämie (Hb <10g/l) und Thrombozyten >25G/L wurden für 48 Wochen mit Momelotinib oder Danazol behandelt.6 Die neuen Daten aus der Open-Label-Phase zeigten bei fast allen Patienten, die nach 24 Wochen ein Ansprechen zeigten, einen anhaltenden Benefit unter Momelotinib bis Woche 48, und zwar für Symptomkontrolle, Transfusionsunabhängigkeit und Milzgrösse.7 Nicht-Responder in Woche 24 hatten zudem eine Chance auf eine späte Response bis Woche 48. In der wichtigen Patientenpopulation mit Thrombozyten <100G/L fand sich ein konsistentes Ansprechen der untersuchten Endpunkte bis Woche 24 im Vergleich zur Gesamtpopulation ohne zusätzliche Safety-Signale.
Mit Pacritinib und Momelotinib stehen zwei JAK2-Inhibitoren mit zusätzlichem Effekt auf ACVR1 und damit den Hepcidinstoffwechsel kurz vor der Zulassung in Europa. Sie sind bei MPN-Patienten mit Zytopenien gut einsetzbar und können neben Symptomkontrolle und Milzverkleinerung weitere wichtige klinische Outcomes wie Transfusionsabhängigkeit positiv beeinflussen.
Pegyliertes Interferonalpha +/– Ruxolitinib – eine vorteilhafte Option?
Der JAK1/2-Inhibitor Ruxolitinib und pegyliertes Interferonalpha haben einen wichtigen Stellenwert in der Behandlung der MPN mit jeweils anderem Wirkprofil. Während Ruxolitinib wirksam konstitutionelle Symptome und Splenomegalie verringert, hat pegyliertes Interferonalpha das Potenzial für eine Krankheitsmodifikation mit Abnahme der MPN-Klongrösse. Entsprechend wurden die finalen Daten der Phase-I/II-Studie RUXOPEG mit Spannung erwartet.
Es wurden über 12 Monate Ruxolitinib und pegyliertes Interferonalpha kombiniert und die Kombinationstherapie bei insgesamt 38 Patienten mit MF untersucht. Im Follow-up nach 12 Monaten wurde eine massgebliche Reduktion der Splenomegalie bei einer Mehrheit (76%) der Patienten beobachtet. Die Nebenwirkungen entsprachen dem bekannten Profil von Ruxolitinib wie auch von pegyliertem Interferonalpha, schwere Nebenwirkungen ≥Grad 3 waren jedoch selten (8%).8 Während gewisse Verbesserungen der Knochenmarkmorphologie auftraten, zeigte sich eine Segregation der Patienten in eine Gruppe mit molekularer Response und Reduktion der MPN-Klongrösse, während eine zweite Gruppe kein direktes Ansprechen der Allellast aufwies. Ko-Mutationen in ASXL1 waren dabei mit einem fehlenden molekularen Ansprechen assoziiert, während die Abwesenheit von Ko-Mutationen oder Ko-Mutationen in TET2undDNMT3A mit einem besseren molekularen Ansprechen einhergingen.8
Das Potenzial von pegyliertem Interferonalpha wurde auch bei weiteren Beiträgen am ASH-Kongress ersichtlich. So wurde ein Update der Phase-II-Studie Low-PV zu 127 Patienten mit Niedrigrisiko-Polycythaemia vera (PV) präsentiert, die mittels Ropeginterferon alfa-2b plus Standardtherapie versus Standardtherapie alleine behandelt wurden. Nach 12 und 24 Monaten fand sich ein signifikanter Vorteil für die Behandlung mit Ropeginterferon alfa-2b bezüglich des kombinierten primären Endpunktes eines Hämatokrits <45% und Abwesenheit einer krankheitsassoziierten Progression oder Komplikation.9 Die Anzahl der Aderlässe war unter Therapie mitRopeginterferon alfa-2b ebenfalls signifikant niedriger. Nebenwirkungen traten jedoch häufiger auf, mit 84% vs. 50% der Patienten, wobei es auch zu Therapieabbrüchen kam.9
Insgesamt unterstreichen diese Ergebnisse das krankheitsmodifizierende Potenzial von pegyliertem Interferon alpha. Ein längeres Follow-up im Hinblick auf die Effektivität in Abwägung des Nebenwirkungsprofils ist jedoch wünschenswert, bevor Ropeginterferon alfa-2b zum breiten Therapiestandard bei Patienten mit Niedrigrisiko-PV erklärt werden kann. Das Potenzial von Ropeginterferon alfa-2b wurde weiter auch in einer einarmigen Phase-II- Studie bei 60 Patienten mitpräfibrotischer MF bzw. mit «Low»- oder «Intermediate1»-Risikokonstellation im DIPSS untersucht – mit ermutigenden Resultaten.10
Neue Kombinationstherapien mitRuxolitinib
Die Verfügbarkeit des JAK1/2-Inhibitors Ruxolitinib hat das Management der MPN massgeblich verändert. Obwohl der therapeutische Benefit von Ruxolitinib bzgl. Reduktion von konstitutionellen Symptomen und Splenomegalie offensichtlich ist, bleibt sein Effekt hinter den Erwartungen zurück. Es bestehen wichtige Limitationen gerade hinsichtlich einer Krankheitsmodifikation. Auch kann das Ansprechen auf die Behandlung mit Ruxolitinib in einem Zeitraum von 2–5 Jahren verloren gehen und zu einem Rebound der Symptome führen.
Entsprechend besteht ein grosses Interesse an zusätzlichen molekularen Targets, die in der Pathogenese der MPN eine relevante Rolle spielen und zusätzlich zu JAK2 therapeutisch angegangen werden können. Am ASH-Kongress 2022 wurde eine Reihe von Phase-I- und Phase-II-Studien zu Kombinationstherapien mit dem JAK-Inhibitor Ruxolitinib vorgestellt, welche synergistisch wirken und den Therapieeffekt dadurch verbessern sollen.
Navitoclax hemmt BCL-2 und BCL-xL, die als Regulatoren des apoptotischen Zelltods auch bei anderen hämatologischen Neoplasien therapeutische Targets darstellen. In präklinischen Studien konnte mit der Kombination von Ruxolitinib und Navitoclax vermehrt die Apoptose des MPN-Klons induziert werden.11,12
In der Phase-II-Studie REFINE zu Ruxolitinib/Navitoclax bei 32 MF-Patienten wurden positive Behandlungseffekte auf die Splenomegalie wie auch auf die Knochenmarkfibrose und die MPN-Klongrösse nachgewiesen.13 Auch Patienten mit prognostisch ungünstigem Mutationsprofil wie z.B. ASXL1-Mutation zeigten ein ermutigendes Ansprechen bezüglich Splenomegalie und «variant allele frequency» (VAF) als Marker der MPN-Klongrösse.
Mit Pelabresib wurde ein BET1/2-Inhibitor in der Phase-II-Studie MANIFEST untersucht. Pelabresib führt zu einer Down-Regulation der Expression verschiedener für die Pathogenese der MPN wichtiger Gene, v.a. NFkB.14 Im Erstlinien-Setting konnte die Kombinationstherapie von Ruxolitinib und Pelabresib bei 84 MF-Patienten neben einer Reduktion von Splenomegalie und Symptomlast auch eine Abnahme des Fibrosegrades sowie der MPN-Klongrösse nach 24 Wochen nachweisen.15
Auch der PI3K-Inhibitor Parsaclisib (Phase-II-Studie mit 74 Patienten) und der HDM2-Inhibitor Siremadlin (Phase-I/II- Studie mit 21 Patienten) konnten jeweils in Kombination mit Ruxolitinib bei MF-Patienten positive Effekte in Bezug auf Milzgrösse und Symptomlast zeigen.16,17
Neue therapeutische Targets beiMPN
Inhibitoren verschiedener neuer molekularer Targets werden auf ihr therapeutisches Potenzial als Monotherapien in Abwesenheit eines JAK2-Inhibitors untersucht. Dazu gehört Bomedemstat, ein Inhibitor von LSD1, einem epigenetischen Regulator der hämatopoetischen Differenzierung.19,20 Im Update einer Phase-II- Studie zu Bomedemstat bei 73 vorbehandelten Patienten mit essenzieller Thrombozythämie (ET) konnte ein Ansprechen bezüglich Thrombozytenzahl, Symptomlast, aber auch der VAF bei guter Verträglichkeit gezeigt werden.21
PIM1, ein Proto-Onkogen, das über JAK/STAT reguliert wird und eine wichtige Rolle in der Zytokin-mediierten Signaltransduktion und Regulation von Transkriptionsfaktoren spielt, wurde als weiteres therapeutisches Target bei MF in einer klinischen Phase-I/II-Studie vorgestellt.22 Für TP-3654, einen oralen PIM1-Inhibitor, wurden Phase-I-Daten bei 9 Patienten mit rezidivierter/refraktärer MF gezeigt. Neben guter Verträglichkeit bestätigten die präliminären Resultate zur Effektivität die präklinisch beobachteten positiven Wirkungen auf Milzgrösse, Symptomlast und Zytokinaktivität.23 Aus der präklinischen Forschung wurde zusätzlich die duale Inhibition des neuen Targets PPM1D in Kombination mit HDM2 als neuer Therapieansatz präsentiert. HDM2 und PPM1D stellen beide Regulatoren des TP53-Signalweges dar und sind in MPN-Stammzellen hochreguliert.18,24 Die kombinierte Inhibition führte zu einer signifikant stärkeren Wirkung im Vergleich zur alleinigen Inhibition von HDM2 oder PPM1D und konnte bei Stammzellkulturen von MF-Patienten eine Depletion der JAK2-positiven MF-Progenitorzellen erreichen, mit Erhalt oder sogar Anstieg der gesunden JAK2-Wildtyp-Fraktion.25
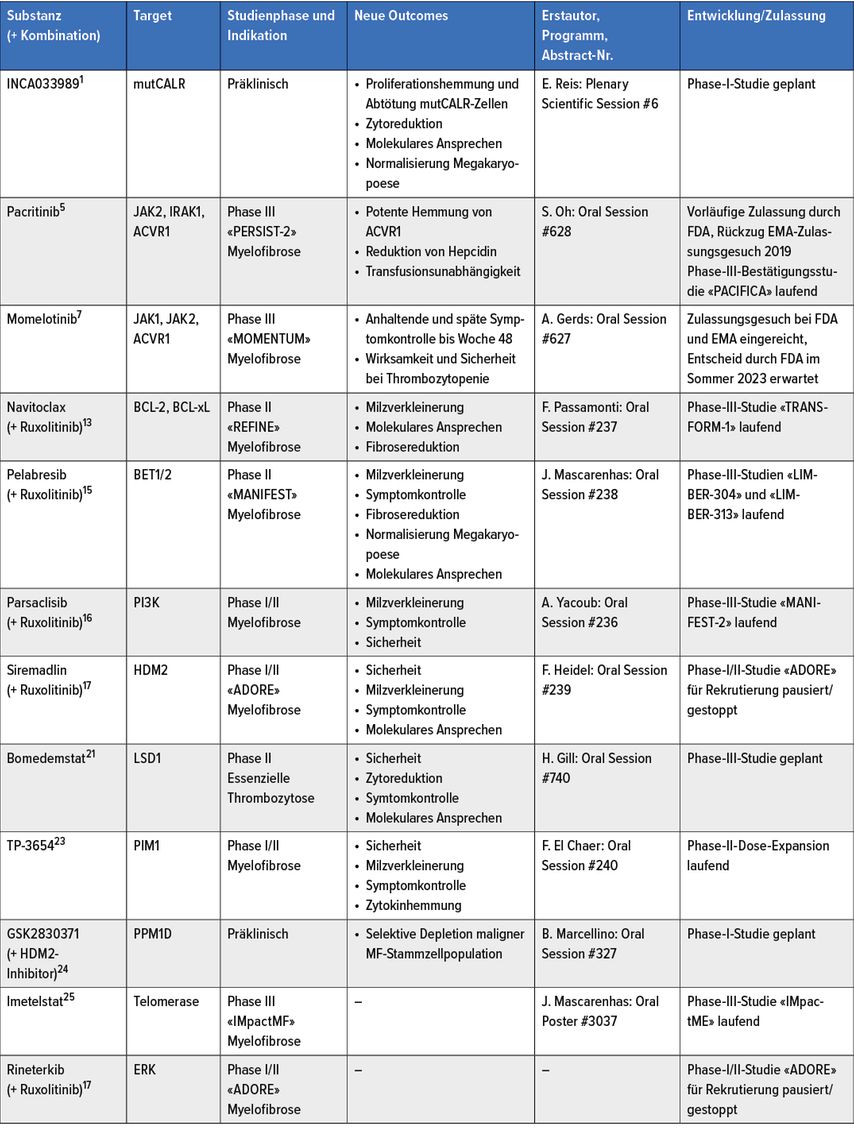
Eine Übersicht über neue therapeutische Ziele und Ansätze für Patientinnen und Patienten mit MPN findet sich in Abb.1 und Tab. 1.
Abb. 1: Übersicht über neue zielgerichtete Therapien und ihre molekularen Targets
Tab. 1: Auswahl neuer therapeutischer Ansätze für myeloproliferative Neoplasien gemäss Vorstellung am ASH-Jahreskongress 2022
Conflicts of interest: SCM has consulted for and received honoraria from Celgene/BMS and Novartis. ML does not have relevant conflicts of interest to declare.
Literatur:
1 Reis E et al.: Blood 2022; 140(Suppl_1): 14-5 2 Pronier E et al.: JCI Insight 2018; 3(22) 3 Mascarenhas J et al.: JAMA Oncol 2018; 4(5): 652-9 4 Sangkhae V, Nemeth E: Adv Nutr 2017; 8(1): 126-36 5 Oh ST et al.: Blood 2022; 140(Suppl_ 1): 1518-21 6 Verstovsek S et al.: EHA 2022; Abstr. #S195 7 Gerds AT et al.: Blood 2022; 140(Suppl_1): 1514-7 8 Kiladjian JJ et al.: Blood 2022; 140(Suppl_1): 577-8 9 Barbui T et al.: Blood 2022; 140(Suppl_1): 1797-9 10 Gill H et al.: Blood 2022; 140(Suppl_1): 1522 11 Waibel M et al.: Cell Rep 2013; 5(4): 1047-59 12 Guo J et al.: PLoS One 2015; 10(3): e0114363 13 Passamonti F et al.: Blood 2022; 140(Suppl_1): 583-5 14 Kleppe M et al.: Cancer Cell 2018; 33(1): 29-43 e7 15 Mascarenhas J et al.: Blood 2022; 140(Suppl_1): 586-9 16 Yacoub A et al.: Blood 2022; 140(Suppl_1): 579-82 17 Heidel FH et al.: Blood 2022; 140(Suppl_1): 590-3 18 Nakatake M et al.: Oncogene 2012; 31(10): 1323-33 19 Harris WJ et al.: Cancer Cell 2012; 21(4):473-87 20 Jutzi JS et al.: Hemasphere 2018; 2(3): e54 21 Gill H et al.: Blood 2022; 140(Suppl_1): 1784-7 22 Tursynbay Y et al.: Biomed Rep 2016; 4(2): 140-6 23 El Chaer F et al.: Blood 2022; 140(Suppl_1): 594-5 24 Marcellino B et al.: Blood 2022; 140(Suppl_1): 797-8 25 Mascarenhas J et al.: Blood 2022; 140(Suppl_1): 6826-9
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...