Erkenntnisse aus Grundlagenforschung und klinischer Praxis
Bericht:
Dr. Judith Moser
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Unter dem Motto „Building Bridges in Coagulation“ fand vom 27. Februar bis 1. März 2024 die 68. Jahrestagung der Gesellschaft für Thrombose und Hämostaseforschung inWien statt. Unter anderem wurden neue Daten zur Pathophysiologie und Therapie zytopenischer Erkrankungen sowie zum Zusammenhang zwischen Krebstherapie und Thromboseneigung diskutiert.
Klonale Hämatopoese als kardiovaskulärer Risikofaktor
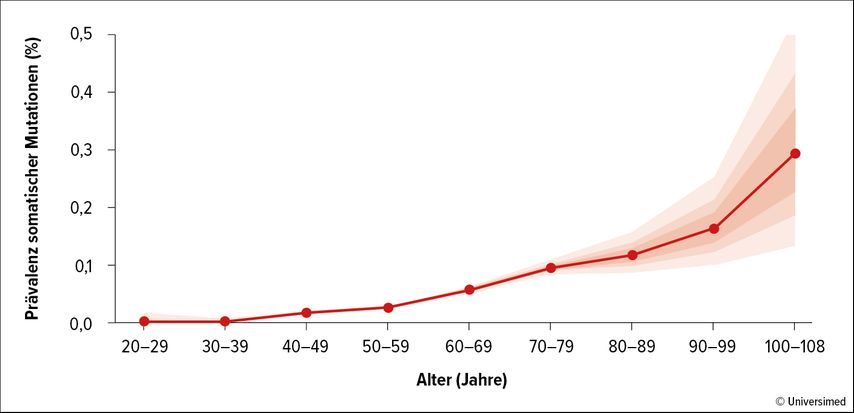
Mit fortschreitendem Lebensalter geht eine Akkumulation somatischer Mutationen in hämatopoetischen Stamm- bzw. Vorläuferzellen einher. Ab dem Alter von ca. 40 Jahren steigt die Mutationsprävalenz immer steiler an (Abb. 1).1 Die klonale Expansion mutierter Zellen hat eine klonale Hämatopoese (CH) zur Folge.2
Abb. 1: Prävalenz somatischer Mutationen in Abhängigkeit vom Lebensalter (modifiziert nach Jaiswal S et al.)1
Prof. Dr. José J. Fuster (Whitaker Cardiovascular Institute, Boston University School of Medicine, USA) wies in der Keynote Lecture der GTH-Jahrestagung auf die Konsequenzen der durch somatische Mutationen angetriebenen CH hin. Das Risiko für die Entwicklung hämatologischer Malignome steigt dadurch um das Zehnfache an, jedoch besteht auch eine Assoziation mit atherosklerotisch bedingten vaskulären Komplikationen.3 In der Gegenwart von somatischen Mutationen ist die Inzidenz der koronaren Herzerkrankung um den Faktor 2 erhöht, jene ischämischer Insulte um den Faktor 2,6.1 Diese Korrelation wurde unabhängig von Alter, Geschlecht und traditionellen kardiovaskulären Risikofaktoren festgestellt. Ebenso erbrachte „whole exome sequencing“ bei mehr als 50000 Personen eine Assoziation von CHIP („clonal hematopoiesis of indeterminate potential“) mit der Entstehung einer peripheren arteriellen Verschlusserkrankung.4 Definitive Erkenntnisse zur zeitlichen Abfolge der Veränderungen fehlen allerdings noch, da die epidemiologischen Daten keine Rückschlüsse auf die Kausalität erlauben.
PESA
Um die Direktionalität der Assoziation zwischen CH und Atherosklerose zu klären, wurde bereits im Jahr 2010 das PESA(Progression of Early Subclinical Atherosclerosis)-Projekt initiiert. Rund 4200 Personen ohne klinisch manifeste kardiovaskuläre Erkrankungen gingen im Alter von 40–54 Jahren in diese Langzeitstudie ein.
Mehr als 4000 Parameter werden im Zusammenhang mit kardiometabolischen Risikofaktoren, Lebensstil, hämatologischen und inflammatorischen Markern sowie Leukozyten-Telomerlänge erfasst. Gleichzeitig erfolgt eine umfangreiche genetische Testung (Genomics, Transcriptomics, Proteomics, Metabolomics, Methylomics) sowie Bildgebung (vaskuläre Sonografie, Computertomografie, 18F-FDG-PET/MRI) zwecks Erfassung von Gefäßveränderungen, Fibrose und Entzündung.
Wie Fuster berichtete, sind ca. 25% der gesunden Personen im mittleren Lebensalter bereits Träger:innen detektierbarer CH-Mutationen, wobei DNMT3A-Mutationen dominierten.5 Den bisherigen Ergebnissen zufolge beeinflusst die CH die Atherosklerose, nicht jedoch umgekehrt. De-novo-Atherosklerose in den Femoralarterien korrelierte signifikant mit CHIP-Mutationen mit höherer Varianten-Allelfrequenz sowie DNMT3A-, TET2- und anderen Mutationen. Dagegen fand sich kein Effekt einer subklinischen Atherosklerose auf die CH-Dynamik.
Insgesamt scheint die durch bestimmte Mutationen bedingte CH ein neuer pathogener Mechanismus für atherosklerotische und andere Erkrankungen zu sein. Weiterführende Untersuchungen könnten eine Rationale für personalisierte Therapien oder Präventionsstrategien liefern, die auf den Effekt spezifischer somatischer Mutationen zugeschnitten sind.
Thrombosen unter onkologischer Therapie: CAT-BLED
Im Vergleich zur gesunden Population zeigen Krebspatient:innen ein gesteigertes Thromboserisiko, wobei venöse Thromboembolien (VTE) um den Faktor 7–9 erhöht sind und arterielle Thromboembolien (ATE) um den Faktor 2–3.6–8 Als Risikofaktoren für eine krebsassoziierte VTE konnten unter anderem platinbasierte Chemotherapien, Antiangiogenese und endokrine Therapien identifiziert werden.9
Im Fokus der an der Medizinischen Universität Wien durchgeführten prospektiven Beobachtungsstudie CAT-BLED (Vienna Cancer, Thrombosis and Bleeding Study) stand die VTE- und ATE-Inzidenz bei 880 Krebspatient:innen, die eine systemische onkologische Therapie starteten.10 Bei 48,5% wurde eine Chemotherapie verabreicht, bei 16,7% Kombinationen aus Chemotherapie und Immuncheckpoint-Inhibition (ICI), bei 15,7% eine alleinige ICI sowie bei 12,4% Kombinationen aus Chemo- und zielgerichteter Therapie (TT). TT-Monotherapien gelangten bei 5,0% zum Einsatz und Kombinationen aus TT und ICI bei 1,7%. Eine metastasierte Erkrankung lag bei 62,6% vor.
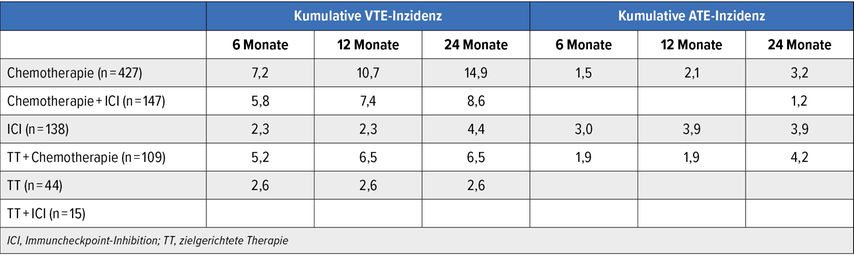
Sowohl die VTE- als auch die ATE-Inzidenz waren in der Studie wie erwartet hoch: Nach zwölf Monaten betrug die kumulative Inzidenz 7,6% bzw. 1,9%. Dabei zeigte sich eine Assoziation mit der Art der Behandlung. Die höchsten VTE-Inzidenzen resultierten unter Chemotherapien; in Bezug auf ATE war dies unter ICI sowie TT plus Chemotherapie der Fall (Tab. 1). Keine Ereignisse traten unter TT plus ICI auf, allerdings handelte es sich hierbei um die kleinste Gruppe. Laut multivariabler Analyse ging ICI mit einem niedrigeren VTE-Risiko als die anderen Therapien einher (HR: 0,60; nicht signifikant), die Chemotherapie dagegen mit einem höheren Risiko (HR: 2,46). Dieselbe Korrelation fand sich für ATE mit HR-Werten von 0,52 bzw. 1,17 (beide nicht signifikant).
Tab. 1: Inzidenz venöser (VTE) und arterieller Thromboembolien (ATE) unter verschiedenen Krebstherapien (modifiziert nach Englisch C et al.)10
Die Autor:innen zogen den Schluss, dass das individuelle Thromboserisiko durch die Krebstherapie beeinflusst wird. Randomisierte kontrollierte Studien oder populationsbasiertes Matching wären notwendig, um den Einfluss bestimmter Therapien besser zu charakterisieren. Gegenwärtig kann das spezifische Risiko nur in Patient:innensubgruppen abgeschätzt werden.
Geänderte t-PA/PAI-1-Balance bei ITP
Der primären Immunthrombozytopenie (ITP) liegt eine Autoimmunreaktion gegen Thrombozyten und Megakaryozyten zugrunde, die zu einer Reduktion der Plättchenzahlen auf <100x109/l führt. Klinisch findet sich neben der gesteigerten Blutungsneigung auch eine Erhöhung des thromboembolischen Risikos. Zur Fibrinolyse bei ITP liegen bisher nur limitierte und kontroversielle Daten vor.
Unter der Annahme, dass der prothrombotische Zustand bei primärer ITP durch eine herabgesetzte fibrinolytische Kapazität verstärkt wird, untersuchte eine multizentrische prospektive Kohortenstudie die Entstehung und Auflösung von Gerinnseln, Plasminbildung sowie fibrinolytische Parameter bei 86 erwachsenen Patient:innen mit primärer ITP aus der Wiener ITP-Biobank. 43% erhielten eine spezifische Therapie, die überwiegend aus Kortikosteroiden und TPO-Rezeptor-Agonisten bestand. 10,6% hatten zuvor bereits eine Thrombose erlitten. Der Vergleich erfolgte mit 78 gesunden Kontrollpersonen aus der Vienna Bleeding Study. Schramm et al. präsentierten die Resultate bei der GTH-Jahrestagung 2024.11 In der Gruppe mit ITP entwickelten sechs Personen Thrombosen, von denen jeweils drei arteriell bzw. venös waren. Verglichen mit den gesunden Kontrollen zeigten die ITP-Patient:innen eine verzögerte Gerinnsel- und Plasminbildung, eine gesteigerte maximale Gerinnselabsorption, erhöhte Aktivität des Plasminogen-Aktivator-Inhibitors Typ 1 (PAI-1) und verringerte Aktivität des gewebespezifischen Plasminogen-Aktivators (t-PA). Die t-PA/PAI-1-Komplexspiegel waren in der gesamten ITP-Gruppe mit der Gerinnselauflösungszeit assoziiert und in der Subgruppe, die Thrombosen erlitt, erhöht.
Wie die Autor:innen betonten, wird in Komplexen gebundenes t-PA langsamer abgebaut als aktives t-PA. Neben der chronischen Aktivierung endothelialer Zellen dürften die kontinuierliche Aktivierung und Dysfunktion der Plättchen zu thrombotischen Komplikationen beitragen.
TTP: Benefits durch Prophylaxe inder Schwangerschaft
Seit der Erstbeschreibung der seltenen, aber lebensbedrohlichen thrombotisch-thrombozytopenischen Purpura (TTP) im Jahr 1924 hat die Aufschlüsselung der Pathophysiologie neue diagnostische und therapeutische Zugänge ermöglicht. Das Bild der Erkrankung umfasst schwere Thrombozytopenie, hämolytische Anämie, disseminierte mikrovaskuläre Thrombosen und Organischämie mit Schäden unterschiedlicher Ausprägung.
Anfang der 2000er-Jahre wurde eine Akkumulation großer Multimere des Von-Willebrand-Faktors (vWF) infolge des Fehlens oder der Inaktivierung der vWF-spaltenden Metalloprotease ADAMTS13 als zentraler Pathomechanismus identifiziert.12 ADAMTS13-Antikörper bedingen die immunmediierte erworbene Form der TTP (iTTP), Mutationen im ADAMTS13-Gen dagegen die kongenitale Variante (cTTP).13,14
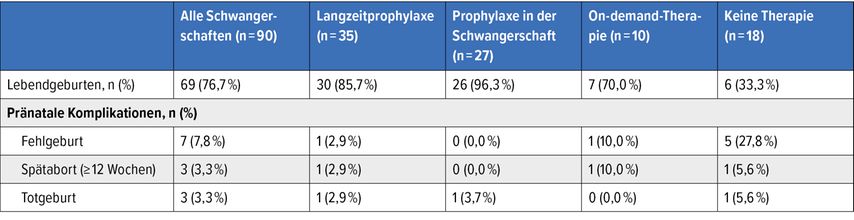
Schraner et al. stellten am GTH-Kongress ihre Beobachtungsstudie zu den klinischen Ergebnissen bei Schwangeren mit cTTP vor.15 Auf der Basis internationaler Registerdaten wurden Patient:innen erfasst, die zum Teil schon vor dem Bekanntwerden ihrer cTTP-Erkrankung und zum Teil erst danach schwanger geworden waren. Plasmainfusionen stellen die Therapie der Wahl dar, wobei die Richtlinien eine prophylaktische Behandlung während der Schwangerschaft empfehlen.16 Wie sich zeigte, verbesserte die Plasmaprophylaxe die mütterliche Morbidität und erhöhte die Rate an Lebendgeburten erheblich (Tab. 2). Trotz des bei cTTP gesteigerten Präeklampsierisikos war die Verschreibungsrate in Bezug auf Acetylsalicylsäure (ASS) im Register niedrig.
Tab. 2: Schwangere mit TTP: Outcomes je nach Behandlungsstrategie (modifiziert nach Schraner M et al.)15
Die Autor:innen empfehlen Awareness sowie eine zeitgerechte Prophylaxe und Verordnung von ASS, um das Management schwangerer Patient:innen mit cTTP zu verbessern.
Auf dem Weg zur TPE-freien Behandlung
Nachdem der therapeutische Plasmaaustausch (TPE) längere Zeit als einzige Behandlungsmaßnahme bei TTP gegolten hatte, konnte im neuen Jahrtausend ein Paradigmenwechsel herbeigeführt werden. Bei iTTP wurde der gegen die A1-Domäne des vWF gerichtete Nanobody Caplacizumab in Verbindung mit einer Immunsuppression verfügbar; bei cTTP kommen Plasmainfusionen ohne Immunsuppression zum Einsatz.17
Einen weiteren Schritt stellt das rekombinante ADAMTS13-Konzentrat dar, das in den USA bereits für die Therapie der cTTP zugelassen ist. Nach einer raschen Diagnosestellung lassen sich akute TTP-Schübe mit den aktuellen Strategien mittlerweile effektiv kontrollieren; die Herausforderung besteht nun primär darin, anhaltende ADAMTS13-Remissionen zu erreichen, um Rezidive zu verhindern.
Aktuelle Studien evaluieren ein therapeutisches Vorgehen ohne den mit Risiken behafteten TPE. Zu diesem Thema präsentierten Kühne et al. eine retrospektive Kohortenstudie auf der Basis des Austrian Thrombotic Microangiopathy Registry und des German REACT-2020 TTP Registry.18 Die Analyse verglich die Ergebnisse bei iTTP-Patienten, die mit TPE (59 Episoden) oder ohne TPE (42 Episoden) behandelt worden waren. Tatsächlich erwies sich Caplacizumab+Immunsuppression alleine als effektive und sichere Strategie, mit der ein klinisches Ansprechen und ADAMTS13-Remissionen erreicht werden konnten.
Gegenüber der TPE-behandelten Gruppe resultierte eine vergleichbare Zeitspanne bis zur Normalisierung der Plättchenzahlen (3 vs. 4 Tage). Auch hinsichtlich sekundärer Endpunkte wie der Anzahl der Episoden mit einem klinischen Ansprechen und des Anteils der refraktären Patient:innen unterschieden sich die Gruppen nicht.
Allerdings setzt der Verzicht auf den TPE günstige Rahmenbedingungen voraus, zu denen kurze Turn-around-Zeiten für die ADAMTS13-Testung, die Verfügbarkeit von Caplacizumab vor Ort sowie optimale Kommunikationsstrukturen zählen. Zudem sollten Kontrollen des gesamten Blutbilds innerhalb von Stunden nach der ersten Caplacizumab-Gabe sowie ein laufendes Monitoring im Hinblick auf die Notwendigkeit eines zusätzlichen TPE gewährleistet sein.
Quelle:
Jahrestagung der Gesellschaft für Thrombose und Hämostaseforschung (GTH), 27.2. bis 1.3.2024, Wien
Literatur:
1 Jaiswal S et al.: Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med 2014; 371(26): 2488-98 2 Fuster JJ, Walsh K: Somatic mutations and clonal hematopoiesis: unexpected potential new drivers of age-related cardiovascular disease. Circ Res 2018; 122(3): 523-32 3 Genovese G et al.: Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. New Engl J Med 2014; 371(26): 2477-87 4 Zekawat SM et al.: TP53- mediated clonal hematopoiesis confers increased risk for incident atherosclerotic disease. Nat Cardiovasc Res 2023; 2: 144-58 5 Unveröffentlichte Daten 6 Mulder FI et al: Venous thromboembolism in cancer patients: a population-based cohort study. Blood 2021; 137(14): 1959-69 7 Grilz E et al: Relative risk of arterial and venous thromboembolism in persons with cancer vs. persons without cancer-a nationwide analysis. Eur Heart J 2021; 42(23): 2299-307 8 Mulder FI et al: Arterial thromboembolism in cancer patients: a danish population-based cohort study. JACC CardioOncol 2021; 3(2): 205-18 9 Ay C et al.: Cancer-associated venous thromboembolism: burden, mechanisms, and management. Thromb Haemost 2017; 117(2): 219-30 10 Englisch C et al.: GTH 2024; Abstr. #SOA-02-OC-04 11 Schramm T et al.: GTH 2024; Abstr. #SOA-09-OC-03 12 Fujikawa K et al.: Purification of human von Willebrand factor-cleaving protease and its identification as a new member of the metalloproteinase family. Blood 2001; 98(6): 1662-6 13 Tsai HM, Lian EC: Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura. N Engl J Med 1998; 339(22): 1585-94 14 Levy GG et al: Mutations in a member of the ADAMTS gene family cause thrombotic thrombocytopenic purpura. Nature 2001; 413(6855): 488-94 15 Schraner M et al.: GTH 2024; Abstr. #SOA-03-OC-06 16 Zheng XL et al.: ISTH guidelines for the diagnosis of thrombotic thrombocytopenic purpura. J Thromb Haemost 2020; 18(10): 2486-95 17 Sukumar S et al.: Thrombotic thrombocytopenic purpura: pathophysiology, diagnosis, and management. J Clin Med 2021; 10: 536 18 Kühne L et al: GTH 2024; Abstr. #SOA-03-OC-04
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...