Aktuelle Entwicklungen bei Tumorerkrankungen der Hämatopoese und des ZNS
Bericht:
Mag. Ruth Streibl, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Am diesjährigen «Swiss Oncology and Hematology Congress» in Basel gab es zahlreiche spannende Vorträge aus den verschiedenen Disziplinen zu hören. Hier haben wir eine Zusammenfassung der aktuellen Datenlage und der Behandlungsstrategien aus der Hämatoonkologie und von Tumoren des Zentralnervensystems zusammengestellt. Gen- und Immuntherapien wie CAR-T-Zellen und BiTE stehen dabei im Vordergrund und zeigen vielversprechende Ergebnisse mit Optimierungsbedarf.
Keypoints
-
CAR-T-Zell-Therapieerfolge bei der B-ALL sind abhängig von verschiedenen Faktoren wie Krankheitslast, MRD-Status und Vortherapien; die hohe Rezidivrate bleibt ein Problem.
-
Signifikante Überlebensverlängerungen zeigen BiTE- und CAR-T-Zell-Therapien beim r/r multiplen Myelom.
-
Bei CAR-T-Zell-Therapien bei soliden Tumoren wie GBM spielen Tumormikroumgebung und Tumorheterogenität eine Rolle – Kombinationstherapien zeigen erste Erfolge.
-
Intraokuläre Metastasen sind ein therapeutischer Notfall und adjuvante Therapien werden dringend benötigt.
Erfolge und Herausforderungen vonCAR-T- und BiTE-Therapien bei B-ALL und beim multiplen Myelom
Prof. Dr. med. Claudia Baldus berichtete über CAR-T(chimärer Antigenrezeptor-T)-Zell-Therapien bei der refraktären oder rezidivierten (r/r) adulten B-ALL (akute lymphatische Leukämie). Denn trotz Wirkstoffen wie Blinatumomab oder Inotuzumab konnte die Gesamtüberlebensdauer von Patient:innen mit Philadelphia-Chromosom-negativer (Ph–) r/r ALL von 5,8 nur auf 7,7 Monate verlängert werden.1
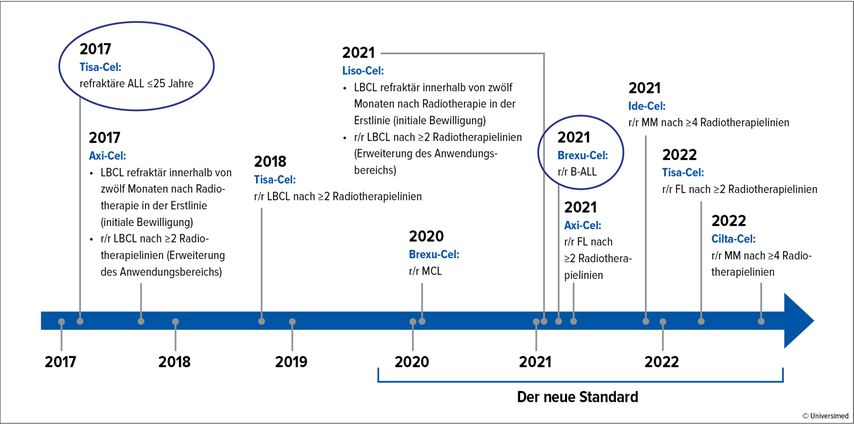
Als CAR-T-Immuntherapie für adulte Patient:innen mit r/r B-ALL ist nun Brexu-Cel (Brexucabtagen-Autoleucel) seit 2021 von der FDA zugelassen (Abb. 1). In ZUMA-3, der Phase-II-Zulassungsstudie mit 55 eingeschlossenen Patient:innen, konnten eine deutliche Verlängerung des medianen Gesamtüberlebens auf 18,2 Monate und eine komplette Remission (CR) bei 71% gezeigt werden; die Toxizität ist hoch, aber vertretbar.2
Abb. 1: CAR-T-Zell-Therapiezulassungen (FDA). Modifiziert nach «Mayo Foundation for medical education and research»
In einem Update der Studie wurde nun der Einfluss von Vortherapien auf den Erfolg der CAR-T-Zell-Therapie evaluiert. Patient:innen, die davor mit Blinatumomab oder Inotuzumab behandelt wurden, hatten eine geringere Rate an kompletter Remission (63% vs. 83%; 59% vs. 77%); eine vorangegangene Stammzelltransplantation (SZT) führte hingegen nicht zu einem signifikanten Unterschied (76% vs. 71%).3 Das grösste Problem der Therapie bleibt jedoch die hohe Rezidivrate von ≈40%.4
Wodurch kann das CAR-T-Zell-Therapieansprechen prognostiziert werden?
Studien in einer jüngeren Population (7–17 Jahre) zeigten, dass Patient:innen mit niedriger Krankheitslast stärker von einer CAR-T-Zell-Therapie profitieren. Eine vorangehende Blinatumomab-Therapie hingegen führte auch hier zu einem geringeren Nutzen einer darauffolgenden CAR-T-Zell-Therapie – vermutlich durch den Verlust des Zielmoleküls CD19.5
Ein frühes Rezidiv (<6 Monaten) nach einer Stammzelltherapie, das mit aggressiver Leukämie und schwachem Immunsystem assoziiert ist, führte ebenfalls zu einem geringeren Therapieerfolg.6 MRD(minimale Resterkrankung)-negative Patient:innen nach einer CAR-T-Zell-Therapie zeigten sehr gute Ergebnisse.
Ein Monitoring der MRD sowie der B-Zell-Aplasie erweist sich vor allem in Kombination als wichtiger Prognosemarker für die Rezidivrate.7 Abschliessend stellt sich die Frage, ob CAR-T-Zellen als Stand-alone-Therapie infrage kommen oder ob sie eher zur Überbrückung vor einer Stammzelltherapie geeignet sind. Laut Prof. Baldus hängt das stark vom Setting ab.
Die Erfolge der CAR-T-Zell-Therapien sind mittlerweile beachtlich, bei Hochrisikopatient:innen bleibt eine anschliessende SZT aber vermutlich unumgänglich.
Aktuelle Studienlage zu BiTE- und CAR-T-Zell-Therapien beim multiplen Myelom
Patient:innen mit r/r multiplem Myelom (r/r MM) haben eine schlechte Prognose und nur begrenzte Behandlungsmöglichkeiten nach der Therapie mit einem Immunmodulator, einem Proteasom-Inhibitor (PI) und einem Anti-CD38-Antikörper (=«triple class exposed»).
Dr. med. Rouven Müller gab Einblick in die neuen Therapieoptionen mit den bispezifischen Antikörpern BiTE («bi-specific T-cell engager») und mit CAR-T-Zellen. In den Phase-I/II-Studien MajesTEC wurde die stark vorbehandelte Patient:innenpopulation mit dem gegen BCMA («B-cell maturation antigen») gerichteten bispezifischen monoklonalen Antikörper Teclistamab behandelt.
Die Ergebnisse sind vielversprechend, mit einer objektiven Ansprechrate von 63%, einer CR von 45,5% und einem medianen progressionsfreien Überleben (PFS) von 11,3 Monaten. Ein grosses Problem der Therapien ist die hohe Toxizität, die sich vor allem in Zytopenien, Infektionen und dem Zytokinfreisetzungssyndrom (CRS) äussert.8
In der MonumenTAL-1-Studie führte der bispezifische Antikörper Talquetamab, mit GPRC5D («G protein-coupled receptor class C group 5 member D») als Zielmolekül, bei Patient:innen mit r/r MM zu einem deutlichen Ansprechen (bei 70% bei wöchentlicher Gabe). CRS, Hauttoxizität und Dysgeusie traten hier häufig auf.9 Eine Subgruppe, die vor der Therapie bereits mit Anti-BCMA-Immuntherapie behandelt wurde, hatte ebenfalls eine Ansprechrate von über 60%.10
Bei den CAR-T-Ansätzen konnte in der Phase-III-Studie KarMMa-3 gezeigt werden, dass das gegen BCMA gerichtete Ide-Cel (Idecabtagen-Vicleucel) das progressionsfreie Überleben bei 386 stark vorbehandelten Patient:innen mit r/r MM signifikant verlängert (13,3 vs. 4,4 Monate in der Standardregime-Gruppe; Abb. 2).11 Auch Cilta-Cel (Ciltacabtagen-Autoleucel), ebenfalls mit BCMA als Zielmolekül, zeigte im finalen 3-Jahres-Follow-up der CARTITUDE-1-Studie sehr ermutigende Ergebnisse mit einem PFS von 34,9 Monaten und einem nach über drei Jahren noch nicht erreichten medianen Gesamtüberleben.12
Abb. 2: Medianes progressionsfreies Überleben (mPFS) mit Ida-Cel beim r/r multiplen Myelom in der Phase-III-Studie KarMMa-3. Modifiziert nach Rodriguez-Otero P et al.11
Was sind die Vor- und Nachteile von CAR-T vs. BiTE?
Beide Ansätze zeigen sehr ermutigende Ansprechraten. CAR-T-Zell-Therapie erfordert eine einmalige Gabe, mit Verzögerung durch den individuellen Herstellungsprozess und oft schwerwiegenden Nebenwirkungen (CRS/ICANS [Immuneffektorzell-assoziiertes Neurotoxizitätssyndrom]). Bispezifische Antikörper (BiTE) sind eine Therapie «von der Stange» mit regelmässiger Administration bis zum Progress. Es kommt zu einer signifikanten Immunsuppression und Nebenwirkungen (CRS/ICANS) sind möglich. Die nötige komplexe Infrastruktur und die hohen Kosten sind bei den Therapien generell problematisch.13
CAR-T-Zell-Therapien bei soliden Tumoren
Über die Therapiefortschritte beim malignen Gliom (GBM) berichtete Prof. Dr. med. Denis Migliorini. Die bekannten CAR-T-Zielmoleküle im malignen Gliom sind IL13Rα2, HER2 und EGFRvIII. Aufgrund von «tumor escape», genetischer Heterogenität im Tumor und einer immunsuppressiven Tumormikroumgebung gibt es aber Bedarf an neuen Zielmolekülen oder multivalenten CAR-T-Zell-Therapien.14 Um möglichst effiziente Therapien zu erhalten, wird nun versucht, verschiedene Strategien zu kombinieren: multispezifische CAR-T-Zellen, eine Kombination von CAR-T-Zellen mit Immuncheckpoint-Inhibitoren oder mit genetisch veränderten dendritischen Vorläuferzellen (DCP). Bivalente CAR-T-Zellen könnten die Herausforderung der hohen Tumorheterogenität besser meistern als monovalente Ansätze, indem sie die Population der zielpositiven Tumorzellen vergrössern.
In einer Phase-I-Dosis-Eskalationsstudie (CTIM40) werden CAR-T-Zellen, die sowohl auf EGFR als auch auf IL13Rα2 abzielen, bei Patient:innen mit EGFR-amplifiziertem rezidiviertem GBM untersucht. Bei den drei bisher untersuchten Patient:innen schrumpfte damit der Tumor im MRT; die Behandlung zeigt vielversprechende erste Ergebnisse.15 Auch die Kombination mit Immuncheckpoint-Inhibitoren wird bereits getestet, da die EGFRvIII-CAR-T-Zell-Therapie in Phase-I-Studien nach wie vor Krankheitsprogress zeigt und eine vermehrte PD-L1-Expression aufweist.16
In einer Phase-I-Studie mit sieben Patient:innen mit neu diagnostiziertem MGMT-unmethyliertem Glioblastom wurden nun EGFRvIII-CAR-T-Zellen in Kombination mit Pembrolizumab (PD-1-Inhibitor) getestet. Einzelzellanalysen zeigten nach der Behandlung vermehrt Makrophagen und reduzierte T-Zell-Werte.17
Eine weitere Kombinationstherapie besteht aus veränderten dendritischen Vorläuferzellen (DCP), die FLT3L und IL-12 produzieren. Die mit immunstimulierenden Zytokinen bewaffneten DCP differenzieren in Typ-I-DC (cDC1) und unterdrücken das Tumorwachstum. In Kombination mit gegen GD2 gerichteten CAR-T-Zellen wurde in einem Tumor-Maus-Modell das Überleben signifikant verlängert.18 Diese neuen Daten verdeutlichen das Potenzial von Kombinationstherapien bei soliden Tumoren.
Okuläre Malignome – verschiedene Arten und ihre Behandlung
Dr. med. Ann Schalenbourg präsentierte die Besonderheiten bei der Behandlung verschiedener okulärer Malignome.
Das konjunktivale Melanom ist sehr selten und gehört zu den kutanen Melanomen. Die konservative Behandlung besteht aus chirurgischer Entfernung des Tumors gefolgt von Radiotherapie, Kryotherapie oder topischer Chemotherapie. Beim etwas häufigeren uvealen Melanom bringt Protonentherapie die besten Ergebnisse.
Das 10-Jahres-Metastasenrisiko beträgt rund 30%, abhängig von Risikofaktoren (wie dem Verlust der BAP1-Expression). Bis vor Kurzem gab es für Melanommetastasen keine Behandlung, mit dem BiTE-Antikörper Tebentafusp gibt es nun aber erstaunliche Überlebensverlängerungen.19 Das Fehlen adjuvanter Therapiemöglichkeiten sowie das Streuungsrisiko bei Biopsien bleibt aber weiterhin problematisch.
Bei den sehr seltenen okulären Lymphomen gibt es zwei Typen. Primäre intraokuläre (vitreoretinale) Lymphome (PIOL) sind schwer zu diagnostizieren, gehören zu den ZNS-Lymphomen und sind meist DLBCL-Typ-Tumoren. Das extrem seltene primäre Uveallymphom gehört zu den systemischen B-Zell-Lymphomen. Eine Radiotherapie ist in 90% der Fälle erfolgreich. Die meisten Uveallymphome stammen aus der Marginalzone und haben generell eine bessere Prognose.
Intraokuläre Metastasen – ein therapeutischer Notfall
Eine dritte Gruppe der okulären Malignome sind intraokuläre Metastasen. Der Primärtumor ist bei Frauen zu 75% ein Mammakarzinom, bei Männern zu 42% ein Bronchialkarzinom.20 Multiple, nicht pigmentierte (selten auch pigmentierte) Läsionen weisen auf Metastasen hin. Da sie meist schnell wachsen und aggressiv sind, das Auge aber relativ klein ist, sind intraokuläre Metastasen immer ein Notfall und müssen schnell behandelt werden, um das Augenlicht nicht zu verlieren.
Wichtig bei der Radiotherapie ist es auch, genau zu lokalisieren, welcher Teil des Auges bestrahlt werden muss – die gute Zusammenarbeit zwischen Onkolog:innen, Ophthalmolog:innen und Radiolog:innen ist für den Erfolg relevant. Die Entwicklung einer adjuvanten Behandlung wäre hier essenziell, um die Prognose für Patient:innen mit Metastasen zu verbessern.
Quelle:
The Swiss Oncology and Hematology Congress 2023, 22.–24. November 2023, Basel
Literatur:
1 Gökburget N et al.: International reference analysis of outcomes in adults with B-precursor Ph-negative relapsed/refractory acute lymphoblastic leukemia. Haematologica 2016; 101(12): 1524-33 2 Shah B et al.: KTE-X19 for relapsed or refractory adult B-cell acute lymphoblastic leukaemia: phase 2 results of the single-arm, open-label, multicentre ZUMA-3 study. Lancet 2021; 398(10299): 491-502 3 Shah B et al.: Impact of prior therapies and subsequent transplantation on outcomes in adult patients with relapsed or refractory B-cell acute lymphoblastic leukemia treated with brexucabtagene autoleucel in ZUMA-3. J Immunother Cancer 2023; 11(8): e007118 4 Grover P et al.: Chimeric antigen receptor T-cell therapy in adults with B-cell acute lymphoblastic leukemia. Blood Adv 2022; 6(5): 1608-18 5 Myers RA et al.: Blinatumomab nonresponse and high-disease burden are associated with inferior outcomes after CD19-CAR for B-ALL. J Clin Oncol 2022; 40(9): 932-44 6 Bader P et al.: CD19 CAR T cells are an effective therapy for posttransplant relapse in patients with B-lineage ALL: real-world data from Germany. Blood Adv 2023; 7(11): 2436-48 7 Pulsipher MA et al.: Next-generation sequencing of minimal residual disease for predicting relapse after tisagenlecleucel in children and young adults with acute lymphoblastic leukemia blood cancer. Discov 2022; 3(1): 66-81 8 Van de Donk NWCJ et al.: Long-term follow-up from MajesTEC-1 of teclistamab, a B-cell maturation antigen (BCMA) x CD3 bispecific antibody, in patients with relapsed/refractory multiple myeloma (RRMM). ASCO 2023; Abstr. #8011 9 Chari A et al.: Talquetamab, a T-cell-redirecting GPRC5D bispecific antibody for multiple myeloma. N Engl J Med 2022; 387(24): 2232-44 10 Touzeau C et al.: Pivotal phase 2 MonumenTAL-1 results of talquetamab (tal), agprc5dxcd3 bispecific antibody (bsab), for relapsed/refractorymultiple myeloma (RRMM). EHA 2023; Abstr. #S191 11 Rodriguez-Otero P et al.: Ide-cel or standard regimens in relapsed and refractory multiple myeloma. Engl J Med 2023; 388(11): 1002-14 12 Munshi N et al.: CARTITUDE-1: Final results of Ciltacabtagene Autoleucel in heavily pretreated patients with relapsed/refractory multiple myeloma. EHA 2023; Abstr. #S202 13 Cipkar C et al.: Hematology Am Soc Hematol Educ Program 2022; 2022(1): 163-72 14 Migliorini D et al.: CAR T-cell therapies in glioblastoma: a first look. Clin Cancer Res 2018; 24(3): 535-40 15 Logun M et al.: CTIM-40. Early radiographic response and engraftment of phase i first-in-human bicistronic car t cells correlate with real-time autologous GBM organoid cytolysis. Neuro-Oncology 2023: 25(Suppl. 5): v72 16 O’Rourke DM et al.: A single dose of peripherally infused EGFRvIII-directed CAR T cells mediates antigen loss and induces adaptive resistance in patients with recurrent glioblastoma. Sci Transl Med 2017; 9(399): eaaa0984 17 Bagley SJ et al.: Phase I study of repeated peripheral infusions of anti-EGFRvIII CAR T cells in combination with pembrolizumab in patients with newly diagnosed, MGMT-unmethylated glioblastoma. 2023. ClinicalTrials.gov ID: NCT03726515 18 Ghasemi A et al: Cytokine-armed dendritic cell progenitors for antigen-agnostic cancer immunotherapy. Nat Cancer 2023 19 Nathan P et al.: Overall survival benefit with tebentafusp in metastatic uveal melanoma. N Engl J Med 2021; 385(13): 1196-206 20 Zografos L: Tumeurs intraoculaires. Paris: Elsevier-masson, 2002
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...