Eingliederung neuer Therapien bei mHSPC & mCRPC
Bericht:
Dr. med. Judith Moser
Autor:
Univ.-Prof. Dr. med. Shahrokh F. Shariat
Universitätsklinik für Urologie, Medizinische Universität Wien
Comprehensive Cancer Center Vienna
Heute ist das Prostatakarzinom ein Beispiel für eine Erkrankung mit hochgradig personalisierter Behandlung und langer Dauer, bei der Optimierungen durch das Drehen an unterschiedlichen Stellschrauben möglich sind. Die Herausforderung besteht darin, «alte» und «neue» Optionen in der multimodalen Behandlungslandschaft zu optimalen Konzepten zusammenzufügen.
Das grundsätzliche Ziel der Therapie des Prostatakarzinoms (PC) ist die möglichst lange Verweildauer im hormonsensitiven Stadium vor dem Eintreten der Kastrationsresistenz. Beim metastasierten hormonsensitiven PC (mHSPC) herrscht mittlerweile kein Zweifel mehr daran, dass die alleinige Androgendeprivationstherapie (ADT) nicht ausreicht. Die Kombination aus ADT mit einem ARPI (Androgenrezeptor-Signalweginhibitor: Abirateron, Enzalutamid, Darolutamid, Apalutamid) gilt laut Advanced Prostate Cancer Consensus Conference 2022 unabhängig von der prognostischen Kategorie als etablierte Backbone-Strategie beim mHSPC.1
Gleichzeitig spielt die Wahl der ADT eine Rolle, wobei es in diesem Bereich an Evidenz mangelt. Meiner Einschätzung nach sollten GnRH-Antagonisten den GnRH-Agonisten vorgezogen werden. Sie weisen Vorteile durch die sofortige Suppression von FSH, LH und Testosteron ohne Microsurges auf und gehen mit einem geringeren Risiko für kardiovaskuläre Ereignisse einher.2 Als besonders für GnRH-Antagonisten geeignet erscheinen Patient:innen mit kardiovaskulären Vorerkrankungen und symptomatischer Tumorlast im Knochenbereich. Metabolische Benefits lassen sich auch durch die Zugabe von Metformin zur Standardtherapie erreichen, wie die im Arm K der STAMPEDE-Studie generierten Ergebnisse nahelegen.3
Kombination als Standardbeim mHSPC
Die Auswahl des ARPI richtet sich primär nach dem Verträglichkeitsprofil. Zuletzt konnten am ESMO-Kongress 2024 mit der randomisierten, doppelblinden PhaseIII-Studie ARANOTE relevante Daten hinsichtlich Effektivität und Sicherheit einer ARPI-Therapie präsentiert werden.4
In ARANOTE zeigte Darolutamid plus ADT im Vergleich zu Placebo plus ADT eine 46%ige Verringerung des Risikos für radiologische Progression oder Tod bei mHSPC-Patient:innen mit aggressiver Erkrankung. Interessanterweise war dieser Vorteil in allen Subgruppen einschliesslich jener mit niedrigem Tumorvolumen konsistent. Weiters fiel im Prüfarm eine vergleichsweise niedrigere Rate an Behandlungsabbrüchen aufgrund therapiebedingter Nebenwirkungen auf als im Kontrollarm (6,1% vs. 9,0%); somit liess sich hier erstmals ein Vorteil zugunsten einer neuen hormonalen Therapie demonstrieren.
Bei ausgewählten fitten Patient:innen mit hoher Tumorlast kann eine Intensivierung mit Docetaxel zusätzlich zum ADT/ARPI-Backbone die Prognose verbessern, wie Studiendaten zeigen. Beispielsweise verlängerte Darolutamid plus ADT und Docetaxel in der ARASENS-Studie das Gesamtüberleben (OS) vs. ADT plus Docetaxel sowohl bei De-novo- als auch rezidivierender Erkrankung.5 Patient:innen mit niedrigem Tumorvolumen profitierten allerdings nicht.6
Da die Toxizität durch die Zugabe von Docetaxel kurzfristig deutlich erhöht wird, bietet sich eine Tripeltherapie nur bei chemotherapiefitten Personen mit hoher Tumorlast an, die eine anfängliche Verschlechterung der Lebensqualität verkraften.1
Radioliganden- und Lokaltherapie
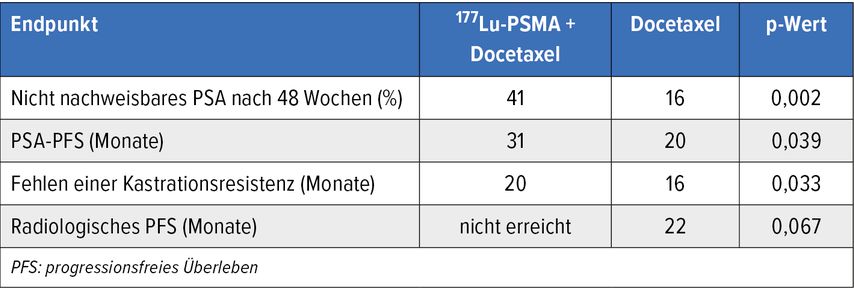
Auf einen möglichen Stellenwert der 177Lu-PSMA-617-Behandlung beim mHSPC mit hohem Tumorvolumen weist die randomisierte Phase-II-Studie UpFrontPSMA hin. Durch zwei Zyklen 177Lu-PSMA-617 gefolgt von sechs Zyklen Docetaxel konnten im Sinne eines Proof of Concept verglichen mit Docetaxel Outcome-Verbesserungen ohne gesteigerte Gesamttoxizität erzielt werden (Tab. 1).7
Tab. 1: UpFront-PSMA: Outcomes unter 177Lu-PSMA-617 gefolgt von Docetaxel vs. Docetaxel alleine (modifiziert nach Azad AA et al.)7
Nicht vergessen werden sollte die lokale Therapie des Primärtumors bei geringer Tumorlast und gutem Ansprechen. Dieses Konzept besitzt hohe Wertigkeit vor dem Hintergrund einer komplexen Interaktion zwischen Primum und Metastasen sowie angesichts der Tatsache, dass die lokale Progression auch bei stabiler Erkrankung signifikante Beschwerden hervorrufen kann (z.B. Blutungen, Obstruktion).
In der STAMPEDE-Studie wurde durch die Zugabe der Radiotherapie zur ADT eine OS-Verlängerung erreicht, allerdings nur bei niedrigem Tumorvolumen.8 Mögliche Synergismen zwischen ADT, ARPI und Radiotherapie legt die PEACE-1-Studie bei Patient:innen mit niedrigem Tumorvolumen nahe, wobei keine OS-Verlängerung resultierte.9
In der Praxis kann die Zugabe der Radiatio zur Standardtherapie gegebenenfalls im Rahmen eines individuellen Heilversuchs mit Auslassversuch der systemischen Behandlung nach einem gewissen Zeitraum zur Anwendung kommen. Für die alleinige routinemässige Prävention lokaler Komplikationen empfehle ich die Bestrahlung beim mHSPC nicht.
mCRPC: Ra-223, PARP-Inhibition
Im Setting des metastasierten kastrationsresistenten PC (mCRPC) ist die randomisierte, offene Phase-III-Studie PEACE-3 erwähnenswert. Enzalutamid plus Radium-223 verlängerte hier verglichen mit der Enzalutamid-Monotherapie bei asymptomatischen oder leicht symptomatischen Patient:innen mit Knochenmetastasen das radiologische progressionsfreie Überleben sowie andere Endpunkte.10 In dieser Gruppe stellt Enzalutamid/Ra223 plus Denosumab eine neue Erstlinienoption dar, sofern noch kein ARPI verabreicht wurde, was allerdings nur mehr selten der Fall ist.
Wachsende Bedeutung fällt im Management des mCRPC der Genetik zu. Als potente Erstlinienstrategie zeichnet sich in den Studien PROpel, TALAPRO-2 und MAGNITUDE die Kombination aus ARPI und PARP-Inhibitoren ab, wobei Benefits hauptsächlich bei Vorliegen von BRCA-/HRR-Mutationen zutage traten.11–13
Im Sinne einer raschen Initiierung der Therapie wird bei allen mCRPC-Patient:innen eine frühzeitige genetische Abklärung empfohlen. Alle Patient:innen, die zumindest eine BRCA1/2-Mutation aufweisen, sollten einen PARP-Inhibitor erhalten. Künftig wird die Aufgabe darin bestehen, die idealen Sequenzen der beim mCRPC verfügbaren Therapien zu identifizieren.
Literatur:
1 Gillessen S et al.: Management of patients with advanced prostate cancer-metastatic and/or castration-resistant prostate cancer: report of the Advanced Prostate Cancer Consensus Conference (APCCC) 2022. Eur J Cancer 2023; 185: 178-215 2 Albertsen PC et al.: Cardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. Eur Urol 2014; 65(3): 565-73 3 Gillessen S et al.: Adding metformin to androgen deprivation therapy for patients with metastatic hormone sensitive prostate cancer: overall survival results from the multi-arm, multi-stage randomised platform trial STAMPEDE. Ann Oncol 2024; 35(Suppl. 2): 1-72 4 Saad F et al.: Efficacy and safety of darolutamide plus androgen-deprivation therapy in patients with metastatic hormone-sensitive prostate cancer from the phase III ARANOTE trial. Ann Oncol 2024; 35(Suppl. 2): 1-72 5 Smith M et al.: Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. N Engl J Med 2022; 386(12): 1132-42 6 Hussain M et al.: Darolutamide plus androgen-deprivation therapy and docetaxel in metastatic hormone-sensitive prostate cancer by disease volume and risk subgroups in the phase III ARASENS trial. J Clin Oncol 2023; 41(20): 3595-607 7 Azad AA et al.: UpFrontPSMA: A randomised phase II study of sequential 177Lu-PSMA-617 and docetaxel versus docetaxel in metastatic hormone-sensitive prostate cancer. Ann Oncol 2024; 35(Suppl. 2): 1-72 8 Parker CC et al.: Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet 2018; 392(10162): 2353-66 9 Bossi A et al.: Prostate irradiation in men with de novo, low-volume, metastatic, castration-sensitive prostate cancer (mCSPC): results of PEACE-1, a phase 3 randomized trial with a 2x2 design. JClin Oncol 2023; 41(Suppl. 17): Abstr. #LBA5000 10 Gillessen S et al.: A randomized multicenter open label phase III trial comparing enzalutamide vs a combination of Radium-223 and enzalutamide in asymptomatic or mildly symptomatic patients with bone metastatic castration-resistant prostate cancer: first results of EORTC-GUCG 1333/PEACE-3. Ann Oncol 2024; 35(Suppl. 2): 1-72 11 Clarke NW et al.: Abiraterone and olaparib for metastatic castration-resistant prostate cancer. N Engl J Med 2022; 1(9): EVIDoa2200043 12 Agarwal N et al.: Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet 2023; 402(10398): 291-303 13 Chi KN et al.: Niraparib and abiraterone acetate for metastatic castration-resistant prostate cancer. J Clin Oncol 2023; 41(18): 3339-51
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...