Diesmal geht es auch um die Synapse
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auf dem diesjährigen Kongress der American Society of Clinical Oncology (ASCO) konnte man unter anderem die wissenschaftliche Auseinandersetzung mit der immunologischen Synapse sehen.
In den mehr als zehn Jahren der klinischen, onkologischen Immunmodulation ist es vor allem um die Modulation der Funktion derimmunologischen Synapse gegangen.Das heisst, die Bildung der immunologischen Synapse wurde vorausgesetzt. Was ist die immunologische Synapse? Hierbei handelt es sich um eine hochgradig strukturierte und regulierte Aggregation von vielen Molekülen, die sich auf den initialen Kontakt des T-Zell-Rezeptors mit dem MHC-Peptid-Komplex auf der Tumorzelle und der T-Zelle bilden. Diese immunologische Synapse ist der Dreh- und Angelpunkt der therapeutischen Immunantwort, da durch sie zytotoxische Signale und Moleküle an die Zielzelle weitergegeben werden und diese dadurch zum Absterben gebracht wird.
Wie schon erwähnt, haben die Checkpoint-Blockaden die Aufgabe, die bei einer sich bildenden Synapse bremsenden Moleküle zu blockieren, damit die Synapse sich stabiler und effektiver ausbilden kann. Aber es setzt grundsätzlich voraus, dass sich eine Bindung zwischen T-Zell-Rezeptor und MHC-Peptid-Komplex entwickelt, der dann therapeutisch modulierbare weitere Schritte im Sinne der Synapsenformation nach sich zieht. Nur zeigen klinische Ergebnisse, wie auch experimentelle Daten, dass sich solch ein T-Zell-Rezeptor-MHC-Peptid-Komplex nicht immer bildet. Dies kann zum Teil dadurch erklärt werden, dass in bestimmten Patienten nicht das richtige T-Zell-Repertoire vorliegt, um eine derartige T-Zell-Rezeptor-MHC-Peptid-Komplexbildung zu erlauben. Die Situation wird dadurch erschwert, dass man bis jetzt nicht vorhersagen kann, ob das richtige Repertoire für die richtigen Zell-MHC-Peptid-Komplexe der Tumorzellen in einem Patienten vorliegt.
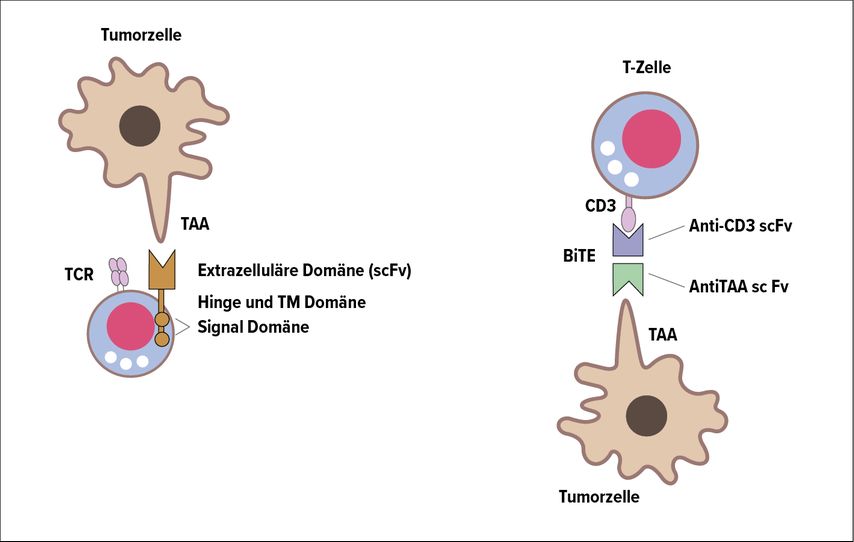
Aus dieser Situation kann nun das therapeutische Konzept abgeleitet werden, dass eine T-Zell-Rezeptor-Komplexbildung auch therapeutisch ausgelöst werden kann. Man spricht dann von der Induktion einer artifiziellen, immunologischen Synapse. Hierfür können zwei Ansätze benutzt werden, die auf dem ASCO 2021 auch vorgestellt wurden (Abb. 1).
Abb. 1: Links der CAR(Chimärer-Antigenrezeptor)-basierte Ansatz zur Formierung der immunologischen Synapse und rechts der BiTE(«Bi-specific T-cell engager»)-basierte Ansatz. Beide führen zur Ausbildung einer Synapse, die zytotoxische Signale und Moleküle an die Tumorzellen sendet. (mod.nach Slaney CY et al.)6
BiTE-basierter Ansatz
Als Erstes möchte ich in diesem Zusammenhang auf eine Studie beim kleinzelligen Bonchialkarzinom (SCLC) hinweisen, da diese ein Beleg dafür ist, dass auch derartige Therapien nun ausserhalb der Hämatoonkologie geprüft werden.
Bekannt und zugelassen ist diese Therapieform für die akute leukämische Leukämie. In diesem Ansatz bindet das bispezifische Antikörperkonstrukt (BiTE) CD3 auf der T-Zelle und CD19 aufseiten der Leukämiezellen. Tarlatamab ist nun ein bispezifischer Antikörper, der CD3 als Teil des T-Zell-Rezeptors auf den T-Zellen und DLL3 auf den Tumorzellen binden kann. Somit wird auch hier die Bildung einer immunologischen Synapse ausgelöst. Als Neuerung zu diesem Konzept hat Tarlatamab noch einen Fc-Teil, der die Halbwertszeit verlängert, um klinisch praktikablere Applikationsintervalle zu erlauben.
In die Studie wurden Patienten eingeschlossen, die wenigstens eine vorherige Therapie im metastasierten Stadium eines SCLC und einen ECOG 0–2 hatten. Von den 66 behandelten Patienten hatten 30% eine vorgängige Checkpoint-Blockade. Die Krankheitskontrollrate betrug 30% und die häufigste Nebenwirkung war ein «cytokine release syndrome» (CRS) bei 44% der Patienten, wobei nur bei einem Patienten ein höhergradiges CRS auftrat.1 Ein derartiger Ansatz wurde auch in der «Trials in Progress»-Sektion für PSMA-exprimierende Prostatakarzinome gezeigt (Acapatamab). Hier scheint mir bei positiven Daten die klinische Einsatzmöglichkeit noch viel grösser zu sein.
CAR-basierter Ansatz
Der alternative Ansatz zur Formierung einer artifiziellen, immunologischen Synapse ist der Einsatz von chimären Antigenrezeptoren (CAR). Hierbei handelt es sich um eine Form der somatischen Gentherapie von T-Zellen. Der CAR bildet eine immunologische Synapse. Hier gibt es zwei gegen das Zielantigen CD19 gerichtete, zugelassene und in der Schweiz angewandte Produkte – Axicabtagen-Ciloleucel (Yescarta®) undTisagenlecleucel (Kymriah®).
Die Herstellung von CAR-tragenden T-Zellen ist nach wie vor technisch und logistisch herausfordernd, sodass aus meiner Sicht bis jetzt ein gewisser Vorteil bei den bispezifischen Antikörpern in der breiten klinischen Anwendung liegt.
Die von mir im Weiteren vorgestellte Studie zeigt aus meiner Sicht zwei wichtige Entwicklungen. Zum einen werden neue Zielstrukturen geprüft und zum anderen kann die Herstellung als dezentraler Prozess etabliert werden. Letzteres wird durch die Verwendung von geschlossenen Systemen ermöglicht, bei denen das Produkt automatisiert hergestellt wird. Bei diesen Systemen wird formal kein Reinraum mehr benötigt, und die Anschaffungskosten sowie der technische Betrieb erlauben die Nutzung in einem Zentrum vor Ort.
In der präsentierten Studie wurde der Herstellungsprozess mittels einer Apparatur namens «CliniMACS Prodigy» der Firma Miltenyi etabliert. Hierbei wurden CAR-tragende T-Zellen gegen die Zielstruktur CD20 hergestellt. Die 10 behandelten Patienten hatten Non-Hodgkin-Lymphome, die vorgängig mit CAR-tragenden T-Zellen gegen CD19 behandelt wurden und im Weiteren rezidivierten.
Alle 10 Patienten zeigten wenigstens ein partielles Ansprechen und 4 Patienten sind nach 10 Monaten immer noch in kompletter Remission.2 Das veranschaulicht sehr schön, dass der Wechsel der Zielstruktur einen therapeutischen Mehrwert haben kann. In den nächsten Jahren wird das Feld der bispezifischen Antikörper und der CAR enorm an Fahrt aufnehmen.
Duale Checkpoint-Blockade
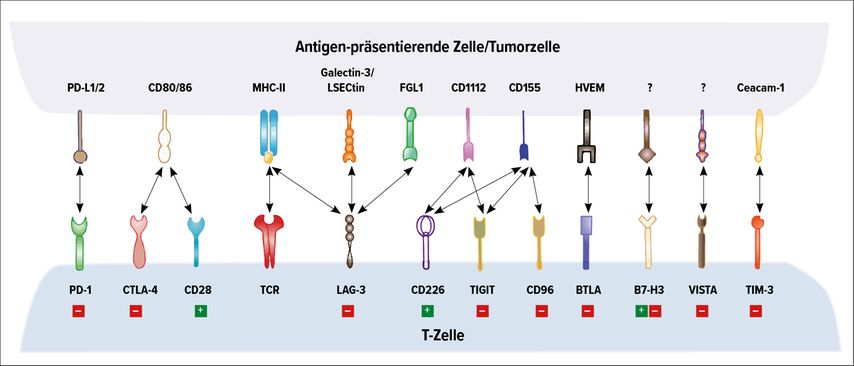
Ansonsten ging die Entwicklung der Checkpoint-Blockade als Kombinationstherapie weiter. Ein spannendes Molekül ist Relatlimab. Relatlimab ist ein Antikörper, der LAG-3 blockiert, das ein weiterer Checkpoint ist, wie in Abbildung 2 gezeigt. LAG-3 reiht sich ein in die Reihe der inhibierenden Moleküle einer therapeutischen Immunantwort und verspricht ein potenzieller Kombinationspartner bei Therapien in verschiedenen malignen Entitäten zu werden.
Abb. 2: Inhibierende (rot) und aktivierende (grün) Checkpoints, zentral für den Effekt der Checkpoints ist die Aktivierung des TCRs (Z-Zell-Rezeptors) (mod. nach Quin S et al.)7
Wie so oft in den letzten Jahren wurde ein neues immunologisches Therapiekonzept beim Melanom als Modellerkrankung getestet. Relatlimab wurde in Kombination mit Nivolumab beim nicht resektablen oder metastasierenden Melanom in der ersten Linie geprüft. Der Vergleichsarm war die Standardtherapie mit Nivolumab. Das mediane progressionsfreie Überleben für den Relatlimab+Nivolumab-Arm war 10 Monate im Vergleich zu Nivolumab mit 4,6 Monaten (HR: 0,75; 95% CI: 0,62–0,92).3 Somit konnte die Kombination einen Vorteil zeigen. Weitere Studien beim Melanom und anderen malignen Erkrankungen müssen den Stellenwert von Relatlimab nun bestätigen.
Weitere Immunmodulatoren
Mir sind darüber hinaus noch weitere Moleküle aufgefallen, die getestet wurden, deren klinische Daten trotz starker biologischer Rationale für mich aber eher enttäuschend waren. So wurde ein oraler CD11B-Modulatur (GB1275) zur Beeinflussung immuner suppressiver, myeloischer Zellen in Kombination mit Pembrolizumab oder als Monotherapie bei Patienten mit vortherapierten soliden Tumoren in einer Phase-I-Studie getestet. Mit der Monotherapie (19 Patienten) und der Kombination (16 Patienten) konnte jeweils nur bei 3 Patienten eine Stabilisierung der Erkrankung als bestes Ergebnis erreicht werden.4
Auch das Molekül TGF-beta wurde wieder in einer klinischen Studie als potenzieller negativer Immunmodulator angegangen. SHR-1701 ist ein bifunktionales Molekül, das sowohl den TGF-beta-Rezeptor als auch PD-L1 blockiert. Auch hier lag eine sehr gute biologische Rationale zum Einsatz dieses Moleküls vor, da TGF-beta multiple immunsuppressive und tumorwachstumsfördernde Funktionen haben kann.
SHR-1701 wurde in einer Phase-I-Studie bei Patienten mit vortherapierten soliden Tumoren geprüft. Hierbei zeigte sich eine allgemeine Ansprechrate von 17,8% in 45 Patienten, was aus meiner Sicht kaum eine Verbesserung des Ansprechens gegenüber einer alleinigen PD-L1-gerichteten Therapie ausmacht.5
Fazit
Zusammenfassend erscheint mir der Einsatz neuer Kombinationen trotz starker biologischer Rationale weiter schwierig, da bis auf wenige Ausnahmen ein klarer klinischer Vorteil noch nicht eindeutig zu sehen ist. Aber hier werden weitere Studien sicher mehr Klarheit bringen.
Auf der Überholspur sind für mich Therapien, die Zellen des Immunsystems so beeinflussen, dass sich immunologische Synapsen mit therapeutischer Wirkung entwickeln können. Ob das in Zukunft vor allem bispezifische Antikörper oder chimäre Antigenrezeptoren sein werden, hängt vor allem von der technischen Entwicklung bei der Herstellung der chimären Antigenrezeptoren ab.
Literatur:
1 Ownikoko TK et al.: Updated results from a phase 1 study of AMG 757, a half-life extended bispecific T-cell engager (BiTE) immuno-oncology therapy against delta-like ligand 3 (DLL3), in small cell lung cancer (SCLC). ASCO 2021; Abstr. #8510 2 Liang A et al.: Safety and efficacy of a novel anti-CD20 chimeric antigen receptor (CAR)-T cell therapy in relapsed/refractory (r/r) B-cell non-Hodgkin lymphoma (B-NHL) patients after failing CD19 CAR-T therapy. ASCO 2021; Abstr. #2508 3 Lipson EJ et al.: Relatlimab (RELA) plus nivolumab (NIVO) versus NIVO in first-line advanced melanoma: primary phase III results from RELATIVITY-047 (CA224-047). ASCO 2021; Abstr. #9503 4 Park H et al.: Preliminary clinical and biologic results of GB1275, a first-in-class oral CD11b modulator, alone and with pembrolizumab, in advanced solid tumors (KEYNOTE A36). ASCO 2021; Abstr. #2505 5 Liu D et al.: Phase 1 study of SHR-1701, a bifunctional fusion protein targeting PD-L1 and TGF-β, in patients with advanced solid tumors. ASCO 2021; Abstr. #2503 6 Slaney CY et al: CARs versus BiTEs: A Comparison between T Cell-Redirection Strategies for Cancer Treatment. Cancer Discov 2018; 8(8): 924-347 Qin S et al.: Novel immune checkpoint targets: moving beyond PD-1 and CTLA-4. Mol Cancer 2019; 18(1): 155
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...