„Die Zukunft der Forschung liegt im ‚adaptive design‘“
Das Interview führte Dr. Nicole Leitner
Unsere Gesprächspartnerin:
Assoc. Prof. Priv.-Doz. Dr. Anna Sophie Berghoff, PhD
Translational Research Unit
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin I
Medizinische Universität Wien
E-Mail: anna.berghoff@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Assoc. Prof. Priv.-Doz. Dr. Anna Sophie Berghoff ist Leiterin der Translational Research Unit an der Medizinischen Universität Wien und Expertin für Neuroonkologie. Wir sprachen mit ihr über die am Jahreskongress der American Society of Clinical Oncology (ASCO) präsentierten Studienergebnisse auf diesem Gebiet.
Beim diesjährigen ASCO wurden mehrere Studien zu zielgerichteten Therapien bei seltenen ZNS-Tumoren präsentiert (Inhibitoren von BRAF/MEK, TRK, ALK). Wie beurteilen Sie die Ergebnisse dieser Studien?
A. S. Berghoff: Studien zu seltenen Tumoren durchzuführen ist eine unglaubliche Herausforderung. Die Studien, die in diesem Jahr beim ASCO-Kongress präsentiert wurden, haben nicht nur seltene Tumoren, sondern auch seltene molekulare Alterationen behandelt. Der Aufwand, der in diese klinischen Studien geflossen ist, ist enorm und die Ergebnisse dieser Studien sind sehr wichtig. Drei Studien möchte ich hier näher beleuchten: eine zu Kraniopharyngeomen, eine zu ALK-Alterationen bei Neuroblastomen und eine zu TRK-Fusionen bei verschiedenen Tumorentitäten.
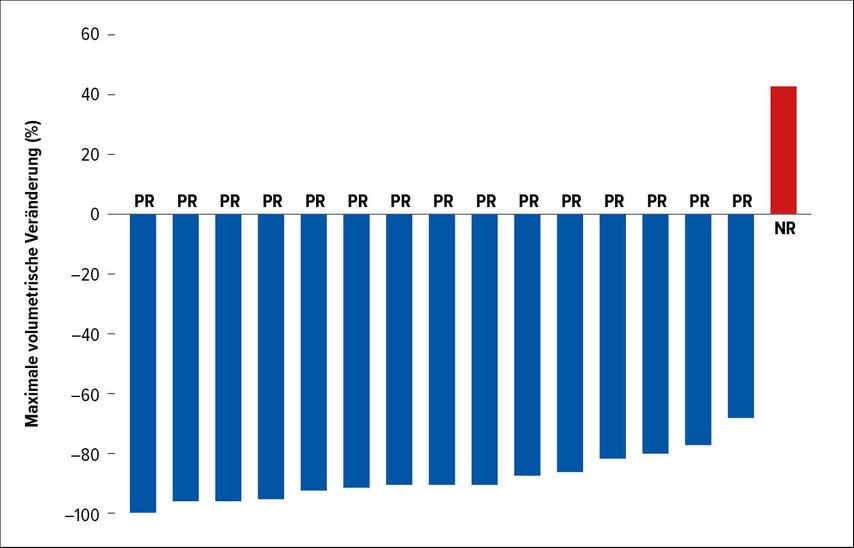
Kraniopharyngeome sind eine sehr seltene Tumorentität. Häufig weisen diese Patienten BRAF-/MEK-Alterationen auf: Bis zu 95% der Patienten haben eine BRAFV600E-Mutation. Bisher hatten wir lediglich Daten aus Case Reports, die nahelegten, dass die BRAF-/MEK-Inhibition eine Therapieoption ist, wenn es keine Möglichkeit zur lokalen Behandlung gibt. Nun wurde zu diesem Thema unter Leitung von Dr. Priscilla Brastianos aus Boston die erste klinische Studie durchgeführt. Es konnte gezeigt werden, dass diese Patienten tatsächlich ein gutes Ansprechen aufweisen: 14 der 15 Patienten sprachen auf die Therapie an (Abb.1).1 Da es sich um eine so seltene Entität handelt, ist es kein großer Trial. Aber dennoch konnte erstmals gezeigt werden, dass auch bei einer so seltenen Tumorerkrankung eine klinische Studie durchgeführt werden kann und dass die Ergebnisse klinisch relevant sind. Wir verfügen damit über eine neu etablierte Therapiemöglichkeit.
Abb. 1: Ansprechen von Kraniopharyngeomen auf BRAF-/MEK-Inhibition. Die mediane Tumorreduktion betrug –91% [Spanne: –68% bis –99%] nach Brastianos et al.)1
Eine weitere Studie untersuchte ALK-Translokationen bei Neuroblastomen. Auch bei den Neuroblastomen handelt es sich um eine sehr seltene Entität, vor allem bei Erwachsenen, die der Fokus dieser Studie waren. ALK-Alterationen kommen in diesem Setting relativ häufig vor. Bei diesem Trial handelte es sich um eine retrospektive Studie, d.h. eine „Case Series“ von Patienten, die mit einer individualisierten Therapie behandelt wurden. Insgesamt erhielten sieben Patienten einen ALK-Inhibitor, fünf von ihnen zeigten einen klinischen Benefit.2 Auch diese Daten weisen uns eine neue Therapieoption auf.
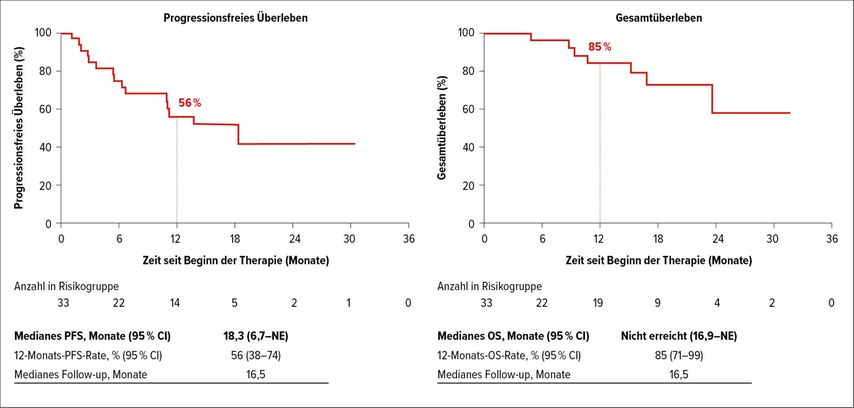
Noch spannender fand ich die Studie zu TRK-Fusionen. Es handelt sich hierbei um einen neuen Therapieansatz, bei dem Tyrosinkinase-Inhibitoren zum Einsatz kommen. Dieser Ansatz wurde in der Studie über verschiedene Entitäten hinweg angewandt. Dazu muss man wissen, dass das eine Genalteration ist, die unglaublich selten ist. Wir reden hier von 0,6% der erwachsenen Patienten und 2% der pädiatrischen Patienten. Auch hier konnten gute Ansprechraten beobachtet werden. Bei den aggressiven, „high grade“ Gliomen lag die Ansprechrate bei 26% und bei den niedriggradigen Gliomen bei 38%. Allerdings handelte es sich hier nicht um ein Erstliniensetting, das Patientenkollektiv war schon stark vorbehandelt. Unter diesem Gesichtspunkt sind das wirklich gute Ansprechraten. Auch das mediane progressionsfreie Überleben (PFS) war mit 18,3 Monaten recht lang (Abb. 2).3 Ich bin sehr gespannt, wie es damit weitergeht. Ich denke, die Zukunft der Forschung liegt im „adaptive design“, bei dem man sehr seltene genetische Alterationen in Studien untersucht.
Abb. 2: Progressionsfreies Überleben und Gesamtüberleben bei Patienten mit TRK-Fusionen unter Tyrosinkinase-Inhibitor-Therapie (nach Perreault et al.)3
Bei den IDH-mutierten hochgradigen Gliomen wurde der PARP-Inhibitor Olaparib getestet – was erwarten Sie von diesem Ansatz?
A. S. Berghoff: Für unsere Behandlung sind IDH-Mutationen ein sehr wichtiger Ansatzpunkt. Seit Langem wird versucht, eine effektive Therapie mit diesem Ansatzpunkt zu finden. Derzeit stellt sich das Problem, dass die bisherigen Inhibitoren bei höhergradigen bzw. Kontrastmittel-aufnehmenden Gliomen wenig Wirkung zeigen. Hier wurde intensiv nachgeforscht und festgestellt, dass der BRCA-Signalweg einer der Faktoren ist, warum IDH-Inhibitoren bei höhergradigen IDH-mutierten Gliomen teilweise nicht funktionieren. Diese Erkenntnis führte zum Ansatz, einen PARP-Inhibitor zu verwenden. Das Studienkollektiv umfasste Patienten, die hochgradige Gliome aufwiesen und für die keine weitere Therapie verfügbar war. Leider war die Studie negativ. Die PFS-Rate nach sechs Monaten lag bei 31% und die Studie erreichte ihren präspezifizierten Endpunkt damit nicht. Man hat dennoch eine gewisse Effizienz der Therapie gesehen, sodass die Autoren schlussfolgerten, dass eine weitere Studie in Kombination mit einem klassischen Chemotherapeutikum wie z.B. Temozolomid einen Benefit haben könnte.4 Ich glaube, dass das ein wichtiger Ansatz ist, denn gerade für die höhergradigen IDH-mutierten Tumoren haben wir bisher keine zielgerichtete Therapie.
Bei den Gliomen wurde der Proteasom-Inhibitor Marizomib untersucht. Wie schätzen Sie diese Studie ein?
A. S. Berghoff: Die Marizomib-Studie oder auch EORTC1709-Studie war für mich ein Highlight des diesjährigen ASCO-Kongresses, und das, obwohl sie negativ ist. Es handelte sich hierbei um die einzige Phase-III-Studie in Bezug auf ZNS-Tumoren, die dieses Jahr präsentiert wurde. Phase-III-Studien sind der Goldstandard in der klinischen Forschung – das ist das, wonach wir streben müssen. Es handelt sich bei dieser Studie um eine internationale Kooperation unter Schirmherrschaft der European Organisation for Research and Treatment of Cancer (EORTC) mit Prof. Roth aus Zürich als Erstautor. Auch viele österreichische Zentren, inklusive des AKH Wien, haben hier teilgenommen und aktiv Patienten eingebracht. Zu unserer Freude hat der Trial unglaublich schnell rekrutiert. Leider reiht sich die Studie in die lange Liste negativer Studien beim Glioblastom ein. Der Ansatz, einen Proteasom-Inhibitor zu verwenden, war präklinisch gut gestützt. Die Studie zeigte dennoch sehr deutlich, dass diese Therapie zu keinem Vorteil in Bezug auf das progressionsfreie Überleben oder das Gesamtüberleben führt.5 Daher wird der Wirkstoff nicht weiterentwickelt. Aber die Studie hat gezeigt, wie effektiv wir Phase-III-Studien durchführen können und wie schnell wir in diese Studien rekrutieren können. Ich würde sagen, es braucht dringend neue Ideen für weitere Phase-III-Studien in der Neuroonkologie.
In einer anderen Studie wurde der Einsatz von CDK4/6- und ERK-Inhibitoren geprüft. Wie schätzen Sie diese Ergebnisse ein?
A. S. Berghoff: CDK4/6-Inhibitoren sind ein sehr interessantes Feld. Es gab in diesem Jahr sogar zwei Studien, die sich damit auseinandergesetzt haben. Eine davon war eine sehr besondere Studie, nämlich eine Phase-0-Studie. In einer Phase-0-Studie wird die Pharmakokinetik des Wirkstoffs untersucht. D.h., Patienten, die für eine Operation infrage kommen, bekommen einige Stunden vor der Operation das Medikament. In der Folge wird im Operationspräparat überprüft, wie viel von der Substanz in den Tumor penetriert ist. Das ist ein sehr eleganter Ansatz, da man daraus schließen kann, bei welchen Patienten die Konzentration im Tumor hoch genug ist, um den Wirkstoff postoperativ weiter zu verabreichen. Genau das wurde in dieser Studie gemacht. Untersucht wurden zwei Substanzen: der CDK4/6-Inhibitor Abemaciclib und ein derzeit noch experimenteller ERK-Inhibitor. Nur wenn beide Substanzen im resezierten Tumor einen bestimmten Grenzwert überschritten hatten, erhielten die Patienten sie auch postoperativ.6 Ich denke, dass ist ein sehr interessanter Ansatz und eine gute Möglichkeit, von Anfang an zu erheben, ob es eine Rationale für die applizierte Therapie gibt.
Die zweite vorgestellte Abemaciclib-Studie ist Teil eines Plattform-Trials, der INSIGhT-Studie. Patienten, die gewisse molekulare Charakteristika erfüllten, die für ein Ansprechen auf CDK4/6-Inhibitoren sprechen, wurden in diesen Studienarm aufgenommen. Allerdings muss man als Einschränkung dazu sagen, dass wir nicht genau wissen, welche molekularen Faktoren ein Ansprechen auf CDK4/6-Inhibitoren begünstigen. Es handelt sich daher um eine Annäherung, die in diesem Trial sehr gut funktionierte. Das Spannende war, dass das PFS in dieser Studie zwar statistisch signifikant unterschiedlich war, das Gesamtüberleben jedoch nicht. Das ist etwas, das bei klinischen Studien häufig vorkommt. Unser Goldstandard muss aber das Gesamtüberleben sein. Und in Bezug darauf schnitt dieser Trial leider negativ ab.7 Damit stellt sich auch die Frage, wie es mit den CDK4/6-Inhibitoren in Zukunft weitergeht. Es gibt eben die Möglichkeit, ein adaptives Studiendesign anzuwenden und zu beurteilen, ob der Wirkstoff am Zielort adäquat ankommt. Oder brauchen wir andere Wirkstoffkombinationen? Leider sind die ersten Studien zu CDK4/6-Inhibitoren relativ enttäuschend.
Gab es andere Studien am ASCO-Kongress, die Sie besonders interessant fanden?
A. S. Berghoff: Da ich ein Labor für personalisierte Immuntherapie leite, ist natürlich die Immuntherapie beim Glioblastom etwas, das mich sehr fasziniert. Hier hoffe ich sehr darauf, dass wir in den nächsten Jahren noch viele Schritte weiterkommen werden. Es gab einige interessante Studien, die präklinisch untersuchten, wie sich die Tumormikroumgebung bei Glioblastomen unter bestimmten Therapien verhält. Sehr spannend war die Erkenntnis, dass IDH-Inhibitoren einen immunmodulatorischen Effekt haben. D.h., eine Hemmung von IDH führt zu einer erhöhten Inflammation im Tumor. IDH-Inhibitoren sind deshalb möglicherweise für Kombinationstherapien interessant.8
Hochspannend war auch eine Studie mit einem Ansatz, der im Feld der Neuroonkologie schon länger überlegt wird, nämlich die Kombination eines PD-1-Inhibitors, in diesem Fall Nivolumab, mit einem VEGF-Inhibitor, in diesem Fall Bevacizumab. Hierbei handelt es sich um eine Kombination, die in einigen Tumorarten wirklich große Erfolge gezeigt hat und z.B. beim hepatozellulären Karzinom und Nierenzellkarzinom eine Standardbehandlung ist. Hier ist die PD-1-/VEGF-Inhibitor-Kombination wirklich sehr effektiv. Bei diesem Trial handelte es sich um eine einarmige Phase-II-Studie, die als negativ zu bewerten ist, da im Vergleich zur historischen Kontrolle und auch in Bezug auf die präspezifizierten Endpunkte kein großer Effekt sichtbar war.9 Das zeigt uns auch, dass wir vermehrt präklinische Studien benötigen, um die Tumormikroumgebung der Gliome besser zu verstehen. Auf Basis präklinischer Daten können wir dann neue Studien im Bereich der Immuntherapie formulieren.
Welche Ansätze in der Neuroonkologie halten Sie für besonders vielversprechend?
A. S. Berghoff: Für mich stellen die sogenannten „platform trials“ die Zukunft der neuroonkologischen Forschung dar. Das sind Studien, die Patienten screenen und dann aufgrund des molekularen Profils einem Arm zuordnen. Dabei teilen sich mehrere Arme einen Kontrollarm. In diesem Design kann man erstens viel besser agieren und festlegen, wann man einen Arm schließt, der sich als ineffizient herausstellt. So lassen sich negative Phase-III-Studien verhindern, indem früh in Phase-II-Studien festgestellt wird, ob ein Wirkstoff überhaupt effizient genug ist. Die zweite Besonderheit an einem adaptiven „platform design“ ist, dass man neue Studienarme, basierend auf neuem, molekularem Verständnis, einführen kann. Diesbezüglich gibt es einige Ansätze. Beim ASCO-Kongress wurden vor allem Daten des schon erwähnten INSIGhT-Trials präsentiert. Hier stellte sich nicht nur bei Abemaciclib, sondern auch bei einer zweiten Substanz heraus, dass es sich um einen ineffizienten Ansatz handelt. Es wurde auch klar statistisch gezeigt, dass so ein Design verhindert, Patienten in einen ineffizienten Arm zu randomisieren. Es gibt eine große internationale Initiative, die GBM-AGILE-Studie, die so ein Design hat und bei der auch wir versuchen werden, teilzunehmen. Ich glaube, das ist die Zukunft der Neuroonkologie.
Vielen Dank für das Gespräch!
Literatur:
1 Brastianos PK et al.: Alliance A071601: phase II trial of BRAF/MEK inhibition in newly diagnosed papillary craniopharyngiomas. ASCO 2021; Abstr. #2000 2 Stiefel J et al.: ALK inhibitors for treatment of adult-onset neuroblastoma. ASCO 2021; Abstr. #2001 3 Perreault S et al.: Efficacy and safety of larotrectinib in adult and pediatric patients with tropomyosin receptor kinase (TRK) fusion-positive primary central nervous system tumors. ASCO 2021; Abstr. #2002 4 Ducray F et al.: Olaparib in recurrent IDH-mutant high-grade glioma (OLAGLI). ASCO 2021; Abstr. #2007 5 Roth P et al.: EORTC 1709/CCTG CE.8: a phase III trial of marizomib in combination with temozolomide-based radiochemotherapy versus temozolomide-based radiochemotherapy alone in patients with newly diagnosed glioblastoma. ASCO 2021; Abstr. #2004 6 Sanai N et al.: A phase 0 ‘trigger’ trial of CDK4/6 plus ERK1/2 inhibitors in recurrent glioblastoma. ASCO 2021; Abstr. #2005 7 Lee EQ et al.: Preliminary results of the abemaciclib arm in the Individualized Screening Trial of Innovative Glioblastoma Therapy (INSIGhT): a phase II platform trial using Bayesian adaptive randomization. ASCO 2021; Abstr. #2014 8 Lu M et al.: Impact of mutant IDH (mIDH) inhibition on DNA hydroxymethylation, tumor cell function, and tumor immune microenvironment (TIME) in resected mIDH1 lower-grade glioma (LGG). ASCO 2021; Abstr. #2008 9 Ahluwalia MS et al.: Randomizedphase2 study of nivolumab(nivo) plus either standard or reduced dose bevacizumab(bev) in recurrent glioblastoma (rGBM). ASCO 2021; Abstr. #2015
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...