„Die Kombinationstherapie aus LAG3- und PD-1-Antikörper war für mich das Highlight“
Unser Gesprächspartner:
Univ.-Prof. Dr. Christoph Höller
Universitätsklinik für Dermatologie
Medizinische Universität Wien
E-Mail: christoph.hoeller@meduniwien.ac.at
Das Interview führte
Dr. Nicole Leitner
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Jahreskongress der American Society of Clinical Oncology (ASCO) hielt in diesem Jahr außerordentlich viele hochinteressante Studienergebnisse zur Melanomtherapie bereit. Wir sprachen mit Univ.-Prof. Dr. Christoph Höller vom Hauttumorzentrum der Medizinischen Universität Wien über neue Daten zu Immuntherapien in verschiedenen Settings.
Welche Studien waren für Sie die Highlights des diesjährigen ASCO-Kongresses?
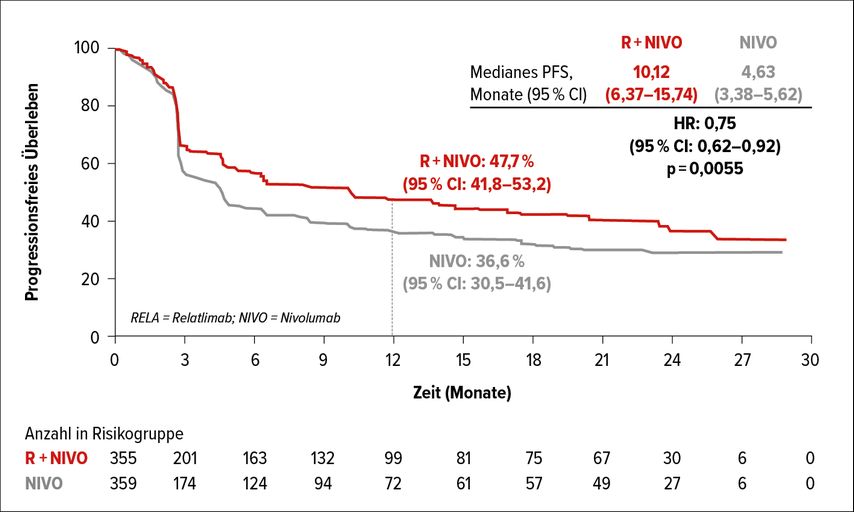
C. Höller: In diesem Jahr gab es beim ASCO-Kongress viele spannende Studienergebnisse zum Melanom. Die Daten der RELATIVITY-047-Studie zur Erstlinientherapie des fortgeschrittenen Melanoms mit der Kombination aus Relatlimab, einem Antikörper gegen LAG3 („lymphocyte-activation gene 3“), und dem PD-1-Antikörper Nivolumab waren für mich ein ganz klares Highlight. Mit der Kombination zeigte sich gegenüber einer Nivolumab-Monotherapie ein Plus von mehr als 10% hinsichtlich der Rate des progressionsfreien Überlebens (PFS) nach 12Monaten (47,7% vs. 36,6%) (Abb. 1). Außerdem fand sich eine gute Verträglichkeit. Allerdings ist die Nachbeobachtungszeit bisher noch kurz und Daten für die weiteren Endpunkte, nämlich Ansprechrate und Gesamtüberleben (OS), fehlen noch.1 Derzeit sieht es so aus, dass man mit der Kombination aus Relatlimab und Nivolumab gegenüber einer Monotherapie mehr Aktivität hinzugewinnt als mit Ipilimumab plus Nivolumab und dass die neue Kombination besser verträglich ist. Es könnte daher auf jeden Fall eine zusätzliche Therapieoption sein. Wobei ich mir nicht sicher bin, ob diese Kombination Ipilimumab plus Nivolumab ersetzen wird, vor allem bei jener Patientenpopulation, die wir primär behandeln. Dabei handelt es sich um Patienten mit einer hohen Tumorlast und mit zerebralen Metastasen, und in diesem Setting zeigt die Datenlage, dass Ipilimumab plus Nivolumab das Aktivste ist, was wir geben können. Wie Relatlimab plus Nivolumab bei dieser Subgruppe abschneidet, dazu liegen noch keine Daten vor. Persönlich glaube ich, dass die PD-1-Antikörper-Monotherapie bei den Patienten mit inoperabler Metastasierung wahrscheinlich zunehmend ersetzt werden wird. Ich denke, in Zukunft werden wir vermutlich für Patienten, die früher aufgrund der möglichen Nebenwirkungen keine Kombinationstherapie erhalten hätten, mit Relatlimab plus Nivolumab eine Kombination haben, die wir einsetzen können. Dafür müssen wir aber natürlich noch die Zulassung abwarten.
Nivolumab in Kombination mit Relatlimab wurde auch im neoadjuvanten Setting untersucht. Was waren die Ergebnisse?
C. Höller: Die Effektivität von Relatlimab plus Nivolumab konnte im neoadjuvanten Setting bestätigt werden. Eingeschlossen waren Patienten mit klinisch detektierbaren Lymphknotenmetastasen, die vor Operation Relatlimab plus Nivolumab erhielten. Die Effektivität von Relatlimab plus Nivolumab war hinsichtlich der Tumorremission in den operierten Lymphknoten vergleichbar mit früheren Daten mit Ipilimumab plus Nivolumab, jedoch war Relatlimab plus Nivolumab auch in dieser Studie besser verträglich.2
Welche weiteren LAG3-Antikörper gibtes?
C. Höller:LAG3-Antikörper sind bisher nicht zugelassen, werden jedoch zurzeit in vielen verschiedenen Studien untersucht. Ähnlich wie bei PD-1 handelt es sich auch bei LAG3 um einen Checkpoint, der auf chronisch stimulierten T-Zellen hochreguliert wird. Zwar hat LAG3 andere Liganden, aber er funktioniert prinzipiell ähnlich wie PD-1. LAG3 ist ebenfalls ein Checkpoint in der Endstrecke der Immunantwort, der seine wesentliche Rolle in der Effektorphase spielt.
Werden LAG3-Antikörper vor allem in Kombination mit anderen Checkpoint-Inhibitoren getestet?
C. Höller: Derzeit werden LAG3-Antikörper ausschließlich in Kombination mit PD-1-Antikörpern untersucht. Als Monotherapie werden sie derzeit gar nicht erwogen, sie wurden von Beginn an als Kombinationstherapien entwickelt.
Als weiteres Beispiel wurde ein Poster mit einer zwar noch recht frühen Studie mit 33 Patienten mit nicht vorbehandeltem Melanom vorgestellt, wo ein weiterer LAG3-Antikörper, Fianlimab, mit dem PD-1-Antikörper Cemiplimab kombiniert wurde, welcher derzeit zur Therapie des fortgeschrittenen kutanen Plattenepithelkarzinoms und Basalzellkarzinoms zugelassen ist. In dieser zwar kleinen Patientengruppe konnten mit dieser Kombination sehr gute Ansprechraten von 66% beobachtet werden, wobei es sich in vielen Fällen um ein anhaltendes Ansprechen handelte und die Verträglichkeit wiederum sehr gut war.3
Die Kombinationstherapie mit LAG3-Antikörper und PD-1-Antikörper war sicherlich für mich das Highlight des diesjährigen ASCO-Kongresses. Basierend auf den Daten erwarte ich mir auch, dass der Zulassungsantrag für die Relatlimab-Nivolumab-Kombination in absehbarer Zeit gestellt werden wird.
Welche neuen Daten gab es zur CheckMate-067-Studie?
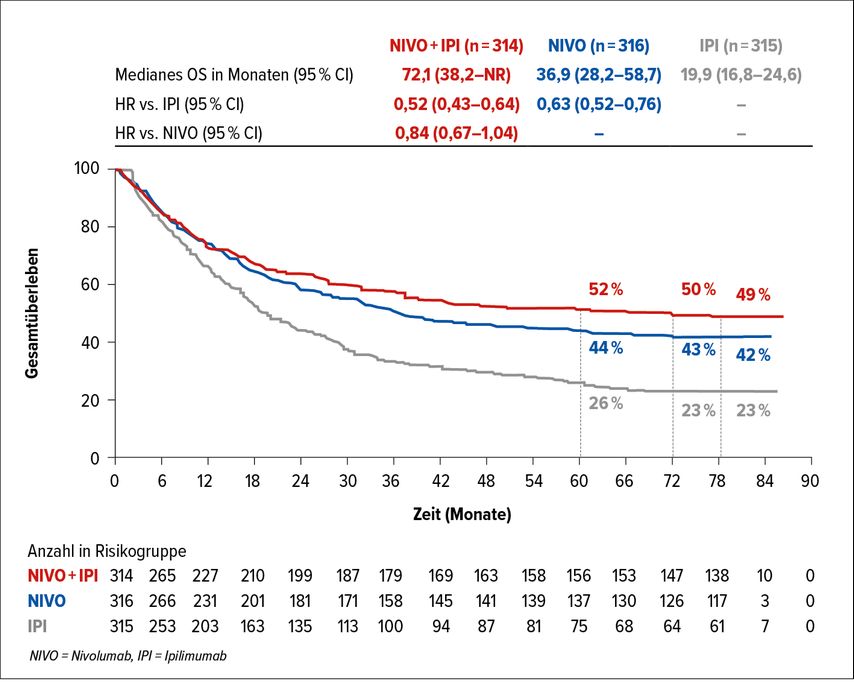
C. Höller: Zur CheckMate-067-Studie, die Ipilimumab gegen Nivolumab gegen Nivolumab plus Ipilimumab vergleicht, gab es ein neues Update nach 6,5 Jahren. Das mediane Gesamtüberleben unter Nivolumab plus Ipilimumab wurde nun erreicht und liegt bei ca. 72 Monaten (Abb. 2).4 Das ist mit Abstand das längste mediane Gesamtüberleben, das wir je in einer Studie zum Melanom gesehen haben. Um das in Perspektive zu setzen: Es ist nur knapp 10 Jahre her, dass das mediane Gesamtüberleben mit der Standard-Chemotherapie, die damals verwendet wurde, bei sechs bis sieben Monaten lag. Und nun haben wir eine Wirkstoffkombination, bei der das mediane OS bei 72 Monaten liegt. Diese Zahlen zeigen eindrucksvoll, was damit erreicht werden kann.
Gibt es neue Strategien, was die Vermeidung von Nebenwirkungen unter Nivolumab plus Ipilimumab angeht?
C. Höller: Zu Nivolumab plus Ipilimumab wurde das 3-Jahres-Update der CheckMate-511-Studie präsentiert. Diese Studie untersuchte, ob eine umgekehrte Dosierung („flip dose“) der Medikamente zu weniger Nebenwirkungen führt. Beim Melanom liegt die Standarddosierung bei 1mg/kg Nivolumab plus 3mg/kg Ipilimumab. In der Studie erhielten die Patienten 3mg/kg Nivolumab plus 1mg/kg Ipilimumab, was z.B. beim Nierenzellkarzinom die Standarddosierung ist. Höhergradige Nebenwirkungen (CTCAE Grad 3–4) traten bei 33% der Patienten unter „flip dose“ auf vs. 48% unter Standarddosierung. Formal war die Studie zwar nicht dafür ausgelegt, einen Unterschied im Ansprechen zu zeigen. Aber es ist auf jeden Fall interessant, dass die Ansprechrate unter „flip dose“ mit 47,2% nicht viel niedriger lag als unter der Standarddosierung mit 52,8%. Auch in der OS-Rate nach drei Jahren fand sich kein großer Unterschied mit 59% vs. 61%.5 Wiederum bedeuten die Daten nicht, dass man die „flip dose“ bei allen Patienten bevorzugt geben sollte. Aber dieses Schema ist auf jeden Fall eine Alternative für Patienten, bei denen ansonsten aufgrund der Nebenwirkungen die Kombinationstherapie nicht infrage kommen würde. Mit den 3-Jahres-Daten können wir uns nun auch sicher sein, dass man den Patienten mit der „flip dose“ keine Chancen vorenthält, da die Unterschiede so gering waren.
Was hat man beim 5-Jahres-Update der ABC-Studie gesehen?
C. Höller: In die ABC-Studie waren Patienten mit (asymptomatischen) Hirnmetastasen eingeschlossen, die maximal 4cm groß sein durften. Auch viele Patienten mit multiplen Hirnmetastasen befanden sich in der Studienpopulation. In den zwei wichtigen Armen erhielten die Patienten entweder Ipilimumab plus Nivolumab oder Nivolumab als Monotherapie. Es gab noch einen kleineren, dritten Studienarm, in den symptomatische Patienten eingeschlossen wurden, die ebenfalls den PD-1-Antikörper erhielten. Im 5-Jahres-Update hat man nun gesehen, dass von den Patienten mit asymptomatischen Hirnmetastasen unter der Kombinationstherapie mit Ipilimumab plus Nivolumab noch 51% am Leben sind.6 Früher hätten wir nicht erwartet, bei Patienten mit Hirnmetastasen jemals aus einer Studie ein 5-Jahres-Überleben zu sehen. Und jetzt liegt das bei über 50%. Das ist ein Meilenstein.
Welche neuen Erkenntnisse brachte das Langzeit-Update von COLUMBUS?
C. Höller: Bei COLUMBUS handelt es sich um die Zulassungsstudie von Encorafenib plus Binimetinib, einer Kombination aus BRAF- und MEK-Inhibitor. Encorafenib ist ein BRAF-Inhibitor, der eine längere Dissoziationszeit aufweist, sodass er länger am BRAF-Molekül haften bleibt. Im jetzigen Update sieht man, dass die OS-Rate nach 5 Jahren unter der Kombinationstherapie bei knapp 35% liegt. Im Kontrollarm der Studie mit Vemurafenib-Monotherapie lag die OS-Rate bei 21,4%. Interessanterweise hatte die Studie auch einen Kontrollarm mit Encorafenib als Monotherapie, wobei Encorafenib alleine nach 5 Jahren kaum schlechter abschnitt als in der Kombination. Bezüglich des PFS betrug der Unterschied zwischen Kombinations- und Monotherapie 3%, hinsichtlich des OS waren die beiden Arme sogar ident, wobei Folgetherapien das Bild verzerren. Allerdings ist eine Monotherapie mit einem BRAF-Inhibitor heute wegen der deutlich höheren Rate an vor allem kutanen Nebenwirkungen wie z.B. den sekundär entstehenden kutanen Plattenepithelkarzinomen, welche in der Kombination mit einem MEK- Inhibitor praktisch nicht mehr vorkommen, keine Option. Das zeigte sich auch dadurch, dass die Patienten im Kombinationsarm länger unter Therapie blieben und es zu weniger Therapieabbrüchen oder Dosisreduktionen kam. In dieser Gruppe fanden sich daher auch eine höhere Dosisdichte und weniger Folgetherapien.7 Die Daten lassen sich also keinesfalls dahingehend interpretieren, nur den BRAF-Inhibitor als Monotherapie zu geben. Aber sie zeigen, wie wirksam dieses Medikament ist.
Können Sie uns bitte über die Ergebnisse der Studie BERINGMELANOMA berichten?
C. Höller: Die BERINGMELANOMA-Studie ist eine wichtige nicht interventionelle Studie, die an österreichischen, deutschen und Schweizer Zentren durchgeführt wird und die Gabe von Encorafenib plus Binimetinib im „Real-life“-Setting untersucht. Beim ASCO-Kongress wurde die Auswertung der ersten 100 Patienten als Poster vorgestellt. Die Patientenpopulation dieser Studie schließt deutlich mehr prognostisch schlechte Patienten ein als typische Zulassungsstudien. Das umfasst mehr Patienten mit Hirnmetastasen, hoher LDH oder einer höheren Tumorlast. Und dennoch sind die ersten Ergebnisse mit denen der COLUMBUS-Studie vergleichbar. Die mediane Behandlungsdauer der Patienten betrug ungefähr 12,7 Monate.8 Man könnte sagen, die BERINGMELANOMA-Studie bestätigt die COLUMBUS-Daten in einer Real-World-Population.
Zur adjuvanten PD-1-Immuntherapie beim Melanom im Stadium III wurde die EORTC-1325/KEYNOTE-054-Studie vorgestellt. Wie beurteilen Sie die Ergebnisse?
C. Höller: EORTC 1325/KEYNOTE-054 verglich in diesem Setting Pembrolizumab gegen Placebo. Für diejenigen Patienten, die unter Placebo progredient wurden, war ein Cross-over in den Pembrolizumab-Arm möglich. Der Fokus der Präsentation auf dem ASCO-Kongress lag auf dem Outcome genau dieser Patienten. Von 505 Patienten im Placeboarm wurden 298 progredient. 155 davon nahmen die Möglichkeit des Cross-overs wahr. Leider gab es keine Daten zu der anderen Hälfte, die nicht in den Pembrolizumab-Arm wechselte. Wir wissen daher leider nicht, warum diese nicht in der Studie geblieben sind und ob und welche andere Therapie sie erhalten haben, auch wenn das natürlich interessant wäre.
Bei der Cross-over-Gruppe betrug die PFS-Rate nach 36 Monaten 32%, das mediane PFS lag bei 8,5 Monaten. Das entspricht genau den Erwartungen bei einer PD-1-Antikörper-Therapie bei nicht vorbehandeltem, metastasiertem Melanom.
Patienten, die in der Studie ein Jahr Pembrolizumab erhalten hatten und danach zumindest ein halbes Jahr tumorfrei geblieben waren, konnten bei einem Rezidiv erneut Pembrolizumab als Studienmedikation erhalten. Diese Gruppe umfasste insgesamt 20 Patienten. Hier betrug das mediane PFS nur vier Monate, was veranschaulicht, dass auch Patienten, die eine adjuvante Therapie mit einem PD-1-Antikörper erhalten haben, nach einem Progress nicht mehr gut auf diese Therapie ansprechen.9 Das war für mich der springende Punkt der Präsentation. Diesen Patienten muss man entweder Nivolumab plus Ipilimumab geben oder bei einer BRAF-Mutation eine Kombination aus BRAF- und MEK-Inhibitor bzw. in Zukunft bei entsprechender Zulassung einen LAG3-Antikörper in Kombination mit einem PD-1-Antikörper.
Ergebnisse zu Lifileucel, einer autologen TIL-Therapie, wurden präsentiert. Was ist von dieser Therapie zu erwarten?
C. Höller: In dieser Phase-II-Studie wurde Lifileucel bei 66 Patienten, die nicht oder nicht mehr auf PD-1-Antikörper ansprachen, untersucht. Wenn eine BRAF-Mutation vorlag, mussten die Patienten zuvor auch eine BRAF-/MEK-Inhibitor-Therapie erhalten haben. Für die Herstellung von Lifileucel wird das operativ entnommene Tumorpräparat an ein zentrales Labor geschickt. Innerhalb des festgelegten Zeitrahmens von drei Wochen werden die tumorinfiltrierenden Lymphozyten extrahiert, expandiert, eingefroren und retourniert. Der Patient erhält nach einer nicht myeloablativen Lymphodepletion die TIL-Therapie zusammen mit einer Interleukin-2-Infusion, die bis zu sechsmal wiederholt wird.
Die Ansprechrate in dieser Studie lag bei immerhin 36%, bei 3% kam es zu einer kompletten Remission. Die mediane Ansprechdauer war nach 33 Monaten Nachbeobachtung noch nicht erreicht. Die auftretenden Nebenwirkungen waren im Wesentlichen auf die vorbereitende Chemotherapie mit Cyclophosphamid und Fludarabin zurückzuführen. Darüber hinaus zeigte sich eine gute Verträglichkeit von Lifileucel. Mit dieser Therapie kann man also bei einem Teil der Patienten die Tumorimmunität noch einmal effektiv aktivieren.10
Zu LEAP-004 gab es ein Update beim ASCO, wie beurteilen Sie diese Daten?
C. Höller: Diese Studie wurde das erste Mal letztes Jahr beim Jahreskongress der European Society of Medical Oncology (ESMO) vorgestellt und hat recht strenge Einschlusskriterien: Die Patienten mussten entweder unter laufender PD-1-Antikörper-Therapie progredient werden oder maximal zwölf Wochen nach Ende der Therapie. 103 Patienten wurden eingeschlossen und erhielten alle drei Wochen 200mg Pembrolizumab plus 20mg Lenvatinib einmal täglich. Die Patientenpopulation kann als sehr herausfordernd charakterisiert werden, da 55% eine erhöhte LDH aufwiesen, 20% sogar eine um mehr als das Doppelte erhöhte LDH. Zudem hatten 15% Hirnmetastasen in der Anamnese. Die Ansprechrate unter der Studienmedikation betrug dennoch 21,4%. Einzelne Patienten erreichten sogar eine komplette Remission. Die Krankheitskontrollrate betrug 66% und nach neun Monaten waren 36% der Patienten progressionsfrei.11 Aufs Erste klingt das vielleicht wenig, aber man muss sich vor Augen halten, wie schwierig die Ausgangssituation dieser Patienten war. Vor diesem Hintergrund finde ich das Ergebnis durchaus respektabel.
Welche Therapieoptionen mit bispezifischen Molekülen gibt es beim Aderhautmelanom?
C. Höller: Das Aderhautmelanom könnte man als den Dorn in unserer Seite betrachten, da es im Gegensatz zum kutanen Melanom auf Immuntherapien sehr schlecht anspricht. Das liegt darin begründet, dass es eine sehr niedrige Mutationsrate aufweist und häufig in die Leber metastasiert. Dort gestaltete sich eine Immunaktivierung schwierig, da die Leber über viele Mechanismen verfügt, genau das zu bremsen.
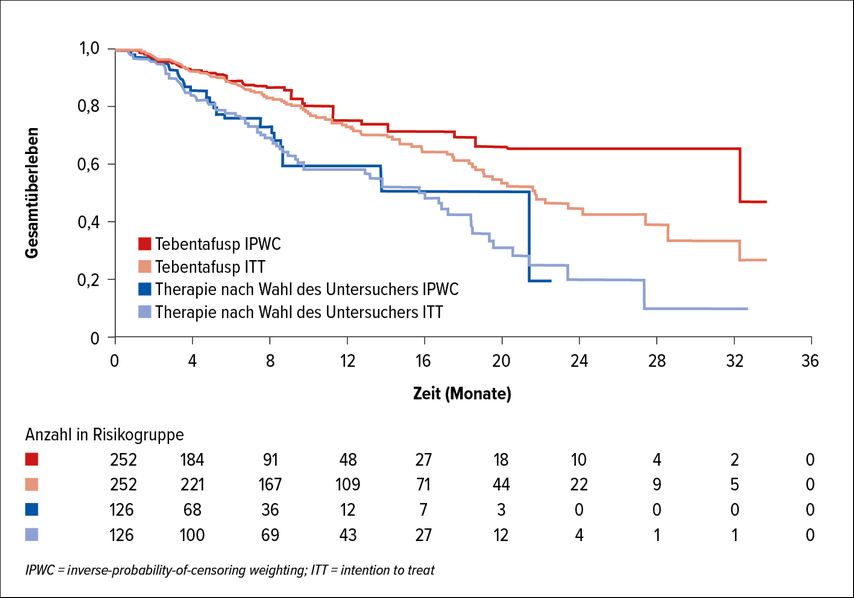
Tebentafusp ist ein bispezifisches Molekül, das zum einen einen Rezeptor für GP100 hat, ein Tumorantigen auf Melanomzellen. Zum andern bindet es an CD3 auf T-Zellen, sodass dieses Molekül in der Lage ist, T-Zellen an die Tumorzelle zu binden. Das bewirkt eine bessere T-Zell-Antwort direkt an der Tumorzelle. Im Rahmen der Phase-III-Studie IMCgp100-202 wurden 252 Patienten zur Therapie mit Tebentafusp und 126 zu einer Therapie nach „investigator’s choice“, entweder Chemotherapie, Ipilimumab oder Pembrolizumab, randomisiert. Unter Tebentafusp kam es in 9% der Fälle zu einem formalen Ansprechen und in 37% zu einer Krankheitsstabilisierung. Im Kontrollarm lag die Ansprechrate bei 5%, 22% der Patienten erreichten eine Krankheitsstabilisierung. Die Hazard-Ratio für das progressionsfreie Überleben lag bei 0,73. Der Effekt auf das Gesamtüberleben war jedoch noch stärker und das OS zeigte sich als zum Teil abgekoppelt vom PFS. Das bedeutet, dass die Patienten eindeutig davon profitierten, auch wenn der Effekt einer weiteren Behandlung nach Progression rausgerechnet wurde (Abb. 3).12
Abb. 3: Gesamtüberleben unter Tebentafusp vs. Therapie nach Wahl des Untersuchers in der
ITT-Population und IPWC-adaptiert (nach Orloff et al.)12
Auch wenn die Ansprechrate mit 9% unter Tebentafusp nach nicht viel klingt, muss man sich vor Augen halten, dass beim Aderhautmelanom die Ansprechrate auf Checkpoint-Inhibitoren im Bereich von 3–4% liegt. Zwar gibt es dazu keine formale Studie, aber in größeren Sicherheitsstudien zu PD-1-Antikörpern, welche auch den Einschluss dieser Patienten erlaubten, konnte man beobachten, dass das Aderhautmelanom auf diese Medikamente nur schlecht anspricht. Insofern ist eine Krankheitskontrollrate von 46% mit Tebentafusp sehr positiv zu bewerten.
Gibt es noch weitere neue Therapiemöglichkeiten für das Aderhautmelanom?
C. Höller: Eine weitere Studie zum Aderhautmelanom war die FOCUS-Studie, an der auch die Kollegen aus Graz beteiligt waren. Hier wird mit einem speziellen Katheter die Leber vom Blutkreislauf abgekoppelt und mit Melphalan perfundiert. Wobei natürlich bei der FOCUS-Studie wesentlich ist, dass die Patienten eine vorwiegende oder isolierte Lebermetastasierung haben, weil es natürlich nur vor Ort in der Leber wirkt. Typischerweise metastasiert das Aderhautmelanom aber zu Beginn in die Leber. Für diese Therapie darf die Leber aber nicht zu mehr als 50% von Metastasen durchsetzt sein.
Zu Beginn der Studie gab es einen Kontrollarm, in dem verschiedene Wirkstoffe als „investigator’s choice“ verabreicht werden konnten, aufgrund der schleppenden Rekrutierung wurde sie im Verlauf jedoch auf eine einarmige Studie umgestellt. Die Patienten konnten bis zu sechs hepatische Perfusionen mit Melphalan im Abstand von 6–8 Wochen erhalten. 91 Patienten erhielten die Perfusionstherapie. Die Ansprechrate betrug 32,9% vs. 13,8% im initialen Kontrollarm, in dem Immuntherapie, arterielle Chemoembolisation oder Chemotherapie angewendet wurde. Hochinteressant ist, dass es bei sechs Patienten im Perfusionsarm zu einer kompletten Remission kam. Das gibt es beim Aderhautmelanom fast nie. Bei 25% kam es zu einer partiellen Remission, bei 36% wurde eine Krankheitsstabilisierung erreicht. Das mediane PFS lag bei 9 Monaten.13 Die Behandlung ist zwar recht aufwendig, da es ein gutes Set-up mit Anästhesie und Operateur benötigt. Prinzipiell haben wir aber mit dieser Therapie eine neue Option für eine Patientenpopulation, für die es ansonsten nicht viel gibt. Da diese Gruppe so klein ist, haben wir uns in Österreich bewusst entschieden, die Therapie an einem Zentrum, und zwar in Graz, zu bündeln, wo sie auch weiterhin im Rahmen eines „named patient program“ angeboten wird.
Insgesamt kann man sagen, dass es auch für so schwer behandelbare Entitäten wie das Aderhautmelanom beim diesjährigen ASCO-Kongress sehr spannende Daten gab.
Vielen Dank für das Gespräch!
Literatur:
1 Lipson EJ et al.: Relatlimab (RELA) plus nivolumab (NIVO) versus NIVO in first-line advanced melanoma: primary phase III results from RELATIVITY-047 (CA224-047). ASCO 2021, Abstr. #9503 2 Amaria RN et al.: Neoadjuvant and adjuvant nivolumab (nivo) with anti-LAG3 antibody relatlimab (rela) for patients (pts) with resectable clinical stage III melanoma. ASCO 2021, Abstr. #9502 3 Hamid O et al.: Clinical activity of fianlimab (REGN3767), a human anti-LAG-3 monoclonal antibody, combined with cemiplimab (anti-PD-1) in patients (pts) with advanced melanoma. ASCO 2021, Abstr. #9515 4 Wolchok JD et al.: CheckMate 067: 6.5-year outcomes in patients (pts) with advanced melanoma. ASCO 2021, Abstr. #9506 5 Lebbe C et al.: Two dosing regimens of nivolumab (NIVO) plus ipilimumab (IPI) for advanced (adv) melanoma: three-year results of CheckMate 511. ASCO 2021, Abstr. #9516 6 Long GV et al.: Five-year overall survival from the anti-PD1 brain collaboration (ABC Study): Randomized phase 2 study of nivolumab (nivo) or nivo+ipilimumab (ipi) in patients (pts) with melanoma brain metastases (mets). ASCO 2021, Abstr. #9508 7 Dummer R et al.: Five-year overall survival (OS) in COLUMBUS: a randomized phase 3 trial of encorafenib plus binimetinib versus vemurafenib or encorafenib in patients (pts) with BRAF V600-mutant melanoma. ASCO 2021, Abstr. #9507 8 Richtig E et al.: Encorafenib plus Binimetinib in patients with locally advanced, unresectable or metastatic BRAFV600-mutant melanoma: First data of the multicenter, multinational, prospective, non-interventional longitudinal study BERINGMELANOMA. ASCO 2021, Abstr. #9555 9 Eggermont AM et al.: Crossover and rechallenge with pembrolizumab in recurrent patients from the EORTC 1325-MG/Keynote-054 phase 3 trial, pembrolizumab versus placebo after complete resection of high-risk stage III melanoma. ASCO 2021, Abstr. #9500 10 Larkin J et al.: Lifileucel (LN-144), a cryopreserved autologous tumor infiltrating lymphocyte (TIL) therapy in patients with advanced melanoma: evaluation of impact of prior anti-PD-1 therapy. ASCO 2021, Abstr. #9505 11 Arance AM: Lenvatinib (len) plus pembrolizumab (pembro) for patients (pts) with advanced melanoma and confirmed progression on a PD-1 or PD-L1 inhibitor: updated findings of LEAP-004. ASCO 2021, Abstr. #9504 12 Orloff M et al.: Overall survival in patients who received checkpoint inhibitors after completing tebentafusp in a phase 3 randomized trial of first-line metastatic uveal melanoma. ASCO 2021, Abstr. #9526 13 Zager JS et al.: Percutaneous hepatic perfusion (PHP) with melphalan for patients with ocular melanoma liver metastases: preliminary results of FOCUS (PHP-OCM-301/301A) phase III trial. ASCO 2021, Abstr. #9510
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...