Die Behandlung des oligometastatischen Kolonkarzinoms
Autorin:
Dr. med. Michèle Voegeli
Leitende Ärztin Onkologie
Medizinische Universitätsklinik
Kantonsspital, Liestal
E-Mail: michele.voegeli@ksbl.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Kolonkarzinom ist der dritthäufigste maligne Tumor beim Mann, der zweithäufigste Tumor bei der Frau sowie die dritthäufigste Krebstodesursache in der Schweiz. Trotz der empfohlenen Screening-Koloskopie ab 50 Jahren wird die Erkrankung leider häufig erst im fortgeschrittenen Stadium entdeckt. Oft kommt es auch nach der Operation des Primärtumors zu einem Rezidiv. Immetastasierten Stadium ist die Prognose mit alleiniger Chemotherapie nach wie vor schlecht. Dieser Artikel soll das interdisziplinäre Management der oligometastatischen Erkrankung und die kurativen Möglichkeiten beimmetastasierten Kolonkarzinom aufzeigen.
Keypoints
-
Das interdisziplinäre Management beim metastasierten kolorektalen Karzinom ist für das Outcome entscheidend.
-
Biologische und prognostische Faktoren (Lymphknotenmetastasen, metachrone Erkrankung, langes erkrankungsfreies Intervall, hoher Tumormarker) helfen bei der Entscheidung, ob ein lokales Verfahren trotz Metastasierung mit kurativer Intention durchgeführt werden kann.
-
Biomarker wie ctDNA, KRAS- oder BRAF-Mutation und MSI sind ebenfalls hilfreich bei der Entscheidungsfindung.
Etwa 50% der Patienten mit Darmkrebs haben bei Diagnose Metastasen oder entwickeln diese im Laufe der Erkrankung. Werden diese diagnostiziert, wenn sie noch ein limitiertes Ausmass haben, besteht die Möglichkeit für ein kuratives Vorgehen.
Oligometastasierung: Was ist das?
Das Konzept der Oligometastasierung (OMD) wurde bereits 1995 von Hellmann und Weichselbaum eingeführt.1 Sie beschrieben damals Patienten mit Lungenmetastasen, vorwiegend von Weichteilsarkomen, Osteosarkomen und Nierenzellkarzinomen, die durch komplette Resektion geheilt wurden. Schon damals wurde eine Serie mit 859 Leberresektionen bei kolorektalen Tumoren erwähnt, bei denen die Operation zu einer Rate krankheitsfreien Überlebens von 25% über fünf Jahre führte –und dies vor der Ära der modernen Bildgebung und vor Einführung von effizienten Systemtherapien mit Wirkstoffen wie Oxaliplatin, Irinotecan oder den Biologika. Hellmann und Weichselbaum beschrieben die Oligometastasierung als Zwischenstadium zwischen lokalisiertem Tumor und einer systemischen Erkrankung.
In der Regel wird als Oligometastasierung bei kolorektalen Tumoren eine Erkrankung mit bis zu fünf Metastasen in maximal zwei Organen beschrieben. Die Metastasen sind viszeral oder gelegentlich auch lymphonodal.2 Typische Lokalisationen sind Leber, Lunge, Peritoneum und Ovarien. Die OMD muss aber vor allem einer radikalen Behandlungsstrategie zugänglich sein, um die Definition zu erfüllen.
Die Standarduntersuchung bei Verdacht auf eine Metastasierung ist eine Computertomografie (CT) von Thorax und Abdomen und falls relevant ergänzend eine Magnetresonanztomografie (MRT) und eine Positronenemissionstomografie(PET-)CT.
Es ist wichtig, zwischen einer «echten» und einer «falschen» Oligometastasierung zu unterscheiden. Bei der «echten» Oligometastasierung besteht eine langsam wachsende Erkrankung in einem relativen Steady-State. Hier macht ein lokales Verfahren Sinn. Bei einer «falschen» Oligometastasierung handelt es sich um eine Erkrankung mit einer okkulten Systemerkrankung, bei der zum Zeitpunkt der Diagnose nur eine limitierte Anzahl Metastasen detektierbar ist. Bei diesem Szenario ist eine Systemtherapie indiziert. Die Unterscheidung ist nicht immer einfach. Im Zweifelsfall soll eine Verlaufsbildgebung (mit und ohne Chemotherapie) nach zwei bis drei Monaten erfolgen.
Lokales Vorgehen: ja oder nein?
Für die Entscheidung für oder gegen ein lokales Vorgehen ist es wichtig, die prognostischen Faktoren zu kennen.3
Bei Vorliegen günstiger Faktoren macht ein lokales Verfahren Sinn und die Wahrscheinlichkeit eines Nutzens ist gross. Günstige biologische/prognostische Faktoren sind:
-
eine einzelne Läsion
-
eine metachrone Metastasierung
-
ein langes krankheitsfreies Intervall (>1Jahr)
-
ein gutes Ansprechen auf eine Systemtherapie
Sind ungünstige prognostische Faktoren vorhanden, sollte ein lokales Verfahren sorgsam abgewogen werden, da der Nutzen eher fraglich ist. Hier lohnt es sich, mit einer Chemotherapie zu starten und nach einigen Monaten ein Restaging vorzunehmen. Besteht keine Progression, kann anschliessend ein lokales Verfahren durchgeführt werden. Schlechte prognostische Faktoren sind:
-
zahlreiche Metastasen
-
synchrone Metastasen
-
kurzes krankheitsfreies Intervall
-
Progression während einer Systemtherapie
Jeder Patient muss vor Beginn einer Therapie bei einer interdisziplinären Tumorkonferenz vorgestellt werden. Bei den zertifizierten Darmkrebszentren in der Schweiz ist dies eine Vorgabe. Es gilt, die Entscheidung für ein lokales Verfahren im Kontext von technischen Möglichkeiten, von krankheitsbedingter Prognose und den nicht tumorbedingten Faktoren wie Komorbidität zu sehen.
Chemotherapie: nicht immer indiziert
Ob vor einer Operation eine Chemotherapie durchgeführt werden muss, ist abhängig von der Komplexität des Eingriffs und davon, ob ungünstige Faktoren vorliegen. In der Regel wird bei einer metachronen Erkrankung mit guter Resektabilität direkt eine Operation durchgeführt und allenfalls danach eine adjuvante/additive Chemotherapie in Angriff genommen.
Beim Rektumkarzinom ist die Situation komplexer. Hier wird in der Regel eine kurze Radiotherapie über fünf Tage durchgeführt (5x5Gy), gefolgt von einer Chemotherapie nach dem FOLFOX-Schema (Folinsäure, 5-Fluorouracil und Oxaliplatin). In Situationen, in denen eine starke Tumorschrumpfung nötig ist, wird die am besten geeignete Polychemotherapie mit einem Biologikum vor der Operation durchgeführt.
Die Resektion und das Outcome
Die meisten Studien bezüglich der Metastasenresektion beziehen sich auf die Lebermetastasierung. Die Frage, ob bei einer synchronen Metastasierung zuerst der Primärtumor oder die Lebermetastasen operiert werden sollen, entscheidet sich anhand der Tumorlast. Bei multiplen bilobären Metastasen sprechen die Daten für die Liver-first-Strategie.4
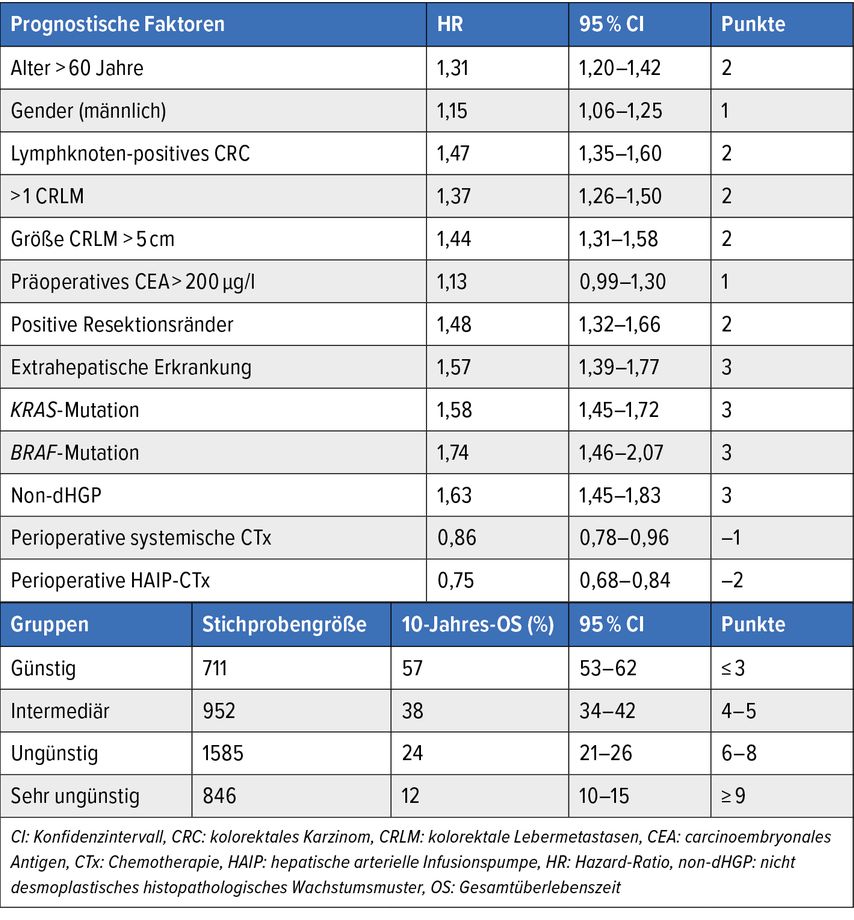
Zum Langzeit-Outcome nach Metastasenresektion in der Leber wurden vor Kurzem Studiendaten publiziert.5 Risikofaktoren für ein schlechtes Outcome waren (Tab. 1):
-
Alter über 60 Jahre
-
männliches Geschlecht
-
nodal-positiver Primärtumor
-
mehr als eine Metastase
-
Metastasen >5cm
-
hoher präoperativer Tumormarker (CEA>200μg/l)
-
positive Tumorränder
-
extrahepatische Erkrankung
-
molekulare Faktoren wie BRAF- oder KRAS-Mutation
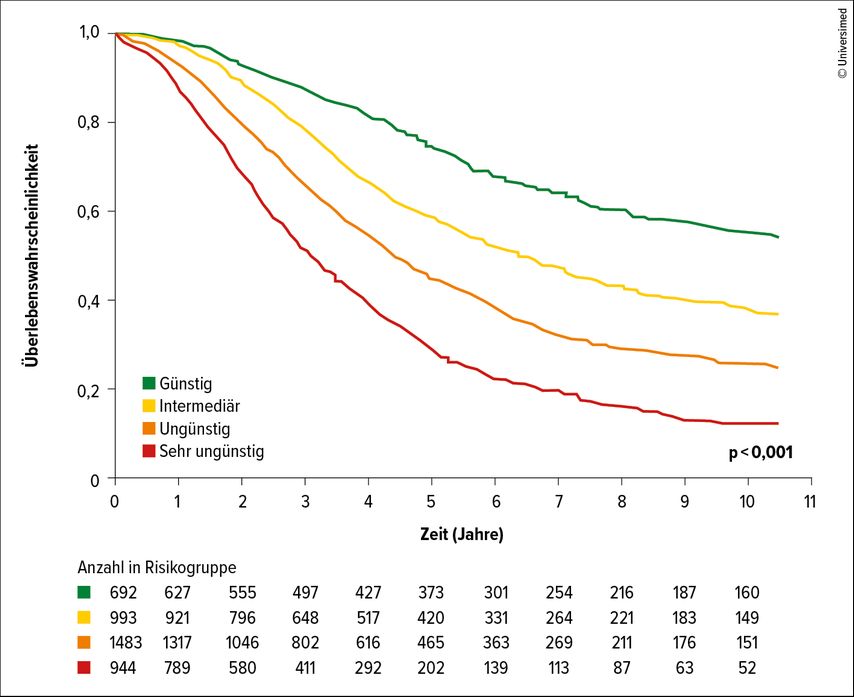
Je nach Anzahl negativer Faktoren schwankte die Langzeitüberlebensrate zwischen 10% und 60% (Abb. 1).
Bezüglich Lungenmetastasen sind die Daten leider nicht so gut wie für die Behandlung der Lebermetastasen. Die jahrelange Praxis, solitäre Lungenmetastasen zu operieren, beruht auf unkontrollierten Beobachtungsstudien. Die grösste Studie (PulMicc) ergab keinen Benefit einer lokalen Behandlung vs. eine Systemtherapie. Bei dieser Datenlage besteht Bedarf an einer Verbesserung.9
Alternativen
Für die nicht chirurgischen, lokal ablativen Verfahren liegen die Daten der SABR-COMET-Studie vor, welche die stereotaktisch ablative Radiotherapie (SABR) untersucht hat.6 Es handelt sich um eine Phase-II-Studie, die verschiedene Primärtumoren eingeschlossen hat. Vertreten waren hauptsächlich Tumoren in Prostata, Mamma und Lunge. Im Arm mit stereotaktisch ablativer Therapie waren nur 14% kolorektale Tumoren. Bei den behandelten Metastasen handelte es sich um Lungen-, Skelett-, Leber- und Nebennierenmetastasen. Das Ergebnis der gesamten Gruppe fiel klar zugunsten der SABR-Gruppe aus (medianes Überleben 41 vs. 28 Monate).
Die zweite nicht chirurgische Studie ist die CLOCC-Studie, ebenfalls eine Phase-II-Studie, welche eine konventionelle Systemtherapie vs. Radiofrequenzablation (RFA) untersuchte.7 Hier wurden nur Patienten mit nicht resezierbaren Lebermetastasen von kolorektalen Tumoren eingeschlossen. Die 5-Jahres- und 8-Jahres-Überlebensrate fiel klar zugunsten der RFA aus (43% vs. 30% und 35% vs. 9%).
Die kombinierte Analyse von drei Phase-III-Studien, welche die selektive interne Radiotherapie (SIRT) in Kombination mit einer Systemtherapie in der ersten Linie untersucht haben, ergab keinen Vorteil für eine SIRT gegenüber einer alleinigen Chemotherapie.8
Prognostik und der Blick in die Zukunft
Für das Outcome gibt es verschiedene prognostische Biomarker. Die zirkulierende Tumor-DNA (ctDNA) scheint auch in diesem Setting prognostisch zu sein. Weitere biologische Marker sind RAS- und BRAF-Mutationen und Mikrosatelliteninstabilität (MSI). Prognostisch schlecht sind auch kombinierte Mutationen wie z.B. von APC/PIK3CA oder KRAS/TP53.
In den vergangenen Jahren haben wir vieles über die oligometastasierte Erkrankung gelernt. Die Behandlung ist komplex und muss in einem interdisziplinären Team stattfinden. Die neuesten Erkenntnisse müssen in die Behandlung einfliessen. In einem idealen Setting und bei positiven biologischen Faktoren liegt die Langzeitüberlebensrate bei über 50%.
Das oberste Ziel sollte aber weiterhin die Verhinderung der oligometastatischen Erkrankung durch regelmäßiges Screening resp. die Früherfassung sein.
Literatur:
1 Hellman S, Weichselbaum RR: Oligometastases. J Clin Oncol 1995; 13(1): 8-10 2 Van Cutsem E et al.: ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol 2016; 27(8): 1386-422 3 Arnold D, Harrison M: Oligometastatic disease in gastrointestinal cancers. ESMO library 2021 4 Giuliante F et al.: Liver-first approach for synchronous colorectal metastases: analysis of 7360 patients from the LiverMetSurvey registry. Ann Surg Oncol 2021; 28(13): 8198-208 5 Buisman FE et al.: Predicting 10-year survival after resection of colorectal liver metastases; an international study including biomarkers and perioperative treatment.Eur J Cancer 2022; 168: 25-33 6 Palma DA: Stereotactic ablative radiotherapy versus standard of care palliative treatment in patients with oligometastatic cancers (SABR-COMET): a randomised, phase 2, open-label trial. Lancet 2019; 393(10185): 2051-8 7 Ruers T: O-018 Radiofrequency ablation (RFA) combined with chemotherapy for unresectable colorectal liver metastases (CRC LM): Long-term survival results of a randomised phase II study of the EORTC-NCRI CCSG-ALM Intergroup 40004 (CLOCC). Ann Oncol 2015; 26(4): IV114 8 Wasan HS et al.: First-line selective internal radiotherapy plus chemotherapy versus chemotherapy alone in patients with liver metastases from colorectal cancer (FOXFIRE, SIRFLOX, and FOXFIRE-Global): a combined analysis of three multicentre, randomised, phase 3 trials. Lancet Oncol 2017; 18(9): 1159-71 9 Treasure T et al.: Pulmonary metastasectomy versus continued active monitoring in colorectal cancer (PulMiCC): a multicentre randomised clinical trial. BMC 2019; Trial #20
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...