Der Sialoglykan-Siglec Glyko-Immuncheckpoint
Medizinische Onkologie, Universitätsspital Basel,<br>und Labor für Immuntherapie<br>Department Biomedizin<br>Universität Basel<br>E-Mail: heinz.laeubli@unibas.ch
Immuncheckpoint-Inhibitoren haben die Krebstherapie revolutioniert und bei einem Teil unserer Patienten zu einem langfristigen Ansprechen geführt. Um die Vorzüge der Immuntherapie noch mehr Patienten zugänglich zu machen, werden aktuell viele neue Immuncheckpoints untersucht. Glyko-Immuncheckpoints sind besonders, da sie Interaktionen von inhibitorischen Rezeptoren mit Zuckerstrukturen (Glykanen) beinhalten. Die Unterbindung von Interaktionen von Sialoglykanen mit inhibitorischen Siglec-Rezeptoren zeigen in präklinischen Untersuchungen besonders vielversprechende Resultate. Erste klinische Studien mit blockierenden Antikörpern gegen Siglecs demonstrieren zudem eine antitumoröse Aktivität.
Keypoints
-
Viele Tumoren zeigen eine starke Aufregulierung von Sialinsäure-haltigen Zuckern (Sialoglykanen) auf den Krebszellen und im Tumormilieu.
-
Diese Sialoglykane können durch immunmodulatorische Rezeptoren, die Siglecs, gebunden werden. Diese Interaktion dient im Gesunden einer Verhinderung einer überschiessenden Immunantwort und ist somit ein Immuncheckpoint.
-
Krebszellen können den Glyko-Immuncheckpoint zwischen Sialoglykanen und Siglecs ausnutzen und so das Immunsystem inhibieren.
-
Therapeutisch kann der Sialoglykan-Siglec-Glyko-Immuncheckpoint mit blockierenden Antikörpern oder auch Enzymen wie Sialidasen angegangen werden, die zielgerichtet in den Tumor eingebracht werden.
Was ist ein Glyko-Immuncheckpoint?
In den vergangenen Jahren konnte die Prognose von vielen Tumorpatienten mit der Einführung von Immuncheckpoint-Inhibitoren, welche die inhibitorischen Rezeptoren CTLA-4 («cytotoxic T-lymphocyte associated protein» 4) und PD-1 («programmed death» 1) oder den Liganden PD-L1 hemmen, deutlich vebessert werden.1–4 Leider profitiert aber nur eine Minorität der Patienten von einem langfristigen Ansprechen auf die aktuellen Immuncheckpoint-Inhibitoren. Aus diesem Grund werden aktuell viele verschiedene neue inhibitorische Rezeptoren oder Immuncheckpoints wie z.B. LAG3 («lymphocyte-activation gene» 3) oder TIM-3 («T-cell immunoglobulin»-3) auf Immunzellen therapeutisch angegangen. Alle diese Checkpoints interagieren mit Proteinliganden (PD-1 mit PD-L1 und PD-L2). Neue vielversprechende Immuncheckpoints sind Siglec («sialic acid-binding Ig-like lectin»)-Rezeptoren, welche nicht Proteine, sondern Zuckerstrukturen auf Tumorzellen binden.5,6
Während der Tumorentstehung werden die Zuckerstrukturen auf Tumorzellen stark verändert.7 Eine wichtige Veränderung ist die starke Aufregulierung von Sialinsäure-haltigen Zuckern, sogenannten Sialoglykanen, auf Krebszellen und im extrazellulären Milieu des Tumors.8 Siglecs können diese Sialoglykane binden und ähnlich wie bei anderen Immuncheckpoints wird ein intrazelluläres, meistens inhibitorisches Signal an die Immunzelle übermittelt (Abb.1). Interessanterweise ist die Struktur sehr ähnlich wie die des Immuncheckpoints PD-1. Es gibt eine extrazelluläre Domäne, die den Liganden – in diesem Falle der Siglec-Rezeptoren Sialoglykane – erkennt, dann eine transmembranäre Domäne und eine intrazelluläre Domäne, welche nach Bindung der Liganden phosphoryliert wird und dann so die Phosphatasen SHP («Src homology 2-containing protein tyrosine phosphatase») 1 und 2 rekrutieren kann, welche die Immunaktivierung bremsen können. Im Gegensatz zu PD-1 gibt es aber eine ganze Familie von Siglec-Rezeptoren (Tab. 1). Im Menschen existieren 14 verschiedene funktional aktive Siglecs. Prinzipiell können zwei Arten von Siglec-Rezeptoren unterschieden werden. Es gibt inhibitorische Siglecs und aktivierende Siglecs, wobei inhibitorische Siglecs deutlich in der Mehrheit sind (Tab.1).5
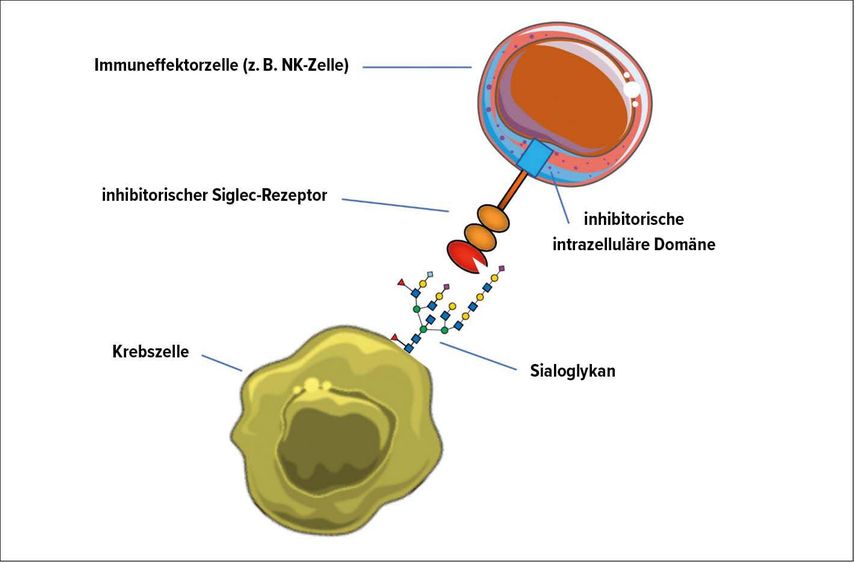
Abb. 1: Siglec-Rezeptoren und Interaktion. Die Abbildung zeigt, wie inhibitorische Siglecs Sialoglykan-Liganden auf der Krebszelloberfläche binden und so Effektorzellen (z.B. T-Zellen oder Natural-Killer-Zellen) hemmen können. Sialoglykan-Liganden können nicht nur auf der Krebszelloberfläche, sondern auch im Tumormilieu extrazellulär auf Glykoproteinen (z.B. Muzinen) oder sogar auf der Effektorzelle selbst (in Cis) sein
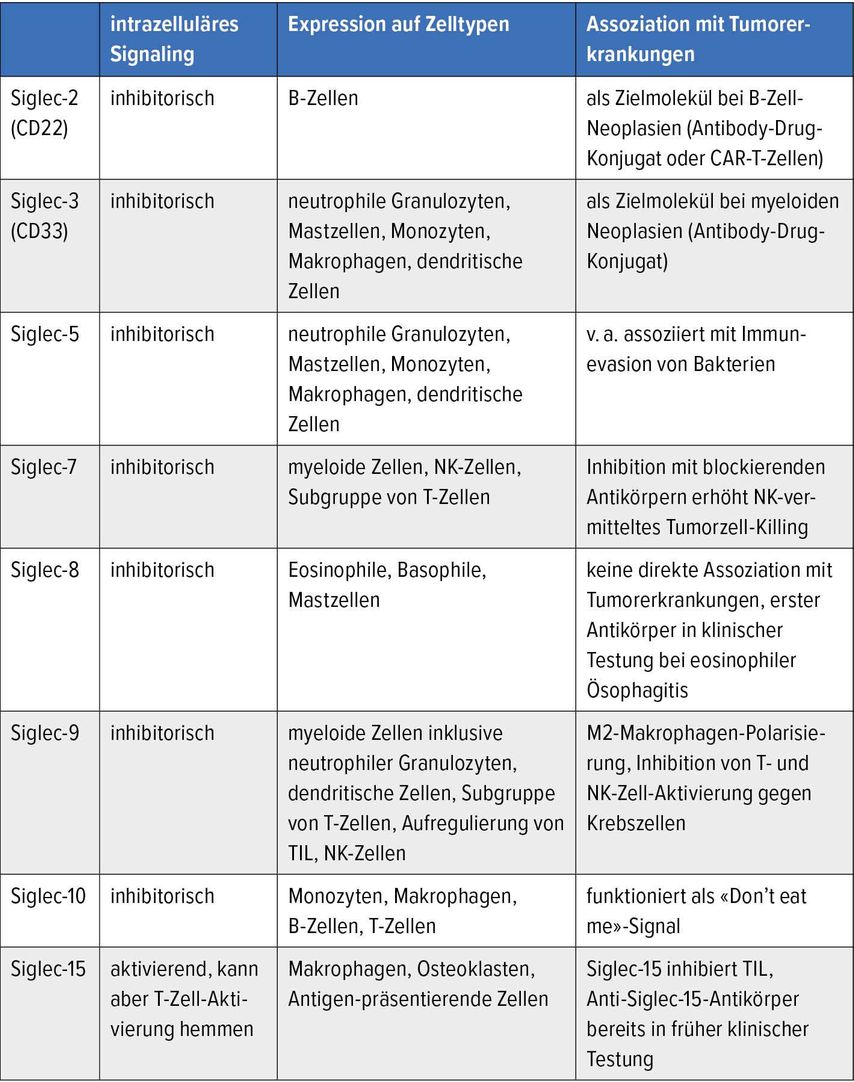
Tab. 1: Wichtigste Siglec-Rezeptoren im Zusammenhang mit Tumorerkrankungen
Die physiologische Funktion von Siglec-Rezeptoren besteht darin, die Immunhomöostase aufrechtzuerhalten, d.h. wie andere Immuncheckpoints überschiessende Immunreaktionen abzufangen.9 Einige Pathogene wie zum Beispiel Streptokokken haben sich diesen Mechanismus zunutze gemacht und bilden entweder selber Sialoglykane oder sogar Proteinliganden, die an Siglecs binden können.9 Das hat zur evolutiven Entwicklung von aktivierenden Siglecs geführt, die vorwiegend auf der gleichen Immunzellpopulation vorkommen. Zum Beispiel binden Siglec-5 und Siglec-14 die gleichen Sialoglykan-Liganden, nur dass Siglec-5 myeloide Zellen hemmt und Siglec-14 diese aktiviert.
Bindung von Sialoglykanen an Siglecs vermittelt «immune escape»
Ähnlich wie Siglec-bindende Pathogene können Tumor-assoziierte Sialoglykane inhibitorische Siglecs binden und so einen «Immune escape»-Mechanismus auslösen.5 Verschiedene Untersuchungen konnten zeigen, dass Sialoglykane auf Krebszellen die inhibitorischen Siglec-7 und Siglec-9 auf NK-Zellen binden können und so die NK-Zell-vermittelte Zytotoxizität vermindern.10 Siglec-9 auf Makrophagen kann über eine Bindung mit Sialoglykanen auf Tumor-assoziierten Muzinen eine protumorigene Polarisation hervorrufen und Siglec-9 kann so das Tumorwachstum begünstigen sowie ein immunsuppressives Milieu schaffen.11 Zudem können Sialoglykane auf Krebszellen Siglec-10 auf Makrophagen binden und so die Phagozytose hemmen, ähnlich der CD47-SIRP-alpha-Interaktion, welche als «Don’t eat me»-Signal dient.12 Wir konnten zudem zeigen, dass tumorinfiltrierende T-Zellen Siglec-9 aufregulieren und Sialoglykane so über die Bindung von Siglec-9 tumporspezifische T-Zell-Antworten hemmen.13 In einer anderen Studie wurde Siglec-15 als T-Zell-Inhibitor identifiziert.14
Angriffspunkt für Immuntherapie
Wie kann nun der Sialoglykan-Siglec-Glyko-Immuncheckpoint therapeutisch angegangen werden? Eine Möglichkeit sind blockierende Antikörper, welche die Siglec-Rezeptoren blockieren, gleich den bereits in der Klinik verfügbaren Immuncheckpoint-Inhibitoren gegen PD-1/PD-L1 oder CTLA-4. Alternativ kann der Sialoglykan-Siglec-Glyko-Immuncheckpoint mit Enzymen angegangen werden, die Sialinsäuren von den Zuckerstrukturen im Tumor entfernen. Mit solchen Tumor-gerichteten Sialidasen können die Sialoglykan-Liganden für die inhibitorischen Siglecs im Tumor reduziert werden. Da es 14 verschiedene Siglec-Rezeptoren im Menschen gibt, kann man mit diesem Vorgehen alle Interaktionen unterbinden. In einem Mausmodell konnten wir zeigen, dass wir mit einer systemisch applizierten Sialidase gekoppelt an Trastuzumab, welches gegen HER2 gerichtet ist, HER2-positive Tumoren erfolgreich desialidieren konnten.15 Interessanterweise konnte auch eine starke adaptive Immunantwort gegen den Tumor induziert werden. Natürlich gibt es bei einem solchen neuartigen Vorgehen auch Risiken. Obwohl in den präklinischen Untersuchungen keine schwere Toxizität gefunden wurde, wird es spannend, zu sehen, ob eine längere Exposition von Sialidasen in den geplanten Phase-I-Studie unerwartete Nebenwirkungen hervorbringen wird.
Ein blockierender Antikörper gegen Siglec-15 wurde bereits in frühen klinischen Studien getestet und zeigte in der Phase-I-Untersuchung ein akzeptables Sicherheitsprofil und auch bereits erste Hinweise auf eine Aktivität, wie an der Jahresversammlung der Society for Immunotherapy of Cancer (SITC) 2019 gezeigt wurde. Auch wurde ein Siglec-8blockierender Antikörper bei Patienten mit eosinophiler Ösophagitis erfolgreich in einer Phase I/II getestet.16 Auch wenn es sich hier nicht um Tumorpatienten handelt, zeigt dies, dass Antikörper gegen Siglecs erfolgreich entwickelt werden können.
Die kommenden Monate werden spannend sein, da weitere Präparate in klinische Studien eintreten werden. Vor allem wird es spannend sein, wenn in erstenStudien Sialidasen systemisch in Patienten appliziert werden.
Literatur:
1 Wei SC et al.: Fundamental mechanisms of immune checkpoint blockade therapy. Cancer Discov 2018; 8(9): 1069-86 2 Larkin J et al.: Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2019; 381(16): 1535-46 3 Hellmann MD et al.: Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med 2019; 381(21): 2020-31 4 Motzer RJ et al.: Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378(14): 1277-90 5 Barenwaldt A, Laubli H: The sialoglycan-Siglec glyco-immune checkpoint - a target for improving innate and adaptive anti-cancer immunity. Expert Opin Ther Targets 2019; 23(10): 839-53 6 Duan S, Paulson JC. Siglecs as immune cell checkpoints in disease. Annu Rev Immunol 2020; 38: 365-95 7 Rodrigues Mantuano N et al.: Tumor-associated carbohydrates and immunomodulatory lectins as targets for cancer immunotherapy. J Immunother Cancer 2020; 8(2): e001222 8 Pearce OM, Laubli H: Sialic acids in cancer biology and immunity. Glycobiology 2015; 26(2): 111-28 9 Laubli H, Varki A: Sialic acid-binding immunoglobulin-like lectins (Siglecs) detect self-associated molecular patterns to regulate immune responses. Cell Mol Life Sci 2020; 77(4): 593-605 10 Jandus C et al.: Interactions between Siglec-7/9 receptors and ligands influence NK cell-dependent tumor immunosurveillance. J Clin Invest 2014; 124(4): 1810-20 11 Beatson R et al.: The mucin MUC1 modulates the tumor immunological microenvironment through engagement of the lectin Siglec-9. Nat Immunol 2016; 17(11): 1273-81 12 Barkal AA et al.: CD24 signalling through macrophage Siglec-10 is a target for cancer immunotherapy. Nature 2019; 572(7769): 392-6 13 Stanczak MA et al.: Self-associated molecular patterns mediate cancer immune evasion by engaging Siglecs on T cells. J Clin Invest 2018; 128(11): 4912-23 14 Wang J et al.: Siglec-15 as an immune suppressor and potential target for normalization cancer immunotherapy. Nat Med 2019; 25(4): 656-66
15 Gray MA et al.: Targeted glycan degradation potentiates the anticancer immune response in vivo. Nat Chem Biol. 2020; doi: 10.1038/s41589-020-0622-x 16 Dellon ES et al.: Anti-Siglec-8 Antibody for Eosinophilic Gastritis and Duodenitis. N Engl J Med. 2020; 383(17): 1624-34
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


