Deeskalationsstrategien in der (neo)adjuvanten Chemotherapie
Autoren:
Dr. Simon Udovica
Priv.-Doz. OÄ Dr. Kathrin Strasser-Weippl, MBA
1. Medizinische Abteilung, Zentrum für Onkologie und Hämatologie, Klinik Ottakring, Wien
Korrespondenz:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der (neo)adjuvanten Therapie des frühen Mammakarzinoms steht uns eine Vielzahl an Therapieoptionen zur Verfügung, von zytostatischen Chemotherapeutika bis hin zu Antikörper-Wirkstoff-Konjugaten und PARP-Inhibitoren. Durch eine Verbesserung der Effektivität der systemischen Therapie konnten eine Reduktion der Rezidivraten und eine Verlängerung des Gesamtüberlebens erzielt werden. Generell wurden dabei aber die Therapiedauer, wie etwa die der adjuvanten endokrinen Therapie, sowie die Therapieintensität, wie etwa über dosisdichte Protokolle, erhöht.1 Damit einher geht eine höhere Rate an therapieassoziierten Risiken und Nebenwirkungen, sodass über Deeskalationsstrategien nachgedacht werden muss. In diesem Artikel möchten wir generelle Konzepte zur Therapiedeeskalation und zur besseren Patientinnenselektion sowie rezente Entwicklungen zur Deeskalation der systemischen Therapie im (neo)adjuvanten Setting des Mammakarzinoms beleuchten.
Therapiekonzepte und Studiendesigns zur Deeskalation
Im Optimalfall zeigt eine neue Therapie eine Verbesserung der Effektivität bei gleichbleibender oder geringerer Toxizität. Meist bedeutet jedoch eine Therapieeskalation (z.B. durch eine zusätzliche, neue Therapie), dass die höhere Effektivität zum Preis einer höheren Toxizität erkauft wird.
Im idealen Fall einer Therapiedeeskalation bleibt die Effektivität gleich, die Toxizität ist aber signifikant niedriger, sodass dafür auch eine minimal geringere Effektivität in Kauf genommen wird. Der Nachweis einer Äquivalenz oder einer als irrelevant betrachteten Unterlegenheit muss hierbei im Rahmen von Nichtunterlegenheitsstudien („non-inferiority trials“) erbracht werden.
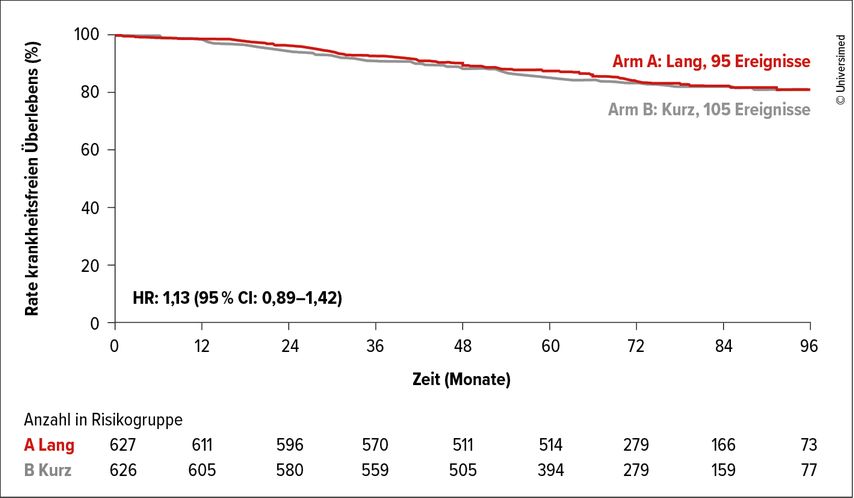
Diese Studien bedürfen spezieller statistischer Verfahren, der simple Nachweis eines „nicht signifikanten Unterschieds“ ist dabei nicht ausreichend. Prägnant kann dies mit dem Ausdruck „absence of evidence is not evidence of absence“ umschrieben werden.2 Exemplarisch für eine Nichtunterlegenheitsstudie sei hier die Short-HER-Studie genannt: Diese Studie untersuchte eine kurze Gabe von Trastuzumab (9 Wochen) verglichen mit der Standarddauer (12 Monate) in der adjuvanten Therapie des frühen HER2-positiven Mammakarzinoms. Eine Hazard-Ratio (HR) <1,29 hinsichtlich des krankheitsfreien Überlebens wurde als Maß für eine Nichtunterlegenheit gewählt.
Das krankheitsfreie Überleben über fünf Jahre betrug 85% im Studienarm vs. 88% im Kontrollarm, entsprechend einer HR von 1,13 (90% CI: 0,89–1,42). Nachdem das Konfidenzintervall die zuvor festgelegte Grenze von 1,29 überschritt, konnte daher eine Nichtunterlegenheit nicht gezeigt werden, obwohl der experimentelle (deeskalierte) Arm im Wesentlichen deckungsgleiche Ergebnisse lieferte (Abb.1).3
Abb. 1: Die Short-HER-Studie als Beispiel für eine Nichtunterlegenheitsstudie. Da das Konfidenzintervall die zuvor festgelegte Grenze von 1,29 überschritt, konnte eine Nichtunterlegenheit nicht gezeigt werden. Modifiziert nach Conte P et al.3
Ein potenzieller Nachteil von Nicht-unterlegenheitsstudien ist die hohe erforderliche Anzahl an randomisierten Patientinnen (um das Konfidenzintervall schmal zu halten), speziell wenn der experimentelle Arm möglicherweise eine geringere Effektivität aufweist.
Exemplarisch sei hier folgende Fallzahlberechnung aufgeführt: Bei einer angenommenen geringeren Effektivität des experimentellen Studienarms (62% vs. 60%) und einer akzeptierten Grenze für eine Nichtunterlegenheit von 5% werden mehr als 3000 Patientinnen pro Studienarm benötigt, um eine Nichtunterlegenheit zu zeigen. Würde die Effektivität in beiden Armen 60% betragen, so würde nur etwa die Hälfte an Patientinnen benötigt werden.4
Aufgrund der methodischen und finanziellen Herausforderung, solch große Studien durchzuführen, stellt sich die Frage, ob wir bei sehr guten Studienergebnissen nicht auch auf Nichtunterlegenheitsstudien verzichten können. Hier sei als Beispiel die APT-Studie genannt: In dieser wurden Patientinnen mit HER2-positiven Tumoren (<3cm und nodal-negativ) und damit eher günstigem Risikoprofil adjuvant mit Trastuzumab und Paclitaxel behandelt. Es gab keinen aktiven Vergleichsarm.
Die Studie konnte nach sieben Jahren ein krankheitsfreies Überleben von 93% und damit ein sehr gutes Outcome für diese Gruppe von Patientinnen zeigen. Obwohl der formale Beweis einer Nichtunterlegenheit im Vergleich zur Standardtherapie nicht erbracht wurde, findet das APT-Schema daher in der klinischen Praxis Anwendung.
Verbesserung der Patientinnenselektion
Durch Verbesserung der Patientinnenselektion ließe sich ebenso eine bessere Effektivität bei individuell gleichbleibender, aber in Summe geringer Toxizität erreichen. Eine Therapie würde dann nur jenen Patientinnen zugemutet, die auch davon profitieren. Speziell im adjuvanten Setting wird heute für relativ kleine, wenn auch signifikante Fortschritte oftmalig eine hohe „number needed to treat“ (NTT) in Kauf genommen. Das bedeutet, dass viele Patientinnen eine Therapie bekommen, ohne davon zu profitieren.
Exemplarisch sei hier die MonarchE-Studie genannt: Hier konnte durch die zusätzliche adjuvante Therapie mit Abemaciclib die Rezidivrate nach drei Jahren um absolut 5,4% gesenkt werden.5 Die NNT beträgt damit in etwa 18,5. Dies bedeutet, dass von 18 Patientinnen eine einzige Patientin durch die Therapie vor einem Rezidiv bewahrt wird, alle anderen Patientinnen profitieren hinsichtlich dieses Endpunkts nicht.
Für adjuvante Studien ist diese NNT mangels besserer Selektionskriterien eine typische Größenordnung. In der klinischen Routine erfolgt die Patientinnenselektion hinsichtlich einer (neo)adjuvanten Therapie basierend auf Parametern, die zum Zeitpunkt der Diagnose vorliegen: Tumorstadium, Tumorbiologie (Histologie, intrinsischer Subtyp), Patientinnenfaktoren (Alter, Komorbiditäten) und neuerdings auch Genexpressionsprofile. Dieses Vorgehen wurde als „Day zero“-Konzept bezeichnet.1
Erstrebenswert, weil wahrscheinlich präziser, wäre aber die Möglichkeit eines frühzeitigen Therapiemonitorings im Sinne von dynamischen Konzepten, sodass eine Therapie je nach Ansprechen angepasst werden kann. Zusätzlich zu Faktoren, die bereits bei Diagnose vorliegen, kommen in diesem Konzept das Ansprechen auf eine neoadjuvante Therapie, z.B. im Sinne eines Ki-67-Ansprechens, Änderungen der Genexpression oder des Immunstatus des Tumors hinzu.
Frühzeitiges Therapiemonitoring – dynamische Selektion
Beim frühen hormonrezeptorpositiven (HR+) Mammakarzinom sind Genexpressionsprofile wie beispielsweise der EndoPredict-Test oder der OncotypeDx Recurrence Score wertvolle Tools zur besseren Selektion von Patientinnen, die von einer (neo)adjuvanten Chemotherapie profitieren.6,7
Mit diesen Tools wird die Tumorbiologie zum Zeitpunkt der Diagnose („day zero“) bestimmt. Ein interessanter Ansatz einer „dynamischen“ Patientinnenselektion wurde in der deutschen Studie ADAPT-HR+-HER2- verwendet: Hier wurde das Ki-67-Ansprechen (also die Änderung des Ki-67-Wertes als „dynamischer Parameter“) nach dreiwöchiger endokriner Therapie als zusätzliche Determinante für die Notwendigkeit einer adjuvanten Chemotherapie eingesetzt.
So konnte bei Patientinnen mit frühem HR-positivem und HER2-negativem Mammakarzinom und 0–2 positiven Lymphknoten selbst bei einem mittleren Recurrence Score von 12–25 auf eine Chemotherapie verzichtet werden, wenn es nach dreiwöchiger endokriner Therapie zu einem guten Ki-67-Ansprechen gekommen war.8
Abb. 2: Studiendiagramm der Studie ADAPT-HR+-HER2- als Beispiel für eine dynamische Patientinnenselektion als Deeskalationsstrategie. Modifiziert nach Harbeck N et al.8
Anhand der Ergebnisse der KEYNOTE-522-Studie kann die neoadjuvante Chemoimmuntherapie bei Patientinnen mit tripelnegativem Mammakarzinom im Stadium II–III als Standard gelten.9 Spannende Daten hinsichtlich einer frühen Dynamik unter neoadjuvanter Chemoimmuntherapie kommen aus der NeoTRIP-Studie, in der die Kombination Atezolizumab + nabPaclitaxel + Carboplatin bei tripelnegativer Erkrankung getestet wurde.
Zu Beginn des zweiten Therapiezyklus wurde eine erneute Biopsie genommen. Als prädiktive Marker für eine spätere pathologische Komplettremission (pCR) konnten ein hoher Anteil von tumorinfiltrierenden Lymphozyten (TIL) oder das Fehlen von Tumorzellen nach einem Zyklus der neoadjuvanten Therapie identifiziert werden. Eine solche „dynamisch selektierte“ Patientinnengruppe könnte daher möglicherweise von einer Deeskalation einer neoadjuvanten Therapie profitieren, wiewohl größere Studien dazu noch ausstehen.10
Bei HER2-positiver Erkrankung ist der derzeitige Standard jedenfalls eine neoadjuvante Chemotherapie kombiniert mit Trastuzumab + Pertuzumab.11 Es gab aber sowohl in der KRISTINE-Studie als auch in der NeoSphere-Studie durchaus Patientinnen, die alleinig mit Trastuzumab/Pertuzumab oder dem Antikörper-Wirkstoff-Konjugat Trastuzumab Emtansin (T-DM1) eine pCR erreichten, also ohne Chemotherapie.12,13 Uns fehlt jedoch derzeit die Möglichkeit, diese Patientinnen prospektiv zu identifizieren.
Möglicherweise müssen auch hier dynamische Parameter im Verlauf der neoadjuvanten Therapie eingesetzt werden. Hinweise dafür ergeben sich etwa aus der PAMELA-Studie: In dieser wurde am Tag 14 nach Therapiebeginn mit Lapatinib + Trastuzumab eine erneute Biopsie inklusive molekularpathologischer Analyse (PAM50-Score) durchgeführt. Eine „Normalisierung“ des molekularen Profils war hierbei prädiktiv für eine spätere pCR und könnte daher auch als Verlaufsparameter in einem dynamischen Therapiekonzept herangezogen werden.14
Zusammenfassung und Ausblick
Neue Therapieoptionen wie etwa Antikörper-Wirkstoff-Konjugate oder CDK4/6-Hemmer haben Einzug in die Therapielandschaft des frühen Mammakarzinoms gehalten. Trotz großer Fortschritte, z.B. durch die Integration von Genexpressionsprofilen, liegt die Herausforderung immer noch darin, jene Patientinnen zu identifizieren, welche eine Eskalation mit neuen Substanzen benötigen, aber auch diejenigen, bei denen eine Deeskalation riskiert werden kann.
Eine dynamische Selektion im Sinne eines frühen Therapiemonitorings, eine noch stärkere Integration translationaler Daten sowie die Analyse großer Datensätzen sind Ansätze, die uns dabei helfen können.
Literatur:
1 Pondé NF et al.: Progress in adjuvant systemic therapy for breast cancer. Nat Rev Clin Oncol 2019; 16(1): 27-44 2 Hartung J et al.: Absence of evidence is not evidence of absence. Anesthesiology 1983; 58(3): 298-300 3 Conte P et al.: Nine weeks versus 1 year adjuvant trastuzumab in combination with chemotherapy: final results of the phase III randomized Short-HER study‡. Ann Oncol 2018; 29(12): 2328-33 4 Hahn S: Understanding noninferiority trials. Korean J Pediatr 2012; 55(11): 403-7 5 Harbeck N et al.: Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: updated efficacy and Ki-67 analysis from the monarchE study. Ann Oncol 2021; 32(12): 1571-81 6 Filipits M et al.: Prediction of distant recurrence using EndoPredict among women with ER+, HER2-node-positive and node-negative breast cancer treated with endocrine therapy only. Clin Cancer Res 2019; 25(13): 3865-72 7 Kalinsky K et al.: 21-Gene assay to inform chemotherapy benefit in node-positive breast cancer. NEngl J Med 2021; 385(25): 2336-23 8 Harbeck N et al.: Abstract GS4-04: endocrine therapy alone in patients with intermediate or high-risk luminal early breast cancer (0-3 lymph nodes), Recurrence Score <26 and Ki-67 response after preoperative endocrine therapy: primary outcome results from the WSG-ADAPT HR+/HER2- trial. Cancer Res 2021; 81: GS4-04 9 Schmid P et al.: Event-free survival with pembrolizumab in early triple-negative breast cancer. N Engl J Med 2022; 386(6): 556-67 10 Gianni L et al.: Pathologic complete response (pCR) to neoadjuvant treatment with or without atezolizumab in triple-negative, early high-risk and locally advanced breast cancer: NeoTRIP Michelangelo randomized study. Ann Oncol 2022; 33(5): 534-43 11 Cardoso F et al.: Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol 2019; 30(8): 1194-220 12 Gianni L et al.: Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012; 13(1): 25-32 13 Hurvitz SA et al.: Neoadjuvant trastuzumab, pertuzumab, and chemotherapy versus trastuzumab emtansine plus pertuzumab in patients with HER2-positive breast cancer (KRISTINE): a randomised, open-label, multicentre, phase 3 trial. Lancet. Oncol 2018; 19(1): 115-26 14 Llombart-Cussac A et al.: HER2-enriched subtype as a predictor of pathological complete response following trastuzumab and lapatinib without chemotherapy in early-stage HER2-positive breast cancer (PAMELA): an open-label, single-group, multicentre, phase 2 trial. Lancet Oncol 2017; 18(4): 545-54
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...