CRC: neue Erkenntnisse und offene Fragen
Autor:innen:
Dr. med. Tabea Ibach-Bilgeri
Prof. Dr. med. Dr. phil. Andreas Wicki
PD Dr. med. Ralph Fritsch
Klinik für Medizinische Onkologie und Hämatologie, Universität und Universitätsspital Zürich
Korrespondenz:
E-Mail: tabea.ibach-bilgeri@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Mortalität durch kolorektale Karzinome (CRC) hat in Europa in den letzten Jahrzehnten kontinuierlich abgenommen. Sowohl im kurativen als auch im metastasierten Setting weist ein signifikanter Anteil der Patient:innen molekulare Profile auf, bei denen die Prognose durch zielgerichtete Therapien verbessert werden kann.
Keypoints
-
Die totale neoadjuvante Therapie (TNT) ist beim LARC häufig der neue kurative Therapiestandard.
-
ctDNA stellt einen sehr vielversprechenden Marker zur Risikostratifizierung vor adjuvanter Chemotherapie beim CRC dar.
-
Mikrosatelliten-instabile (MSI-h) CRC zeigen ein exzellentes Ansprechen auf neoadjuvante Immuntherapie.
-
Die therapeutischen Optionen beim metastasierten CRC werden immer diverser mit zielgerichteten Therapien als Ergänzung zur Standard-Chemotherapie, ein Durchbruch mit stark verlängertem Gesamtüberleben bleibt bisher aus.
Zielgerichtete Therapien konnten beim kolorektalen Karzinom (CRC) die Prognose der Betroffenen zwar verbessern. Dennoch besteht bei fortgeschrittenen Tumoren die Grundlage der systemischen Therapie meistens weiterhin aus einer Kombination von 5-Fluorouracil, Leucovorin, Oxaliplatin und/oder Irinotecan, zusammen mit einem EGFR- oder VEGF-gerichteten Antikörper. Auch aufgrund des deutlich verbesserten Gesamtüberlebens werden verlässliche prädiktive Marker über den genauen Nutzen der jeweiligen Therapien in verschiedenen Stadien benötigt. So können Übertherapien mit potenziell langfristigem Schaden vermieden werden. Dieser Artikel bietet einen Überblick über aktuelle Entwicklungen der Therapieoptionen beim CRC.
Totale neoadjuvante Therapie beimlokal fortgeschrittenen Rektumkarzinom
Die perioperative Behandlung des lokal fortgeschrittenen Rektumkarzinoms (LARC) hat sich zunehmend hin zur totalen neoadjuvanten Therapie (TNT) entwickelt. Hierbei wird die klassische neoadjuvante Radiochemotherapie durch eine intensivierte (präoperative) Chemotherapie ergänzt. Das primäre Ziel einer neoadjuvanten Behandlung war bislang, die Rate an sphinktererhaltenden Operationen zu steigern und eine möglichst geringe Rate an Lokalrezidiven zu erzielen. Mit der TNT soll zusätzlich das Risiko für Fernmetastasen im Verlauf minimiert werden. In bestimmten Fällen ist sogar der Verzicht auf eine Operation möglich. Diese alternative Therapiestrategie wurde in verschiedenen Ausführungen bereits in mehreren grösseren Studien untersucht (RAPIDO,1 PRODIGE23,2 OPRA3).
Die 7-Jahres-Daten von PRODIGE23 wurden 2023 veröffentlicht. Patient:innen mit LARC wurden neoadjuvant mit FOLFIRINOX gefolgt von Radiochemotherapie behandelt. Im Kontrollarm erfolgte neoadjuvant lediglich die konkomitierende Radiochemotherapie. Eine adjuvante Chemotherapie war in beiden Armen möglich. Nach sieben Jahren zeigte sich ein statistisch signifikant verlängertes krankheitsfreies Überleben (DFS) von 67,6% vs. 62,5% im Standardarm.4 Bei fast der Hälfte der Patient:innen unter FOLFIRINOX kam es zu ausgeprägten Nebenwirkungen (CTCAE Grad 3–4), vor allem Neutropenie und Diarrhö. Die neoadjuvante Therapie mit FOLFIRINOX ist daher gegenüber alternativen Schemata mit FOLFOX ein aggressiverer Therapiestandard mit ausgeprägteren Nebenwirkungen. Er kommt in erster Linie bei fitten Patienten mit hoher Tumorlast und dringend benötigtem raschem Ansprechen infrage.
In der aktuellen Phase-III-Studie PROSPECT wurde analysiert, ob alternativ auch ein Verzicht auf die Bestrahlung möglich wäre. Hierzu wurden Patient:innen mit LARC neoadjuvant mit sechs Zyklen FOLFOX oder konkomitierender Radiochemotherapie behandelt. Nur wenige Patient:innen (9,1%) mussten bei schlechtem Ansprechen im experimentiellen Arm im Anschluss noch mit Radiochemotherapie behandelt werden. Alle wurden im Anschluss operiert und adjuvant behandelt. Das 5-Jahres-Überleben zeigte sich fast identisch (89,5% vs. 90,2%).5 Bisher kam es ohne lokale Bestrahlung nicht zu signifikant mehr Lokalrezidiven. Die akuten Nebenwirkungen – in erster Linie Neutropenie und Neuropathien – waren im experimentiellen Arm ausgeprägter (Grad 3–4: 41% vs. 22,8%). Die Radiochemotherapie führte zu mehr Diarrhö und nach einem Jahr zu schlechterer Sexualfunktion.6
International wurde diese Studie ausführlich diskutiert. Zum einen haben sich die europäischen Leitlinien bereits dahingehend geändert, dass bei frühen (in dieser Studie eingeschlossen) proximalen Neoplasien eine direkte Operation mit adjuvanter Chemotherapie bereits Standard ist. Zum anderen wurden die in der Zwischenzeit entwickelten Konzepte der TNT nicht berücksichtigt. Insgesamt steht mit der PROSPECT-Studie eine Therapieoption für Patient:innen mit LARC zur Verfügung, bei denen ein Verzicht auf Bestrahlung gewünscht ist. Dies sollte jedoch individuell diskutiert werden, besonders da sonst bei einigen Patient:innengruppen die Gefahr einer Übertherapie besteht.
Adjuvante Therapie beim kolorektalen Karzinom
Die adjuvante Behandlung von CRC verfolgt das Ziel, die Heilungsrate nach Operation zu erhöhen. Therapeutischer Standard von Kolonkarzinomen im Stadium III ist eine drei- bis sechsmonatige adjuvante Chemotherapie.7 Im Stadium II ist eine adjuvante Therapie derzeit bei Vorliegen von zusätzlichen Risikofaktoren indiziert. Rektumkarzinome im oberen Rektumdrittel werden adjuvant analog dem Kolonkarzinom behandelt. Es besteht dringender Bedarf nach prädiktiven Markern, um zu differenzieren, welche Patient:innen wirklich von einer adjuvanten Chemotherapie profitieren.
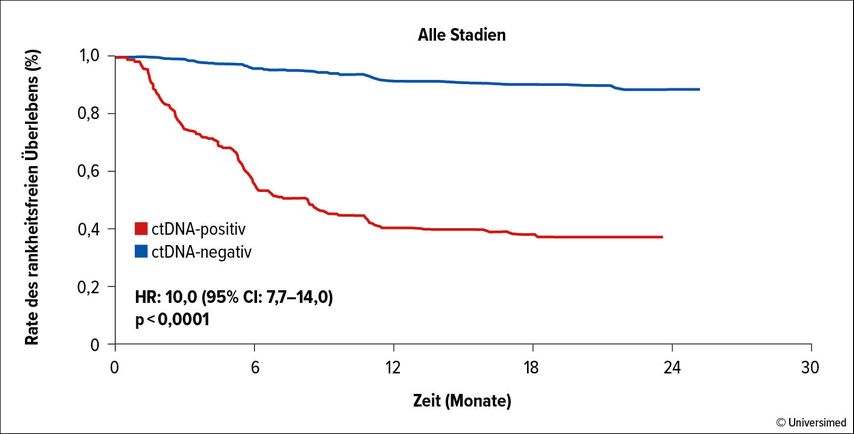
In der Phase-II-Studie GALAXY wurde der Zusammenhang zwischen minimaler, im Blut messbarer Resterkrankung (MRD) postoperativ in Form von «circulating tumor DNA» (ctDNA), dem Verlauf der ctDNA und dem progressionsfreien Überleben (PFS) bei CRC im Stadium II–IV nach kompletter Resektion analysiert. In die Studie wurden Patient:innen mit neoadjuvanter (11%) und mit adjuvanter (39%) Therapie eingeschlossen. Postoperativ erfolgten nach MRD-Bestimmung regelmässige Kontrollen der ctDNA im peripheren Blut für drei Monate. In der gesamten Kohorte zeigte sich die ctDNA-Negativität als ein statistisch signifikanter prognostischer Marker für ein längeres PFS nach zwei Jahren (ctDNA neg. 89%, ctDNA pos. 34%, Abb. 1).7
Abb. 1: ctDNA-Negativität als statistisch signifikanter prognostischer Marker für ein längeres PFS bei CRC Stadium II–IV, zwei Jahre nach kompletter Resektion. Modifiziert nach Kotani D et al.7
Prognostisch relevant war zudem der Verlauf der ctDNA. Bei Patient:innen im Stadium II–III und ohne ctDNA im Blut brachte eine adjuvante Chemotherapie keinen Vorteil des PFS nach zwei Jahren. Hingegen hatten ctDNA-positive Patient:innen zwar eine deutlich erhöhte Rückfallquote, profitierten jedoch signifikant von der adjuvanten Chemotherapie. Die ctDNA kann somit im adjuvanten Setting sowohl als prognostischer Marker als auch als prädiktive Entscheidungshilfe in Bezug auf adjuvante Chemotherapie verwendet werden.
In zwei japanischen Phase-III-Studien (ALTAIR, VEGA) wird derzeit ctDNA-abhängig adjuvant therapiert. Die Ergebnisse werden zusammen mit weiteren laufenden Studien möglicherweise zum breiten Einsatz von ctDNA beim kurativ therapierten CRC führen.
Neoadjuvante Therapie beimKolonkarzinom
Die neoadjuvante Behandlung ist beim lokalisierten Kolonkarzinom kein genereller Therapiestandard. Bei bis zu 15% der lokalisierten Kolonkarzinome liegt eine Mismatch-Reparatur-Defizienz (dMMR) vor. Für diese konnte die Serie der NICHE-Studien demonstrieren, dass eine neoadjuvante Immuntherapie exzellente Ergebnisse erzielen kann.8 Bereits in NICHE und NICHE-2 wurde gezeigt, dass die kombinierte Gabe von Nivolumab, einem PD-1-Inhibitor, und dem CTLA4-Inhibitior Ipilimumab zu 95% zu einem majoren pathologischen Ansprechen führte.9,10
In der Phase-II-Studie NICHE-3 wurden bisher 19 Patient:innen mit lokal fortgeschrittenem Kolonkarzinom und dMMR neoadjuvant mit zwei Zyklen Nivolumab und Relatlimab (Anti-LAG3-Antikörper) behandelt. Diese Kombination war zuvor bereits beim malignen Melanom mit sehr gutem Ansprechen und geringer Toxizität getestet worden.11 Alle Patient:innen zeigten ein pathologisches Ansprechen, davon 79% eine komplette pathologische Remission.10 Das Nebenwirkungsprofil war typisch für Immuntherapien, es kam nicht zu Verzögerungen der geplanten Operationen.
Zusammenfassend waren die Fallzahlen in diesen Studien bisher zwar gering, die Ergebnisse zeigen jedoch ein exzellentes Ansprechen auf neoadjuvante Immuntherapie und sollten somit bereits jetzt bei diesem Patientenkollektiv berücksichtigt werden. Offen bleibt allerdings die Frage, ob man Patient:innen mit Kolonkarzinom und klinisch komplettem Ansprechen nach neoadjuvanter Immuntherapie zwingend operieren muss oder analog den Entwicklungen im LARC auch einen «Watch and wait»-Ansatz verfolgen könnte.
Palliative Therapie beimmetastasierten CRC
Bei disseminierten Tumoren, bei denen keine kurative Option besteht, wird bei beschwerdefreien Patient:innen auf eine Operation verzichtet. In der ersten Linie wird abhängig vom Allgemeinzustand und von molekularen Markern eine Chemotherapie, teils in Kombination mit einem Antikörper, gewählt. Bei einem Progress in der Zweitlinientherapie können sowohl Chemotherapie als auch Antikörper geändert werden. Für die dritte Linie wurden 2023 die Ergebnisse von drei Studien publiziert, die Alternativen zu den etablierten oralen Therapien mit Trifluridin/Tipiracil (FTD/TPI), Regorafenib oder dem EGFR-Antikörper Panitumumab bei RAS-Wildtyp darstellen.
In der SUNLIGHT-Studie wurde entweder im Standardarm mit FTD/TPI-Monotherapie oder im experimentellen Arm mit der Kombination aus FTD/TPI und dem VEGF-Inhibitor Bevacizumab behandelt. Auch Patient:innen mit zuvor bereits erfolgter Therapie mit Bevacizumab waren in die Studie eingeschlossen worden. Es zeigte sich ein signifikant verlängertes Gesamtüberleben (mOS 10,8 vs. 7,5 Monate) im experimentellen Arm.12 Die Nebenwirkungen waren konsistent mit den bekannten Sicherheitsprofilen von FTD/TPI und Bevacizumab (vorwiegend Neutropenie, Nausea und Hypertension). Die Kombinationstherapie ist daher ein neuer Standard ab der Drittlinientherapie bei metastasiertem CRC.
Etwa 3% aller CRC weisen eine KRASG12C-Mutation auf, die zu einer tendenziell schlechteren Prognose führt.13 Studien mit dem KRASG12C-Inhibitor Sotorasib als Monotherapie beim stark vorbehandelten Kolonkarzinom zeigten wenig antitumorale Aktivität. Eine Kombination mit EGFR-Antikörpern erscheint vielversprechend, da durch die zusätzliche Deaktivierung von EGFR die Hemmung des KRAS-Signalweges verstärkt und das Entstehen von Resistenzen verhindert werden soll.
In der Phase-III-Studie CodeBreak300 konnte nun gezeigt werden, dass die Kombination aus 960mg Sotorasib und dem EGFR-Antikörper Panitumumab bei Tumoren mit KRASG12C-Mutation zu einem verlängerten progressionsfreien Überleben im Vergleich mit FTD/TPI oder Regorafenib führt.14 Die Daten zum Gesamtüberleben sind noch ausstehend. Es zeigten sich keine unerwarteten neuen Nebenwirkungen. Dies ist aktuell eine alternative Therapieoption bei Patient:innen, bei denen eine Chemotherapie nicht mehr möglich ist.
Einschränkend gilt jedoch, dass seit der oben erwähnten SUNLIGHT-Studie der Kontrollarm nicht mehr die Standardtherapie in der dritten Linie darstellt. Zudem befinden sich diverse weitere KRASG12C-Inhibitoren in Testung, unter anderem wird mit Adagrasib ein zweiter KRASG12C-Inhibitor in Kombination mit dem EGFR-Inhibitor Cetuximab in einer Phase-III-Studie (KRYSTAL-10) getestet.
Etwa 2% aller Kolonkarzinome zeigen eine Amplifikation von HER2, wobei dies derzeit in der Wahl der Erst- und Zweitlinientherapie keine Rolle spielt.15 Eine anti-HER2-gerichtete Therapie mit dem Antikörper Trastuzumab hat jedoch in weiteren Linien antitumorale Wirkung gezeigt.16
Eine bereits beim Mammakarzinom sehr erfolgreich angewendete Alternative ist das Antikörper-Wirkstoff-Konjugat Trastuzumab-Deruxtecan (T-Dxd). Hier wurde Trastuzumab mit dem Topoisomerase-I-Hemmer Deruxtecan verbunden. Dieser wird aktiviert, sobald das Molekül an HER2 gebunden hat und in die Tumorzelle eingedrungen ist. In früheren Studien kam es hierunter jedoch zu ausgeprägten Nebenwirkungen in Form von interstitiellen Lungenerkrankungen.17
In der aktuellen Studie DESTINYCRC02 zeigte sich jedoch, dass eine reduzierte Dosis von 5,4mg/kg zu weniger schweren Nebenwirkungen bei nur minimal verringertem Ansprechen führte (37% ORR, mPFS 5,5 Monate).18 In dieser Phase-II-Studie verdienen zwei Aspekte besondere Beachtung. So waren Patient:innen eingeschlossen, die bereits in vorherigen Therapielinien HER2-gerichtete Therapien erhalten hatten: T-Dxd kann somit beispielsweise nach Trastuzumab/Lapatinib eingesetzt werden. Zudem waren Patient:innen mit KRAS-Mutationen eingeschlossen. In den aktuellen Guidelines der European Society for Medical Oncology (ESMO) sind HER2-gerichtete Therapien aufgrund der bisherigen Studienlage nur für Patienten mit RAS-Wildtyp empfohlen.19 Dies könnte sich aufgrund der nun vorliegenden Daten aus DESTINYCRC02 ändern.
Literatur:
1 Bahadoer RR et al.: Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(1): 29-42 2 Conroy T et al.: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(5): 702-715 3 Garcia-Aguilar J et al.: Organ preservation in patients with rectal adenocarcinoma treated with total neoadjuvant therapy. J Clin Oncol 2022; 40(23): 2546-56 4 Conroy T et al.: Total neoadjuvant therapy with mFOLFIRINOX versus preoperative chemoradiation in patients with locally advanced rectal cancer: 7-year results of PRODIGE 23 phase III trial, a UNICANCER GI trial. J Clin Oncol 2023, 41(17_suppl): LBA3504 5 Schrag D et al.: Preoperative treatment of locally advanced rectal cancer. NEngl J Med 2023; 389(4): 322-34 6 Basch E et al.: Patient-reported outcomes during and after treatment for locally advanced rectal cancer in the PROSPECT trial (Alliance N1048). J Clin Oncol 2023; 41(21): 3724-34 7 Kotani D et al.: Molecular residual disease and efficacy of adjuvant chemotherapy in patients with colorectal cancer. Nat Med 2023; 29(1): 127-134 8 Goel A, Boland CR: Epigenetics of colorectal cancer. Gastroenterology 2012; 143(6): 1442-60 9 Chalabi M et al.: Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med 2020; 26(4): 566-76 10 Verschoor YL et al.: LBA31. Neoadjuvant nivolumab plus relatlimab (anti-LAG3) in locally advanced MMR-deficient colon cancers: the NICHE-3 study. Ann Oncol 2023; 34: S1270 11 Amaria RN et al.: Neoadjuvant relatlimab and nivolumab in resectable melanoma. Nature 2022; 611(7934): 155-60 12 Prager GW et al.: Trifluridine-tipiracil and bevacizumab in refractory metastatic colorectal cancer. N Engl J Med 2023; 388(18): 1657-67 13 Chida K et al.: The prognostic impact of KRAS G12C mutation in patients with metastatic colorectal cancer: a multicenter retrospective observational study. Oncologist 2021; 26(10): 845-53 14 Fakih MG et al.: Sotorasib plus panitumumab in refractory colorectal cancer with mutated KRAS G12C. N Engl J Med 2023; 389(23): 2125-39 15 Djaballah SA et al.: HER2 in colorectal cancer: the long and winding road from negative predictive factor to positive actionable target. Am Soc Clin Oncol Educ Book 2022; (42): 219-32 16 Sartore-Bianchi A et al.: Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17(6): 738-46 17 Yoshino T et al.: Final results of DESTINY-CRC01 investigating trastuzumab deruxtecan in patients with HER2-expressing metastatic colorectal cancer. Nat Commun 2023; 14(1): 3332 18 Raghav KPS et al.: Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2- overexpressing/amplified (HER2+) metastatic colorectal cancer (mCRC): Primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. J Clin Oncol 2023, 41(16_suppl): 3501 19 Cervantes A et al.: Metastatic colorectal cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(1): 10-32
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...