CML: Die Zukunft sieht rosig aus
Autor:
Prim. Univ.-Prof. Dr. Andreas Petzer
Vorstand der Abteilungen Interne I für Hämatologie mit Stammzelltransplantation, Hämostaseologie und medizinische Onkologie am Ordensklinikum Linz
E-Mail: andreas.petzer@ordensklinikum.at
Sehr effiziente bereits zugelassene und interessante neue Substanzen werden den Therapieverlauf der chronischen myeloischen Leukämie (CML) prägen. Auf dem ASH-Meeting 2022 wurden unter anderem Asciminib, Ponatinib, Olverembatinib und Vodobatinib vorgestellt.
Asciminib: neuer Player in der CML-Therapie
Asciminib ist der erste sogenannte STAMP-Inhibitor (STAMP: „specifically targeting the ABL myristoyl pocket“). Im Unterschied zu allen bisher zugelassenen Tyrosinkinaseinhibitoren (TKI) zur Behandlung der chronischen myeloischen Leukämie (CML) bindet Asciminib nicht an die ATP-Bindungsstelle von ABL, sondern an die Myristoyl-Tasche von ABL. Durch diese Bindung wird die Autoinhibition von ABL, die durch die Fusion von ABL mit BCR zu BCR::ABL1 aufgehoben wird, wiederhergestellt.
Asciminib ist aufgrund seiner gezeigten Wirksamkeit in der Phase-III-Studie ASCEMBL für Patient*innen ab der dritten Linie seit August 2022 in Europa und in Österreich zugelassen. Aktuell wird Asciminib in der Erstlinientherapie getestet, z.B. im Rahmen der Phase-III-Studie ASC4FIRST, in der Asciminib in einer Dosis von 80mg täglich (QD) mit einem für die Erstlinientherapie zugelassenen TKI der Wahl des Investigators verglichen wird. Diese Studie hat Ende 2022 ihre Rekrutierung beendet. Die Daten dazu sind noch ausständig. Einen ersten Eindruck über die Wirksamkeit von Asciminib in der Erstlinientherapie zeigen sehr frühe Daten aus der australischen ASCENT-Studie. Dabei wird ebenfalls Asciminib bei neu diagnostizierten CML-Patient*innen getestet. In weiterer Folge kann die Dosis von Asciminib bei suboptimalem Ansprechen basierend auf den ELN(European LeukemiaNet)-Richtlinien auf 80mg zweimal täglich gesteigert werden. Bei Therapieversagen kann zusätzlich zu Asciminib ein weiterer Tyrosinkinaseinhibitor gegeben werden.
Beim ASH-Meeting wurden die molekularen Daten der Studie nach drei Monaten präsentiert. Dabei zeigt sich, dass 92% der Patient*innen den Zielwert von ≤10% BCR::ABL1 erreichen. Beeindruckend ist jedoch vor allem, dass 47% einen Wert einer tiefen molekularen Remission (MMR bzw. MR3) bereits nach drei Monaten erreichen. Somit ist auch in der Erstlinientherapie von einer exzellenten Wirksamkeit von Asciminib auszugehen.
Hinsichtlich der Toxizität gab es im Vergleich zur ASCEMBL-Studie keine neuen Erkenntnisse. Im Vordergrund steht eine Hämatotoxizität mit Vorherrschen von Thrombozytopenie und Neutropenie. Zudem sind Lipaseerhöhungen erwähnenswert, die jedoch nicht typischerweise zum Bild einer Pankreatitis führen, sowie die Erhöhung der Werte von Leberenzymen. Die Autor*innen heben auch hervor, dass bislang keine arteriell-okklusiven oder vaskulär-okklusiven Ereignisse beobachtet wurden. Die Beobachtungszeit diesbezüglich ist jedoch mit einem medianen Follow-up von elf Monaten noch kurz. Generell zeigte Asciminib in allen bisher durchgeführten Studien eine gute Verträglichkeit.
Molekulare Prädiktoren beiDiagnosestellung
Es konnte gezeigt werden, dass das Vorhandensein „zusätzlicher chromosomaler Abnormalitäten“ (ACA) mit einem schlechteren Ansprechen auf TKI und einem höheren Progressionsrisiko vergesellschaftet ist. Zudem ist es auch mit einem schlechteren Gesamtüberleben assoziiert. Deshalb wurde das Vorhandensein von ACA (zusätzliches Chromosom 8, zusätzliches Philadelphia-Chromosom, i[17q], +19, -7/7q-, 11q23, 3q26.2, komplex aberrante Karyotypen) in die „Warning“-Kategorie der ELN-Guidelines aufgenommen.
Beim diesjährigen ASH-Meeting wurden zudem zusätzliche genetische Abnormalitäten (AGA) bei Diagnosestellung analysiert. Sowohl die australische Arbeitsgruppe als auch die deutsche Arbeitsgruppe fanden dabei, dass ca. 20–23% bei Diagnosestellung eine zusätzliche genetische Abnormalität aufweisen. Die australische Arbeitsgruppe zeigt, dass Patient*innen mit AGA ein schlechteres molekulares Ansprechen aufweisen, insbesondere wenn die Patient*innen mit Imatinib behandelt werden. Zusätzlich weisen diese Patient*innen ein höheres Risiko für ein Therapieversagen auf.
Bei Verwendung von Zweitgenerations-TKI zeigt sich eine Verzögerung im Erreichen einer MMR/MR3 oder einer MR4. Die deutsche CML-Studiengruppe konnte zeigen, dass es sich bei den molekularen Mutationen vor allem um epigenetisch modifizierende Gene wie ASXL1, DNMT3A oder TET handelt. Die am häufigsten vorhandene ASXL1-Mutation findet man vor allem in der jüngeren Population und in der Hochrisikokategorie. Die Zahl der Patient*innen mit einer ASXL1-Mutation, die eine MMR/MR3 im Laufe einer TKI-Therapie erreichen, ist im Vergleich zu Patient*innen ohne Mutationen bzw. bei Vorhandensein jeglicher anderer Mutationen deutlich geringer.
Bislang wurde von beiden Studiengruppen jedoch noch nicht gezeigt, inwieweit das Vorhandensein dieser molekularen Mutationen zu einem schlechteren Gesamtüberleben führt. Auch das Ansprechen auf Zweitgenerations-TKI im Vergleich zu Imatinib bei Vorhandensein dieser Mutationen ist derzeit noch nicht eindeutig konklusiv.
Asciminib und Ponatinib in der Drittlinientherapie
Asciminib
Dadurch, dass Asciminib nicht an die ATP-Bindungsstelle, sondern an die Myristoyl-Tasche bindet, ergibt sich die Möglichkeit, Asciminib mit anderen TKI zu kombinieren. Dieses Vorgehen wird in der Phase-II-Studie ASC4MORE bei Patient*innen in chronischer Phase (CP) getestet, die mindestens ein Jahr Imatinib erhalten haben, ein Ansprechen von zumindest einer MR2, jedoch keine tiefe molekuare Remission von ≥MR4 erreichten. Diese Patient*innen wurden randomisiert und erhielten entweder weiterhin Imatinib in einer Dosis von 400mg täglich (QD), Nilotinib in einer Dosis von 300mg 2x täglich (BID) oder Imatinib in einer Dosis von 400mg QD in Kombination mit Asciminib in einer Dosierung von 40mg QD oder 60mg QD.
Der primäre Endpunkt war das Erreichen einer tiefen molekularen Remission von MR4.5 in Woche 48. Dabei zeigte sich, dass unter Fortführen von Imatinib kein*e Patient*in in Woche 48 eine MR4.5 erreichte und unter Nilotinib 4,8% der Patient*innen. In der Kombinationstherapie von Imatinib und Asciminib betrug hingegen die Rate an Patient*innen mit einer MR4.5 in Woche 48 19% (Asciminib 40mg QD) bzw. 28,6% (Asciminib 60mg QD). Die Nebenwirkungen waren in der Kombinationstherapie von Asciminib und Imatinib etwas vermehrt, jedoch akzeptabel. Therapieabbrüche waren im Nilotinib-Arm häufiger als in den Asciminib-„Add-on“-Armen.
Fazit: Die Kombination von Imatinib und Asciminib scheint eine zukünftige wirksame und akzeptabel verträgliche Therapieoption zu sein.
Ponatinib
Ein weiterer wichtiger Player in der Drittlinie ist Ponatinib. Aufgrund seiner vaskulär-okklusiven Nebenwirkungsrate in der initialen 45mg-Dosierung wurde die Phase-II-Studie OPTIC initiiert, in welcher unterschiedliche Anfangsdosierungen von 45mg, 30mg und 15mg QD getestet wurden und bei Ansprechen (Erreichen eines Wertes von ≤1% BCR::ABL1IS) auf eine Dosis von 15mg QD reduziert wurde.
Der primäre Endpunkt dieser Studie, das Erreichen eines Wertes von ≤1% BCR::ABL1IS, wurde bereits publiziert. Beim aktuellen ASH-Meeting wurden die 3-Jahres-Daten gezeigt. Dabei zeigt sich, dass nach wie vor die 45mg-QD-Anfangsdosierung den 30mg- und 15mg-Dosierungen bezüglich Effektivität überlegen ist. Allerdings betrifft dies in erster Linie Patient*innen, die eine T315I-Mutation aufweisen, bzw. Patient*innen, die auf die zuletzt vorangegangene TKI-Therapie ein sehr schlechtes Ansprechen hatten (maximal eine komplette hämatologische Remission oder schlechter). Für Patient*innen mit anderen Mutationen bzw. Patient*innen ohne nachweisbare BCR::ABL1-Mutation war der Vorteil der 45mg-Dosierung im Vergleich zu den beiden anderen Dosierungen (30mg bzw. 15mg) deutlich geringer.
Mit diesem in der OPTIC-Studie getesteten Vorgehen einer raschen Dosisreduktion von Ponatinib im Falle eines Ansprechens ist die Rate an Nebenwirkungen geringer, wenngleich die Rate an arteriell-okklusiven Ereignissen mit 12% mit der 45mg-QD-Dosierung nach wie vor höher ist als bei Verwendung einer Anfangsdosis von 30mg (6%) bzw. 15mg (4%). Erwähnenswert ist auch, dass in die OPTIC-Studie deutlich weniger Patient*innen mit kardiovaskulären Risikofaktoren eingeschlossen wurden. So hatten lediglich circa ein Viertel der Patient*innen eine arterielle Hypertonie, nur ca. 5% einen Diabetes mellitus und 15–20% eine Hyperlipidämie. Die Rate an Patient*innen mit ≥2 kardiovaskulären Risikofaktoren betrug zwischen drei und fünf Prozent.
Das MD Anderson Cancer Center der University of Texas hat retrospektiv Daten hinsichtlich der Effektivität der Verwendung eines neuerlichen Zweitgenerations-TKI vs. Ponatinib in der dritten Linie ausgewertet. Dabei zeigte sich Ponatinib im Erreichen einer Reduktion von BCR::ABL1 um zwei oder drei Logarithmen der Verwendung eines Zweitgenerations-TKI deutlich überlegen. Auch das progressionsfreie Überleben und das Gesamtüberleben waren signifikant verbessert.
Fazit: Ponatinib ist in der dritten Linie der neuerlichen Verwendung eines alternativen Zweitgenerations-TKI in der Wirkung überlegen, insbesondere bei Patient*innen, welche bei Therapieversagen keine spezifische BCR::ABL1-Mutation aufweisen. Durch die Strategie der raschen Dosisreduktion analog zur OPTIC-Studie scheint die Substanz besser verträglich, eine Anfangsdosierung von 45mg sollte Patient*innen mit T315I-Mutation oder sehr schlechtem Ansprechen auf die vorangegangene TKI-Therapie vorbehalten sein.
Zukünftige Therapieoptionen: Olverembatinib und Vodobatinib
Olverembatinib
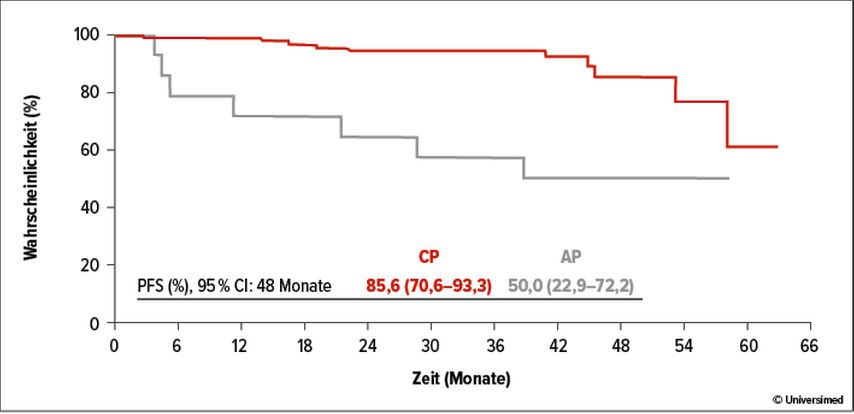
Olverembatinib (HQP1351) ist ein bereits seit Längerem bekannter Drittgenerations-Multikinase-TKI, der neben BCR::ABL1 auch zahlreiche andere Kinasen wie KIT, BRAF, DDR1, PDGFR, FGFR, FLT3 und weitere hemmt. Von dieser Substanz wurde ein 5-Jahres-Follow-up einer Phase-I-Studie präsentiert. In diese Studie wurden vor allem Patient*innen mit bereits zwei oder ≥3 vorangegangenen TKI-Therapien eingeschlossen. Bei Patient*innen in CP zeigen sich hohe kumulative Raten an MMR/MR3 (65%), MR4 (45%) und MR4.5 (39%). Zudem ist beim Großteil der Patient*innen das Ansprechen bei einer Dosierung von ≥30mg Olverembatinib sowohl in CP als auch in akzelerierter Phase dauerhaft (Abb. 1).
Abb. 1: Progressionsfreies Überleben (PFS) bei Patient*innen in der Phase-I-Studie zu Olverembatinib in der chronischen (CP) und akzelerierten (AP) Phase. Modifiziert nach Jiang Q et al. ASH 2022; Abstr. #81
An hämatologischen Nebenwirkungen ist vor allem im ersten Behandlungsjahr die Thrombozytopenie erwähnenswert. An nichthämatologischen Toxizitäten wird eine dauerhafte Hautpigmentierung in ca. 80% der Fälle beschrieben, ansonsten scheint die Substanz ein günstiges Nebenwirkungsprofil aufzuweisen. Arteriell-okklusive Ereignisse und venöse thrombotische Ereignisse traten in 7% der Fälle auf.
Bislang ist Olverembatinib nur in China verfügbar bzw. auch nur dort zugelassen. Das MD Anderson Cancer Center berichtet nun erstmalig über die Wirksamkeit dieser Substanz bei Patient*innen außerhalb Chinas. Es wurden Dosierungen von 30, 40 und 50mg an insgesamt 51 Patient*innen getestet. Erwähnenswert ist, dass >50% der Patient*innen kardiovaskuläre Komorbiditäten aufwiesen bzw. 35% an einer arteriellen Hypertonie litten. Der Großteil der Patient*innen hatte ≥2 TKI-Vortherapien, besonders erwähnenswert ist, dass >50% auch bereits vorab Ponatinib erhalten haben und 75% dieser Patient*innen Ponatinib-resistent waren. Die Rate an T315I-Mutationen betrug 37%.
Dabei zeigt sich eine hohe Rate (78%) an kompletten zytogenetischen Remissionen (CCyR) und MMR/MR3 (50%) bei Ponatinib-resistenten Patient*innen. Auch bei Patient*innen mit T315I-Mutation kommt es in 88% zum Erreichen einer CCyR und bei 56% der Patient*innen zu einer MMR. In einer weiteren Publikation mit chinesischen Patient*innen wurde ebenfalls bei Patient*innen mit T315I-Mutationen ein exzellentes progressionsfreies und Gesamtüberleben von 92 bzw. 95% berichtet.
Fazit: Olverembatinib scheint speziell für Patient*innen mit Ponatinib-Resistenz bzw. bei Vorhandensein einer T315I-Mutation eine hoffnungsvolle zukünftige Therapiealternative darzustellen.
Vodobatinib
Vodobatinib ist eine weitere interessante neue Substanz, ein selektiver BCR-ABL1-Inhibitor, der gegen zahlreiche Punktmutationen von BCR::ABL1 eine gute Aktivität aufweist, nicht jedoch gegen die T315I-Mutation. Bei dieser Substanz wurden ebenfalls gute zytogenetische und molekulare Remissionsraten in der zweiten und dritten Therapielinie gezeigt, auch nach Ponatinib-Vorbehandlung (Cave: ausgenommen Patient*innen mit T315I-Mutation!).
Zudem wurde berichtet, dass die erzielten Ansprechraten auch in der dritten Therapielinie zum Großteil dauerhaft sind. An Nebenwirkungen werden von hämatologischer Seite vor allem Thrombozytopenien, ansonsten gastrointestinale und muskuloskelettale Nebenwirkungen berichtet. Das Auftreten von Nebenwirkungen ist in der dritten Linie häufiger als bei Verwendung der Substanz in der zweiten Linie.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...