Von der CDK4/6-Inhibition bis zur Blockade des AKT/PIK3CA/PTEN-Pathways
Autorin:
Dr. Sabine Danzinger
Arbeitsgruppe Senologie, Klinische Abteilung für Allgemeine Gynäkologie und Gynäkologische Onkologie, Universitätsklinik für Frauenheilkunde, Medizinische Universität Wien
Die CDK4/6-Inhibotoren Ribociclib und Abemaciclib sind auch adjuvant beim frühen HR+, HER2– Mammakarzinom mit hohem Rezidivrisiko in Kombination mit antihormoneller Therapie zugelassen. Elacestrant, ein oraler SERD, sowie Capivasertib, ein Pan-AKT-Inhibitor, werden bei lokal fortgeschrittenem oder metastasiertem ER+, HER2– Brustkrebs eingesetzt. Der SERD und komplette Östrogenrezeptor-Antagonist Camizestrant wird in den beiden klinischen Studien CAMBRIA-1 und CAMBRIA-2 beim frühen ER+, HER2– Mammakarzinom untersucht.
Keypoints
-
Ribociclib und Abemaciclib werden adjuvant beim frühen HR+, HER2– Mammakarzinom mit hohem Rezidivrisiko in Kombination mit antihormoneller Therapie eingesetzt.
-
Elacestrant ist bei lokal fortgeschrittenem oder metastasiertem ER+, HER2– Brustkrebs und ESR1-Mutation nach einer antihormonellen Therapielinie, inklusive eines CDK4/6i, indiziert.
-
Die Studien CAMBRIA-1 und CAMBRIA-2 untersuchen Camizestrant im Vergleich zu endokriner Standardtherapie beim frühen ER+, HER2– Mammakarzinom mit mittlerem bzw. mittelhohem oder hohem Rückfallrisiko.
-
Capivasertib + Fulvestrant sind bei ER+, HER2–, lokal fortgeschrittenem oder metastasiertem Mammakarzinom mit einer oder mehreren PIK3CA/AKT1/PTEN-Alterationen zugelassen.
Ribociclib und Abemaciclib beim frühen Mammakarzinom
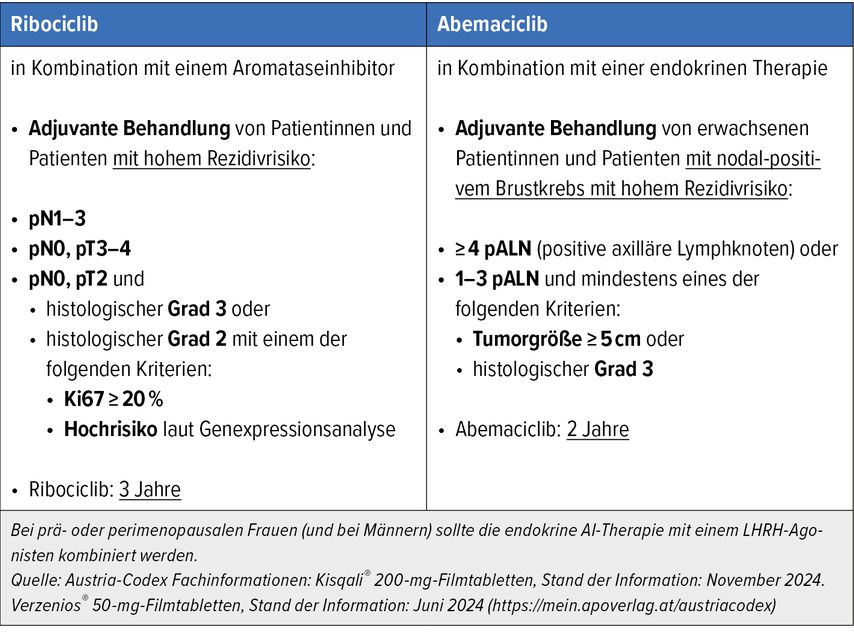
Bei Patient:innen mit Hormonrezeptor- (HR)-positivem (HR+), HER2-negativem (HER2–) Brustkrebs im frühen Stadium mit hohem Rezidivrisiko sind nun adjuvant – zusätzlich zur antihormonellen Therapie – die beiden CDK4/6-Inhibitoren (CDK4/6i) Ribociclib und Abemaciclib zugelassen. Dabei wird Ribociclib in Kombination mit einem Aromatasehemmer (AI) über eine Dauer von drei Jahren, Abemaciclib mit endokriner Therapie generell über zwei Jahre eingesetzt. Je nach Substanz wird das hohe Rezidivrisiko unterschiedlich definiert: Bei Abemaciclib ist eine axilläre Lymphknotenbeteiligung (positives pN-Stadium) jedenfalls Voraussetzung. Hingegen ist Ribociclib bei jedem positiven Nodalstatus und auch bei negativem Lymphknotenstatus und pT3-/pT4-Stadium sowie bei pT2 in Kombination mit histologischer Differenzierung Grad 3 oder Grad 2 in Kombination mit Ki67 ≥20% oder Hochrisiko laut Genexpressionsanalyse indiziert (Tab. 1).
Abemaciclib wird kontinuierlich, d.h. ohne Unterbrechung eingenommen, die empfohlene Dosis beträgt 150mg zweimal täglich.1 Diese Zulassung basiert auf den Ergebnissen der monarchE-Studie: Die Einnahme von Abemaciclib in Kombination mit einer endokrinen Therapie über zwei Jahre im Vergleich zu endokriner Standardtherapie allein führte zu einer signifikanten Verlängerung des von invasivem Tumorwachstum freien Überlebens (IDFS) sowie des von Fernrezidiven freien Überlebens (DRFS). Diese positiven Ergebnisse konnten auch über das Therapieende hinaus bestätigt werden; die mediane Nachbeobachtungszeit betrug 54 Monate: HR: 0,670; 95% CI: 0,588–0,764 (p<0,001) für IDFS, HR: 0,665; 95% CI: 0,577–0,765 (p<0,001) für DRFS.2–4
Im adjuvanten Setting beträgt die empfohlene Dosis von Ribociclib 400mg (2 Filmtabletten à 200mg) einmal täglich, beim lokal fortgeschrittenen oder metastasierten Brustkrebs hingegen 600mg täglich. Die Einnahme erfolgt nach dem 3/1-Schema: 21 Tage Einnahme, 7 Tage Pause, d.h. ein Zyklus entspricht 28 Tagen.5 In der randomisierten Phase III-Studie NATALEE wurde Ribociclib gemeinsam mit einem nichtsteroidalen Aromatasehemmer (NSAI) (Einnahme über mind. 5 Jahre) mit einem NSAI allein bei frühem HR+, HER2– Brustkrebs im Stadium II oder III verglichen. Bei einer medianen Nachbeobachtungszeit von 33,3 Monaten zeigte sich mit der Kombinationstherapie (Ribociclib + NSAI) eine signifikante Verlängerung des IDFS (primärer Endpunkt): HR: 0,749; 95% CI: 0,628–0,892 (p=0,001).6,7
EMERALD: Verlängerung des PFS durch Elacestrant
In der Phase III-Studie EMERALD wurde der orale selektive Östrogenrezeptor-Degrader (SERD) Elacestrant bei postmenopausalen Frauen und Männern mit Östrogenrezeptor(ER)-positivem (ER+), HER2– fortgeschrittenem Mammakarzinom, die zuvor 1–2 Linien endokrine Therapie (CDK4/6i erforderlich) und ≤1 Chemotherapie erhalten hatten, untersucht. Nach 1:1-Randomisierung erhielten die Patient:innen entweder 400mg Elacestrant einmal täglich per os (n=239) oder eine Standard of Care (SOC) endokrine Monotherapie (AI oder Fulvestrant) (n=238). Unter Elacestrant konnte verglichen mit SOC ein signifikant längeres progressionsfreies Überleben (PFS) erzielt werden, sowohl in der Gesamtpopulation als auch bei Patient:innen mit ESR1-Mutation.8 Eine Subgruppenanalyse untersuchte den Einfluss der Dauer der vorangegangenen CDK4/6i-Therapie auf das PFS. Bei Vorliegen einer ESR1-Mutation war eine vorangegangene CDK4/6i-Therapie ≥12 Monaten mit klinisch bedeutsamer Verlängerung des medianen PFS unter Elacestrant, verglichen mit SOC, assoziiert: 8,6 versus 1,9 Monate (HR: 0,410; 95% CI: 0,262–0,634).9
Elacestrant ist im lokal fortgeschrittenen oder metastasierten Stadium zur Monotherapie von postmenopausalen Frauen und Männern mit ER+, HER2– Brustkrebs mit aktivierender ESR1-Mutation bei Progress nach zumindest einer endokrinen Therapielinie, inklusive eines CDK4/6-Inhibitors, zugelassen. Die empfohlene Dosis beträgt 345mg (eine 345-mg-Filmtablette) einmal täglich. Bei Auftreten von Nebenwirkungen (≥Grad 3) soll nach Therapiepause im Falle einer Wiederaufnahme der Behandlung mit einer reduzierten Dosis von Elacestrant (258mg einmal täglich) fortgesetzt werden. Zu den häufigsten Nebenwirkungen (≥10%) zählen Übelkeit, erhöhte Triglyzeride, erhöhtes Cholesterin, Erbrechen, Fatigue, Dyspepsie, Diarrhö, erniedrigtes Kalzium, Rückenschmerzen, erhöhtes Kreatinin, Arthralgie, erniedrigtes Natrium, Obstipation, Kopfschmerzen, Hitzewallungen, Abdominalschmerz, Anämie, erniedrigtes Kalium und erhöhte Alanin-Aminotransferase (ALT, GPT).10
Camizestrant: SERENA-2, CAMBRIA-1, CAMBRIA-2
Camizestrant gilt als SERD und kompletter Östrogenrezeptor-Antagonist der neuen Generation. In der randomisierten Phase-II-Studie SERENA-2 wurden verschiedene Dosierungen von Camizestrant gegen Fulvestrant bei postmenopausalen Frauen mit ER+, HER2– Brustkrebs mit Rezidiv oder Progress nach ≤1 ET (kein Fulvestrant, kein oraler SERD) und ≤1 Chemotherapie im fortgeschrittenem Stadium untersucht. Camizestrant in den Dosierungen von jeweils 75mg bzw. 150mg zeigte im Vergleich zu Fulvestrant in der gesamten Studienpopulation einen signifikanten Benefit beim PFS. Behandlungsbedingte Nebenwirkungen (≥Grad 3) traten in den Armen Camizestrant 75mg, Camizestrant 150mg und Fulvestrant bei 12%, 23% sowie 15% der Patientinnen auf. Photopsie (18,4%) und (Sinus-)Bradykardie (15,6%), jeweils Grad 1 oder 2 zählten zu den am häufigsten mit Camizestrant assoziierten Nebenwirkungen.11
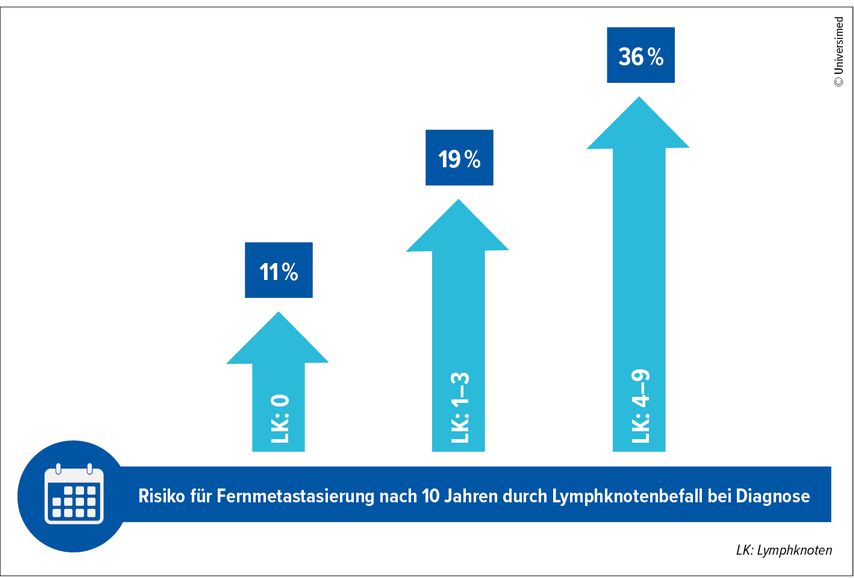
Beim frühen ER+ Mammakarzinom (T1, T2) mit adjuvanter antihormoneller Therapie über fünf Jahre steigt das Risiko für eine Fernmetastasierung mit zunehmender Lymphknotenbeteiligung zum Zeitpunkt der Diagnose (Abb. 1).12,13 Um das Rezidivrisiko beim frühen ER+/HER2– Brustkrebs im Vergleich zu endokriner Standardtherapie zu senken, wird Camizestrant derzeit in den Phase-III-Studien CAMBRIA-1* und CAMBRIA-2** untersucht. In CAMBRIA-1 werden Patient:innen mit mittlerem oder hohem Risiko für ein Rezidiv eingeschlossen, die bereits mindestens zwei Jahre eine endokrine Standardtherapie erhalten haben. Patient:innen mit mittelhohem oder hohem Rückfallrisiko und Abschluss einer definitiven lokoregionalen Behandlung ([Operation ± Strahlentherapie] ± [neo]adjuvante systemische Chemotherapie) können in die CAMBRIA-2-Studie eingeschlossen werden. In Österreich nehmen an diesen beiden internationalen Studien mehrere Zentren teil.12
Abb. 1:Risiko für Fernmetastasierung in Abhängigkeit befallener Lymphknoten bei Frauen mit ER+ frühem Brustkrebs (T1, T2) und fünfjähriger adjuvanter endokriner Therapie (n=74194) (modifiziert nach Hamilton EP et al., Pan H et al.)12,13
Capivasertib: Small Molecule als Pan-AKT-Inhibitor
Capivasertib, ein oral verfügbares Small Molecule, gilt als Pan-AKT-Inhibitor, als Inhibitor aller drei AKT-Isoformen (AKT1, AKT2, AKT3) in der PI3K/AKT/mTOR-Signalkaskade.14–16 In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie CAPItello-291 wurden insgesamt 708 Patient:innen mit fortgeschrittenem AI-resistentem (± CDK4/6i) HR+, HER2– Brustkrebs 1:1 randomisiert: 355 erhielten Capivasertib + Fulvestrant, 353 Placebo + Fulvestrant. Das mediane PFS betrug 7,2 Monate vs. 3,6 Monate (HR: 0,60; 95% CI: 0,51–0,71; p<0,001). Bei Veränderung im AKT-Pathway betrug das mediane PFS 7,3 Monate vs. 3,1 Monate (HR: 0,50; 95% CI: 0,38–0,65; p<0,001). Die häufigsten Nebenwirkungen ≥Grad 3 waren Hautausschlag (12,1% vs. 0,3%), Diarrhö (9,3% vs. 0,3%) sowie Hyperglykämie (2,3% vs. 0,3%).17 Diese Nebenwirkungen traten kurz nach Therapiebeginn mit Capivasertib + Fulvestrant auf: Die mediane Dauer bis zum Auftreten (alle Grade) betrug jeweils 12, 8 und 15 Tage (respektive). Sie konnten mit supportiven Therapiemaßnahmen, Dosisreduktionen, Therapieunterbrechungen und/oder -abbrüchen gemanagt werden. Bedingt durch Nebenwirkungen kam es bei 13% der Patient:innen zum Absetzen von Capivasertib.18
Capivasertib ist zugelassen in Kombination mit Fulvestrant zur Behandlung von Patient:innen mit lokal fortgeschrittenem oder metastasiertem ER+, HER2– Mammakarzinom mit einer oder mehreren PIK3CA/AKT1/PTEN-Alterationen nach Rezidiv oder Progression der Erkrankung während oder nach einer endokrinen Therapie.19
*
https://clinicaltrials.gov/study/NCT05774951
(abgerufen am: 29.04.2025)
**
https://clinicaltrials.gov/study/NCT05952557
(abgerufen am: 29.04.2025)
Literatur:
1 Austria-Codex Fachinformation zu Verzenios® 50mg Filmtabletten, Stand: Juni 2024 2 Rastogi P et al.: Adjuvant abemaciclib plus endocrine therapy for hormone receptor-positive, human epidermal growth factor receptor 2-negative, high-risk early breast cancer: results from a preplanned monarchE overall survival interim analysis, including 5-year efficacy outcomes. J Clin Oncol 2024; 42(9): 987-93 3 Johnston SRD et al.: Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): results from a preplanned interim analysis of a randomised, open-label, phase 3 trial. Lancet Oncol 2023; 24(1): 77-90 4 Johnston SRD et al.: Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2-, node-positive, high-risk, early breast cancer (monarchE). J Clin Oncol 2020; 38(34): 3987-98 5 Austria-Codex Fachinformation zu Kisqali® 200mg Filmtabletten, Stand: November 2024 6 Hortobagyi GN et al.: A phase III trial of adjuvant ribociclib plus endocrine therapy versus endocrine therapy alone in patients with HR-positive/HER2-negative early breast cancer: final invasive disease-free survival results from the NATALEE trial. Ann Oncol 2025; 36(2): 149-57 7 Slamon D et al.: Ribociclib plus endocrine therapy in early breast cancer. N Engl J Med 2024; 390(12): 1080-91 8 Bidard FC et al.: Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: results from the randomized phase III EMERALD trial. J Clin Oncol 2022; 40(28): 3246-56 9Bardia A et al.: Elacestrant in ER+, HER2- metastatic breast cancer with ESR1-mutated tumors: subgroup analyses from the phase III EMERALD trial by prior duration of endocrine therapy plus CDK4/6 inhibitor and in clinical subgroups. Clin Cancer Res 2024; 30(19): 4299-4309 10Austria-Codex Fachinformation zu Orserdu® 86mg Filmtabletten, Stand: November 2023 11 Oliveira M et al.: Camizestrant, a next-generation oral SERD, versus fulvestrant in post-menopausal women with oestrogen receptor-positive, HER2-negative advanced breast cancer (SERENA-2): a multi-dose, open-label, randomised, phase 2 trial. Lancet Oncol 2024; 25(11): 1424-39 12 Hamilton EP et al.: CAMBRIA-1 & CAMBRIA-2 phase III trials: camizestrant versus standard endocrine therapy in ER+/HER2- early breast cancer. Future Oncol 2025; 21(7): 795-806 13 Pan H et al.: 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med 2017; 377(19): 1836-46 14 Browne IM, Okines AFC: Resistance to targeted inhibitors of the PI3K/AKT/mTOR pathway in advanced oestrogen-receptor-positive breast cancer. Cancers (Basel) 2024; 16(12): 2259 15 Shirley M: Capivasertib: first approval. Drugs 2024; 84(3): 337-46 16 Turner NC et al.: A plain language summary of the CAPI tello-291 study: capivasertib in hormone receptor-positive advanced breast cancer. Future Oncol 2024; 20(37): 2901-13 17 Turner NC et al.: Capivasertib in hormone receptor-positive advanced breast cancer. N Engl J Med 2023; 388(22): 2058-70 18 Rugo HS et al.: Capivasertib and fulvestrant for patients with hormone receptor-positive advanced breast cancer: characterization, time course, and management of frequent adverse events from the phase III CAPItello-291 study. ESMO Open 2024; 9(9): 103697 19 Austria-Codex Fachinformation zu Truqap® 200mg Filmtabletten, Stand: Juni 2024
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...