Bispezifische Antikörper und supportive Therapie
Autor:
Prof. Dr. Hartmut Link
ehem. Chefarzt, Klinik für Innere Medizin, Hämatologie und Onkologie, Kaiserslautern,
Sprecher der AG Supportive Therapie der Arbeitsgemeinschaft Internistische Onkologie (AIO) in der Deutschen Krebsgesellschaft
E-Mail: hlink@kabelmail.de
Die Toxizität der Therapie mit bispezifischen Antikörpern (BsAb) bedingt die Implementierung einer Supportivtherapie mit standardisierter Prophylaxe, Diagnostik und abgestuften Reaktionen. Die Kombination der BsAb mit weiterer antineoplastischer Therapie erfordert eine umfangreiche Supportivtherapie.
Keypoints
-
Zu beachten ist das Zytokinfreisetzungssyndrom (CRS).
-
Das Syndrom der Immuneffektorzellen-assoziierten Neurotoxizität (ICANS) ist eher selten. BsAb gegen Malignome des Immunsystems erhöhen das Infektionsrisiko durch bakterielle und opportunistische Erreger, dementsprechend sind eine angepasste Infektionsdiagnostik, konsequente Infektionsprophylaxen, G-CSF bei Neutropenie, Immunglobulinsubstitution bei IgG unter 400mg/dl und Impfungen erforderlich.
-
Auch etablierte Supportivtherapie-Leitlinien z.B. zu Emesisprophylaxe, Anämiemanagement oder Tumorlyse müssen eingehalten werden.
-
Die Standards können mit Onkopti®-Protokollen eingehalten werden.
Monoklonale Antikörper können therapeutisch gegen definierte Epitope auf malignen Zellen gerichtet werden, ebenso können spezielle Epitope der T-Zelle üblicherweise CD3 erkennen und aktivieren. Es sind immer mehr bispezifische Antikörper (BsAb) verfügbar, die periphere und intratumorale Immunzellen aktivieren, welche auf eine FcγR- und MHC-unabhängige Weise gegen Tumorantigene und T-Zellen oder natürliche Killerzellen agieren.1 Es werden „T-cell engagers“ (TCE) und „non-T-cell engagers“ unterschieden, die die natürlichen Killerzellen und Makrophagen zur Zellzerstörung anlocken.2–4
Obwohl die klinische Entwicklung der BsAb bei hämatologischen und soliden Tumoren breit angelegt ist, haben sie sich bei Patient:innen mit B-Non-Hodgkin-Lymphom (B-NHL) und multiplem Myelom (MM) als besonders wirksam erwiesen und stellen den nächsten therapeutischen Meilenstein bei diesen Krankheiten dar.
Beispielsweise sind bei lymphatischen Neoplasien die BsAb Blinatumomab, Epcoritamab, Glofitamab, Mosunetuzumab und Odronextamab aktuell oder demnächst verfügbar, beim multiplem Myelom sind es Elrantamab, Talquetamab, Teclistamab, beim Lungenkarzinom Amivantamab, Tarlatamab und bei uvealem Melanom Tebentafusp. Sicherlich werden weitere BsAb wie z.B. beim Kolonkarzinom oder Mammakarzinom das therapeutische Spektrum erheblich erweitern.
Entsprechend ihren unterschiedlichen Wirkweisen haben BsAb unerwünschte Wirkungen und mögliche Toxizitäten, wie Zytopenien, Durchfall, Transaminasenanstieg und das Tumorlysesyndrom, die auch bei der herkömmlichen Chemotherapie auftreten. Darüber hinaus können, jedoch nur in Zusammenhang mit BsAb, das Zytokinfreisetzungssyndrom (CRS), die Neurotoxizität (einschließlich des Syndroms der Immuneffektorzellen-assoziierten Neurotoxizität [ICANS]) und das Aufflackern des Tumors auftreten.
Das erhöhte Risiko unter TCE-BsAb für bakterielle, virale und opportunistische Infektionen bei der BsAb-Therapie wird auf BsAb-induzierte T-Zell-Erschöpfung, Neutropenie und Hypogammaglobulinämie zurückgeführt. Dieses erhöhte Risiko ergibt sich sowohl aus der direkten T-Zell-Aktivierung als auch aus „On-target off-tumor“-Toxizitäten, bei denen Antikörperziele nicht nur auf Tumorzellen, sondern auch auf einigen gesunden Geweben vorhanden sind.
Exemplarisch hierfür sind die Depletion von B-Zellen durch die Bindung von CD19- und CD20-Antikörpern, die Eliminierung normaler Plasmazellen und Antikörper durch B-Zell-Reifungsantigene, die von Antikörpern angegriffen werden, und Zytopenien durch die Bindung von Antikörpern an CD123/CD33. Patient:innenspezifische Faktoren, wie eine krebsbedingte Immunschwäche und frühere Krebsbehandlungen, können diese Effekte verstärken.
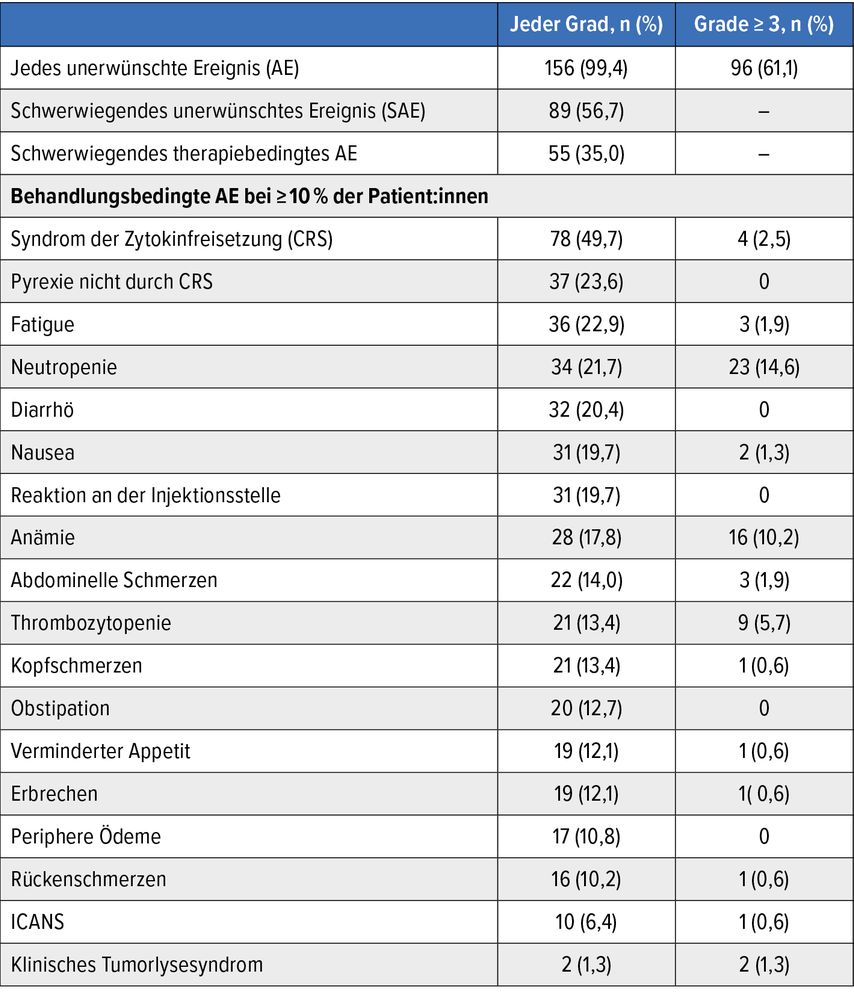
Aus der Studie mit diffusem großzelligem B-Zell-Non-Hodgkin-Lymphom (B-NHL) sind typische Nebenwirkungen am Beispiel von Epcoritamab, einem BsAb gegen CD3- und CD20-Antigene, in Tab. 1 dargestellt.5
Tab. 1: In der Studie mit Epcoritamab unter der Behandlung auftretende AE nach dem höchsten Grad bei Patient:innen mit diffusem großzelligem B-Zell-Lymphom (modifiziert nach Thieblemont C et al.)5
Die Toxizität kann zwischen den Antikörpern unterschiedlich sein, je nach Zielantigen und aktivierten Immunzellen. Insbesondere die im Vergleich zur bisher üblichen antineoplastischen Therapie neuen Toxizitäten wie CRS und ICANS müssen beachtet werden.
Dazu gibt es Leitlinien von ASCO und ASH mit genaueren Hinweisen zur Prophylaxe und Therapie.6,7
Zytokinfreisetzungssyndrom
Das Zytokinfreisetzungssyndrom (CRS) wird durch die Freisetzung von Zytokinen und die anschließende systemische Entzündung verursacht. Zu den klinischen Manifestationen von CRS gehören hohes Fieber, Hautausschlag, Erbrechen und Übelkeit. Das CRS kann auf eine abnorme Aktivierung von Effektor-T-Zellen und Makrophagen zurückgeführt werden, die durch BsAb ausgelöst wird. Die Aktivierung von T-Zellen setzt große Mengen an IFN-γ und anderen Zytokinen frei, die ihrerseits Makrophagen dazu veranlassen, viel IL-6 und IL-10 freizusetzen. IL-6 spielt hierbei eine zentrale Rolle.
Das CRS aller Grade wird bei etwa 55–80% der Patient:innen mit rezidiviertem oder refraktärem (r/r) multiplem Myelom und bei 45–65% der Patient:innen mit B-NHL beobachtet. Ein schweres CRS (Grad ≥3) ist relativ selten und betrifft 0–4% der Patient:innen.6 Ein schweres CRS kann durch die Prophylaxe mit Dexamethason und eine schrittweise Aufdosierung verhindert werden. Tocilizumab, ein monoklonaler Antikörper gegen den IL-6-Rezeptor, ist therapeutisch wirksam.
Zytopenien
Bei allen BsAb können vorübergehende Zytopenien auftreten, obwohl dies bei Patient:innen mit r/r multiplem Myelom (MM) häufiger vorkommt als bei r/r NHL. In den prospektiven Studien wurde bei 30–75% der Patient:innen mit r/r MM eine Neutropenie, bei 35–60% eine Anämie und bei 25–40% eine Thrombozytopenie festgestellt. Bei Patient:innen mit r/r NHL wird eine Neutropenie bei 20–40%, eine Anämie bei 15–45% und eine Thrombozytopenie bei 10–25% beschrieben. Die meisten dieser Zytopenien sind von Grad ≥3, mit Ausnahme der Anämie bei Patient:innen mit NHL. Hämatologische Toxizität ist die häufigste Toxizität von ≥Grad 3 bei der Verwendung von BsAb.6
Infektionen
BsAb sind immunsuppressiv und führen zu einer Zunahme von Infektionen. Die Häufigkeit und die Art der Infektionen können sich zwischen den BsAb unterscheiden. Insbesondere bei Patient:innen, die mit den Anti-BCMA(„B-cell maturation antigen“)-BsAb Teclistamab und Elranatamab behandelt worden sind, scheint die Infektionsrate höher zu sein (70–80%) als bei den anderen BsAb, wobei Talquetamab 34–47% der Infektionen und die Anti-CD20-BsAb 20–45% der Infektionen bei behandelten Patient:innen verursachen.
Für diese hohe Infektionsrate bei Anti-BCMA-BsAb können mehrere Faktoren verantwortlich sein, wie z.B. Neutropenie, T-Zell-Erschöpfung, B-Zell-Aplasie, gestörte BCMA-Signalübertragung, aber auch die beobachtete Hypogammaglobulinämie kann sehr ausgeprägt sein.8
Die Vorbeugung von Infektionen ist von allergrößter Bedeutung. Es wird dringend empfohlen, alle Patient:innen, insbesondere aber Patient:innen mit r/r MM, vor Beginn der BsAb-Therapie gegen das Varizella-zoster-Virus (VZV) und Pneumokokken sowie jährlich gegen Influenza und Covid-19 zu impfen. Auch Tests auf HIV und Hepatitis B und C werden vor Beginn der Behandlung durchgeführt. Zytomegalovirus- und EBV-Tests können hinzugefügt werden. Darüber hinaus wird eine Prophylaxe gegen Pneumocystis jirovecii (PJP) und Herpes-simplex-Viren/VZV empfohlen, und bei Patient:innen mit r/r MM sollte eine antibakterielle Prophylaxe in Betracht gezogen werden, insbesondere wenn eine Neutropenie Grad 3/4 vorliegt.
Retrospektive Analysen deuten darauf hin, dass ein frühzeitiger Beginn der IgG-Ersatztherapie die Inzidenz von Infektionen auf 5,3% senken könnte und dies bei allen Patient:innen mit niedrigen IgG-Spiegeln (IgG <400mg/l) in Betracht gezogen werden sollte.6
Schlussfolgerung
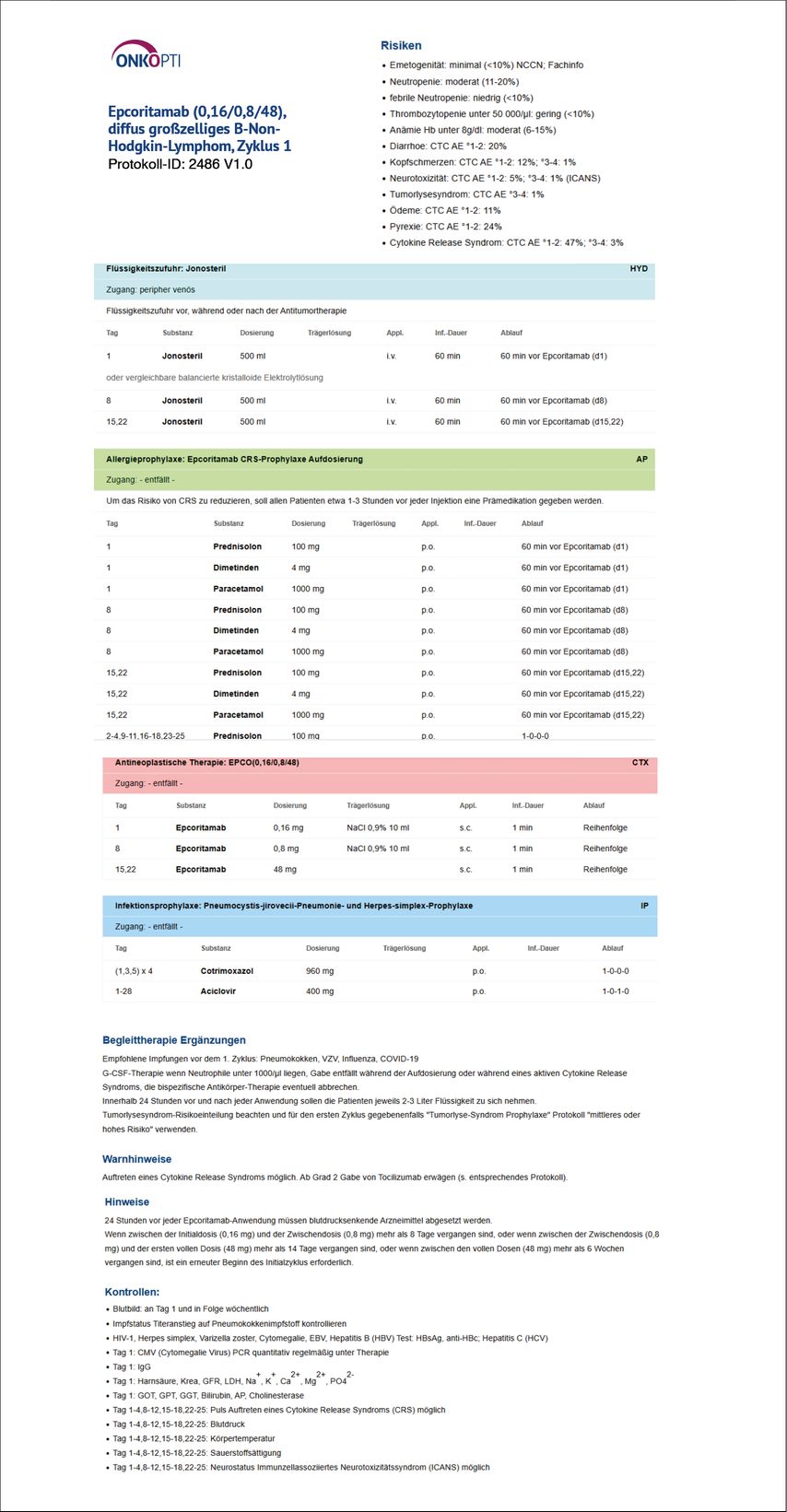
Die Supportivtherapie ist daher auch bei vermeintlich einfachen Protokollen der antineoplastischen Therapie sehr komplex. In der Datenbank Onkopti® ( www.onkopti.de ) mit über 2700 digitalisierten Protokollen können entsprechende Protokolle aller Fachgebiete eingesehen und auch zum Import in Anwendungssysteme heruntergeladen werden.9 In diesen Protokollen sind die relevanten Risiken eines Therapieprotokolls angegeben sowie auch die entsprechende leitlinienbasierte Supportivtherapie (Abb. 1).
Abb. 1: Erster Zyklus des Therapieprotokolls mit dem BsAb Epcoritamab bei diffusem großzelligem Non-Hodgkin-Lymphom aus der Onkopti-Datenbank (www.onkopti.de) mit der erforderlichen Supportiv- und Begleittherapie (modifiziert nach Thieblemont C et al.)5
Literatur:
1 Herrera M et al.: Bispecific antibodies: advancing precision oncology. Trends Cancer 2024; 10(10): 893-919 2 Kohler J et al.: Treating EGFR exon 20-mutant cancers with bispecific antibody-mediated receptor degradation. J Clin Oncol 2021; 39(30): 3403-6 3 Lim K et al.: Clinical pharmacology strategies for bispecific antibody development: learnings from FDA-approved bispecific antibodies in oncology. Clin Pharmacol Ther 2024; 116(2): 315-27 4 Surowka M, Klein C: A pivotal decade for bispecific antibodies? MAbs 2024; 16(1): 2321635 5 Thieblemont C et al.: Epcoritamab, a novel, subcutaneous CD3xCD20 bispecific T-cell-engaging antibody, in relapsed or refractory large B-cell lymphoma: dose expansion in a phase I/II trial. JClin Oncol 2023; 41(12): 2238-47 6 Braun A et al.: Bispecific antibody use in patients with lymphoma and multiple myeloma. ASCO 2024; 44(3): e433516 7 Crombie JL et al.: Consensus recommendations on the management of toxicity associated with CD3xCD20 bispecific antibody therapy. Blood 2024; 143(16): 1565-75 8 Lancman G et al.: IVIg use associated with ten-fold reduction of serious infections in multiple myeloma patients treated with anti-BCMA bispecific antibodies. Blood Cancer Discov 2023; 4(6): 440-51 9 Link H et al.: Digitalization and standardization oncology drug therapy plans with the Onkopti database for online publication and import into software. Oncology 2024: 1-19
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...