Bispezifische Antikörper bei indolenten und aggressiven Lymphomen
Autorin:
Prof. Dr. med. Felicitas Hitz
Onkologie/Hämatologie
Kantonsspital St.Gallen
E-Mail: felicitas.hitz@kssg.ch
Die bispezifischen Antikörper haben in der Behandlung der indolenten und aggressiven Lymphome einen festen Stellenwert erlangt. Anfänglich wurden Studien zu bispezifischen Antikörpern bei verschiedenen Subtypen der indolenten und aggressiven Lymphome durchgeführt. Nun liegen die Ergebnisse von grossen Phase-II/III-Studien für follikuläre Lymphome und für grosszellige B-Zell-Lymphome vor. Im folgenden Text werden die wichtigsten erläutert.
Keypoints
-
T-Zell-aktivierende Substanzen wie bispezifische Antikörper und CAR-T-Zell-Behandlungen haben die Behandlungsalgorithmen der Lymphomtherapien entscheidend verändert.
-
Die bispezifischen Antikörper sind im Rezidiv der Behandlung für follikuläre Lymphome wie auch für diffuse grosszellige Lymphome eine wirksame und bei sachgemässer Anwendung eine komplikationsarme Behandlungsoption.
-
Die Erstgabe sollte unter stationären Bedingungen und mit einer Dexamethason-Prämedikation und einer schrittweisen Aufdosierung eingeleitet werden.
Wirkmechanismus der bispezifischen Antikörper
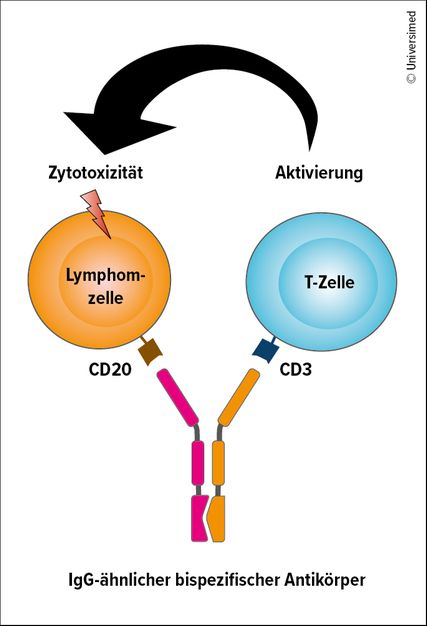
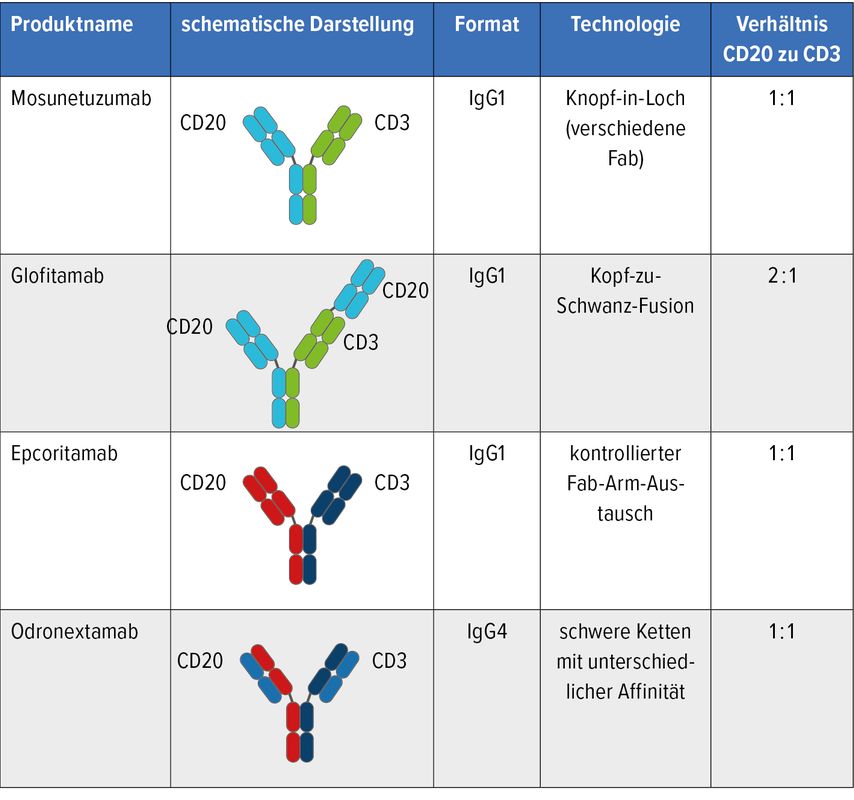
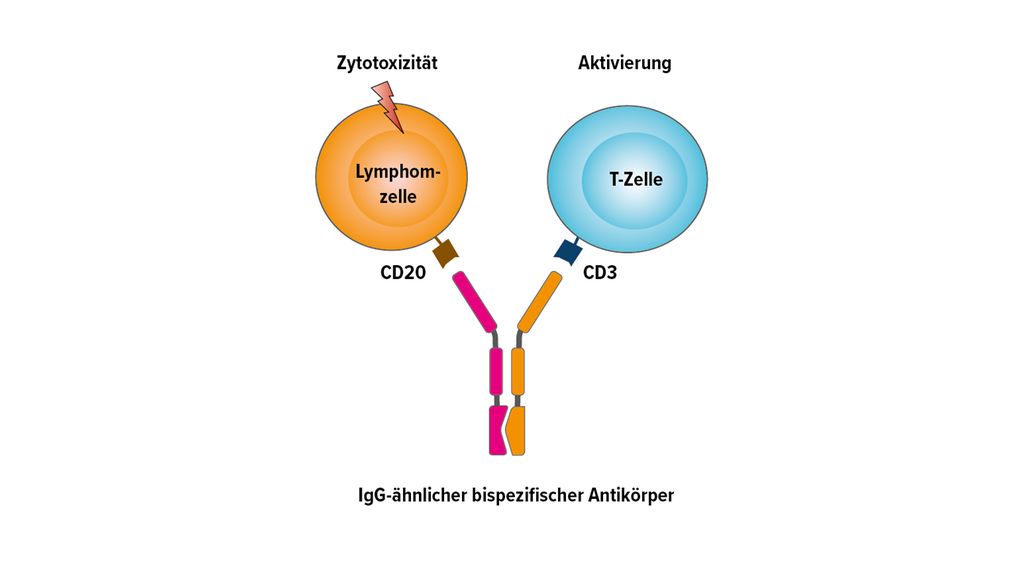
Der Wirkmechanismus der bispezifischen Antikörper basiert auf der Verbindung von T-Zell-Rezeptoren und einem tumorspezifischen Antigen der Lymphomoberfläche (Abb.1). Die derzeit in den klinischen Studien am weitesten entwickelten bispezifischen Antikörper (Glofitamab, Epcoritamab, Odronextamab, Mosunetuzumab) sind vergleichbar mit einer IgG-ähnlichen Antikörperstruktur. Die T-Zell-Aktivierung findet über die Verbindung von CD3 und CD20 statt (Abb.2).
Abb. 2: Die vier bisher am weitesten entwickelten bispezifischen Antikörper (modifiziert nach FalchiL et al.)2
Die überschiessende T-Zell-Aktivierung verursacht eine charakteristische Nebenwirkung, das Zytokinfreisetzungssyndrom (CRS). Deutlich seltener als unter CAR-T-Zell-Behandlung kommt es bei bispezifischen Antikörpern zu neurologischen Symptomen. Das Risiko einer schweren Komplikation wird durch eine Vorbehandlung, die schrittweise Aufdosierung und durch eine subkutane Verabreichung reduziert.
Die Prämedikation mit Dexamethason führt zu einer deutlich geringeren Ausprägung von CRS und ist daher als Standard etabliert.1 Für Glofitamab ist vor der Erstgabe eine Applikation von Obinutuzumab empfohlen, was die Akuttoxizität ebenfalls abmildert.2 Alle bispezifischen Antikörper werden in einer schrittweisen Aufdosierung initial stationär verabreicht. Die subkutane Applikation führt zu einer verzögerten und weniger hohen Peak-Konzentration als die intravenöse Verabreichung, was wiederum zu einer geringeren Ausprägung von CRS beiträgt.
Aggressive Lymphome
Die bispezifischen Antikörper (Glofitamab, Epcoritamab, Odronextamab) mit den beiden Anknüpfungsstellen auf dem T-Zell-Rezeptor CD3 und dem B-Zell-Rezeptor CD20 sind für grosszellige B-Zell Lymphome abschliessend getestet. In anderen Entitäten der aggressiven B-Zell-Lymphome, wie beispielsweise beim Mantelzell-Lymphom, sind bisher Daten aus einer Phase-I/II-Studie mit einer kleinen Population vorliegend.3
Monotherapie im Rezidiv
Die bispezifischen Antikörper Epcoritamab, Glofitamab und Odronextamab sind in der Rezidivsituation als Monotherapie für grosszellige B-Zell-Lymphome geprüft. Eingeschlossen wurden Patient:innen, die mindestens zwei vorhergehende Therapielinien erhalten hatten und einen guten ECOG-Performance-Status, ein diffuses grosszelliges B-Zell-Lymphom (DLBCL), ein transformiertes follikuläres Lymphom (FL), ein primär mediastinales Lymphom oder ein High-Grade-Lymphom mit MYC- und BCL2-/BCL6-Translokation hatten.
Die Prämedikation und Dosissteigerung von Glofitamab und Epcoritamab sind unterschiedlich, ebenso die Dauer der Behandlung. Glofitamab wird über einen definierten Zeitraum von zwölf Zyklen dosiert, während Epcoritamab bis zum Krankheitsprogress verabreicht wird.
Das Ansprechen, die Toxizität und die Wirksamkeit der Monotherapie mit Glofitamab und Epcoritamab im Rezidiv sind vergleichbar, mit CR 39%, ORR 52% respektive CR 39%, ORR 63%.4,5 Odronextamab zeigt eine etwas niedrigere Ansprechrate mit CR/OR von 31% vs. 52%.6
Nach einer Verlaufsbeobachtung von mittlerweile drei Jahren (medianes Follow-up: 37,7 Monate) zeigen mit Glofitamab behandelte Patient:innen mit einer kompletten Remission nach zwölf Behandlungszyklen eine Rate des 24-monatigen Gesamtüberlebens von 77%.7
Wiederum vergleichbar sind die Ergebnisse mit Epcoritamab in kontinuierlicher Applikation (medianes Follow-up: 37,1 Monate) mit 63% der Patient:innen in anhaltend kompletter Remission nach drei Jahren.8
Kombinationstherapie im Rezidiv
Die Kombinationsbehandlungen mit einer Standard-Salvage-Chemotherapie im Rezidiv eines diffusen grosszelligen B-Zell-Lymphoms zeigt für Glofitamab+Rituximab-GemOx vs. Rituximab-GemOx bei nicht transplantationsfähigen Patient:innen nach einer medianen Verlaufsbeobachtung von 27 Monaten einen Überlebensvorteil von 25,5 Monaten (18,3–NE) vs. 12,9 Monate (7,9–18,5) (HR [95% CI]: 0,62 [0,43–0,88]; p=0,006). Mit diesem Ergebnis wurde erstmals für einen CD3xCD20-bispezifischen Antikörper in einer Phase-III-Studie der primäre Studienendpunkt Gesamtüberleben erreicht.9
Für Epcoritamab in Kombination mit Rituximab-GemOx wurde kürzlich eine Phase-Ib/II-Studie publiziert. Eingeschlossen wurden ebenfalls Patient:innen, die für eine Transplantation nicht qualifizieren und eine oder mehrere Vorbehandlungen hinter sich haben. Ein deutlicher Unterschied zeigt sich im Ansprechen in Abhängigkeit von der Anzahl an Vorbehandlungen (CR Erstlinie: 74% vs. CR >Zweitlinie: 53%). Die mediane Dauer der kompletten Remission lag bei 23,6 Monaten.10
Bispezifische Antikörper sind basierend auf diesen Ergebnissen ideale Kombinationspartner zur Standard-Salvage-Immunchemotherapie mit Rituximab-Gemcitabin/Oxaliplatin sowohl vor einer autologen Stammzelltransplantation als auch als Bridging vor einer CAR-T-Zell-Behandlung.
Erstlinientherapie
Mit Spannung werden die Ergebnisse mehrerer Phase-III-Studien mit Patient:innen mit grosszelligen Lymphomen in der ersten Therapielinie einer Standard-Immun-Chemotherapie mit bispezifischen Antikörpern erwartet. Sämtliche Phase-III-Studien haben Hochrisikopatient:innen mit grosszelligen B-Zell-Lymphomen basierend auf einem hohen IPI-Score eingeschlossen. Bei allen hier erwähnten Studien wurden primäre ZNS-Lymphome ausgeschlossen.
Die Studie SKYGLO untersucht Glofitamab in Kombination mit Polatuzumab-Rituximab-CHP gegen eben diesen Standard-Arm. Die Rekrutierung dieser internationalen Studie wurde im Herbst 2024 abgeschlossen.11 Eine randomisierte Phase-III-Studie mit Epcoritamab+Rituximab-CHOP hat als Standard-Arm Rituximab-CHOP gewählt.12 Eine weitere Studie mit Odronextamab verwendet keinen ergänzenden CD20-Antikörper und ist nur mit Odronextamab+CHOP konzipiert, da die Bindungsstelle am CD20-Antigen identisch zu Rituximab respektive Obinutuzumab ist.13
Indolente Lymphome
Monotherapie im Rezidiv
In den Phase-II-Studien für rezidivierte follikuläre Lymphome liegen die Daten der bispezifischen Antikörper Mosunetuzumab,14 Epcoritamab15 und Odronextamab16 nach mehr als zwei Vorbehandlungen vor.
Die Studien unterscheiden sich in der Art der Applikation, wobei Mosunetuzumab und Odronextamab intravenös verabreicht wurden und Epcoritamab subkutan. Mosunetuzumab und Odronextamab wurden als terminierte Behandlungen geprüft, Epcoritamab bis zur Krankheitsprogression. Vergleichbar sind die Gesamtansprechraten vom ≈80% und die Raten der kompletten Remissionen: Mosunetuzumab mit 60%, Epcoritamab mit 62,5% und Odronextamab mit 73% bei ebenfalls vergleichbaren CRS von Grad 1 bei 45% und neurologischen Toxizitäten von Grad 1 bei 5%. Die häufigste Nebenwirkung aller Substanzen war eine Neutropenie bei ≈25%.
Mosunetuzumab, die Substanz mit der längsten Verlaufsbeobachtung, zeigt nach einer medianen Beobachtungszeit von 37,4 Monaten ein medianes PFS von 24 Monaten (95% CI: 12,0–NE).17 Mosunetuzumab zeigt auch für die ungünstige Gruppe der Lymphome mit einer Progression innerhalb von zwei Jahren und TP53-Mutation und für refraktäre Lymphome nach einer Erstlinien-Immun-Chemotherapie ein medianes PFS von 17,8 Monaten und ein noch nicht erreichtes medianes OS.14,18
Die NHL-1-Studie mit Epcoritamab zeigt nach einer Verlaufsbeobachtung von 17,4 Monaten eine PFS-Rate von 49,8% (39,0–59,1) für alle Patient:innen mit Therapieansprechen und bei Erreichen einer kompletten Remission eine PFS-Rate von 73,8%.15 Odronextamab hat nach einer Verlaufsbeobachtung von 20,1 Monaten ein medianes PFS von 20,7 Monaten (95% CI: 17,2–27,5) und für komplette Remissionen ein PFS von 27,8 Monaten (95% CI: 23,0–NE).16
Kombinationstherapie im Rezidiv
In der Indikation nach einer oder mehreren Vorbehandlungen werden derzeit alle drei der zuletzt besprochenen bispezifischen Antikörper in einer Phase-III-Studie geprüft (CELESTIMO, EPCORE FL-1, OLYMPIA-5).19–20 Noch liegen keine Daten für den primären Endpunkt aller drei Studien vor, das PFS.
Als Standardarm wurde Rituximab+Lenalidomid (R2) definiert, ein etabliertes chemotherapiefreies Behandlungskonzept im Rezidiv für follikuläre Lymphome, das in der Phase-III-Studie AUGMENT nach sechs Behandlungszyklen ein medianes PFS von 40 Monaten zeigt.21 Die Behandlung wird für alle drei bispezifischen Antikörper über eine fixe Dauer von zwölf Zyklen verabreicht.
Die ersten publizierten Ergebnisse für Epcoritamab+R2 in EPCORE FL-1 nach zwölf Zyklen beschränken sich auf die Ergebnisse des experimentellen Studienarms nach einer Verlaufsbeobachtung von mindestens zwei Jahren. Eingeschlossen wurden auch Hochrisikopatient:innen mit Progression nach Immunchemotherapie POD24 und primär refraktäre Patient:innen.
Die meisten Patient:innen waren mit Anthrazyklinen oder Alkylantien vorbehandelt, nur sehr wenige hatten bereits eine CAR-T-Zell-Therapie hinter sich. Die ORR lag bei 96% und die CR-Rate bei 87%, unabhängig von der Risikokonstellation. Das geschätzte 24-Monats-PFS betrug 70%.19
Für die CELESTIMO-Studie mit Mosunetuzumab+Lenalidomid vs. Rituximab+Lenalidomid für Patient:innen mit mehr als einer oder mehr Vorbehandlungen werden erste Ergebnisse bald präsentiert.19
Für die Phase-III-Studie OLYMPIA-5 mit Odronextamab sind bisher keine Daten publiziert.20
Zusammenfassung
Die bispezifischen Antikörpern haben in der Lymphomtherapie massiv an Bedeutung gewonnen und den Behandlungsalgorithmus neu definiert. Sowohl als Monotherapien im Rezidiv eines grosszelligen Lymphoms als auch in der Kombinationsbehandlung mit einer Immun-Chemotherapie führen sie zu einem guten Ansprechen und nach Erreichen einer kompletten Remission zu einer langen progressionsfreien Zeit.
Bei den follikulären Lymphomen sind chemotherapiefreie Behandlungskonzepte bereits etabliert und werden nun durch die noch laufenden Phase-III-Studien mit hoher Wahrscheinlichkeit zu einer weiteren chemotherapiefreien Behandlungsoption.
Literatur:
1 Crombie JL et al.: Consensus recommendations on the management of toxicity associated with CD3 x CD20 bispecific antibody therapy. Blood 2024; 143(16): 1565-75 2 Falchi L et al.: Bispecific antibodies for the treatment of B-cell lymphoma: promises, unknowns, and opportunities. Blood 2023; 141(5): 467-80 3 Phillips TJ et al.: Glofitamab in relapsed/refractory mantle cell lymphoma: results from a phase I/II study. J Clin Oncol 2024; 43(3): 318-28 4 Dickinson MJ et al.: Glofitamab for relapsed of refractory diffuse large B-cell lymphoma. New Engl J Med 2022; 387(24): 2220-31 5 Thieblemont C et al.: Epcoritamab, a novel, subcutaneous CD3 x CD20 bispecific T-cell engaging antibody, in relapsed or refractory large B-cell lymphoma: dose expansion in a phase I/II trial. J Clin Oncol 2023; 41(12) 6 Ayyappan S et al.: Final analysis of the phase 2 ELM-2 study:odronextamab in patients with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL). Blood 2023; Abstr. #436 7 Dickinson MJ et al.: Fixed-duration glofitamab monotherapy continues to demonstrate durable responses in patients with relapsed or refractory large B-cell lymphoma: 3-year follow-up from a pivotal phase II study. ASH 2024; Abstr. #865 8 Vose JM et al.: 3-year update from the EPCORE NHL-1 trial: epcoritamab leads to deep and durable responses in relapsed or refractory large B-cell lymphoma. ASH 2024; Abstr. #4480 9 Abramson JS et al.: Glofitamab plus gemcitabine and osaliplatin (GemOx) versus rituximab-GEmOs for relapsed or refractory diffuse large B-cell lymphoma (STARGLO): a global phase 3, randomized, open-label trial Lancet 2024; 404(10466): 1940-54 10 Brody JD et al.: Epcoritamab plus GemOx in transplant-ineligible relapsed/refractory DLBCL: results from the EPCORE NHL-2 trial. Blood 2025 11 Advani RH et al.: SKYGLO: a global phase III randomized study evaluating glofitamab plus polatuzumab vedotin + rituximab, cyclophosphamide, doxorubicin, and prednisone (Pola-R-CHP) versus Pola-R-CHP in previously untreated patients with large B-cell lymphoma (LBCL). ASH 2024; Abstr. #1718.1 12 Sehn LH et al.: Phase 3 trial of subcutaneous epcoritamab + RCHOP versus R-CHOP in patients (pts) with newly diagnosed diffuse large B-cell lymphoma (DLBCL): EPCORE DLBCL-2. Hematol Oncol 2023; 41(S2): 849-50 13 Tessoulin B et al.: Trial in progress: Phase 3 trial evaluating the efficacy and safety of odronextamab plus CHOP (O-CHOP) versus R-CHOP in previously untreated diffuse large B-cell lymphoma (OLYMPIA-3). Hemasphere 2023; 7(S3): e06798be 14Budde LE et al.: Safety and efficacy of mosunetuzumab, a bispecific antibody, in patients with relapsed or refractory follicular lymphoma: a single-arm, multicentre, phase 2 study. Lancet Oncol 2022; 23(8): 1055-65 15 Linton KM et al.: Epcoritamab monotherapy in patients with relapsed or refractory follicular lymphoma (EPCORE NHL-1): a phase 2 cohort of a single-arm, multicentre study. Lancet Haematol 2024; 11(8): e593-605 16 Kim TM et al.: Safety and efficacy of odronextamab in patients with relapsed or refractory follicular lymphoma. Ann Oncol 2024; 35(11): 1039-47 17 Sehn LH et al.: Long-term 3-year follow-up of mosunetuzumab in relapsed or refractory follicular lymphoma after ≥2prior therapies. Blood 2025; 145(7): 708-19 18 Assouline S et al.: Mosunetuzumab demonstrates clinically meaningful outcomes in high-risk patients with heavily pre-treated R/R FL after ≥3 years of follow-up: subgroup analysis of a pivotal phase II study. EHA 2024; Abstr. #S233 19 Falchi L et al.: Fixed-duration epcoritamab + R2 drives deep and durable responses in patients with relapsed or refractory follicular lymphoma: 2-year follow-up from arm 2 of the EPCORE NHL-2 trial. Blood 2024; 144(Suppl. 1): 342 20 Vitolo U et al.: Phase 3 trial of odronextamab plus lenalidomide versus rituximab plus lenalidomide in relapsed/refractory (R/R) follicular lymphoma (FL) and marginal zone lymphoma (MZL; OLYMPIA-5). ASCO 2022; Abstr. #TPS7094 21 Leonard JP et al.: AUGMENT: a phase III study of lenalidomide plus rituximab versus placebo plus rituximab in relapsed or refractory indolent lymphoma. JClin Oncol 2019; 37(14): 1188-99
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...