Biomarker zur molekularen Risikostratifikation beim Prostatakarzinom
Autorin:
PD Dr. med. Angelika Borkowetz
Klinik und Poliklinik für Urologie, Universitätsklinikum Carl Gustav Carus Dresden
Technische Universität Dresden
Neben den bisher genutzten Biomarkern treten für Diagnose, Prognose und Prädiktion des Prostatakarzinoms neue RNA- wie auch Protein-basierte Marker oder zellfreie Nukleinsäuren in den Vordergrund.
Das Prostatakarzinom (PCa) ist die häufigste Krebserkrankung und die dritthäufigste Krebstodesursache beim Mann weltweit.1 Die Früherkennung des PCa beruht zum einen auf der Testung des Prostata-spezifischen Antigens (PSA) im Serum und zum anderen auf der digital-rektalen Untersuchung.2
Jedoch ist das PSA zwar mit einer hohen Sensitivität, aber mit einer geringen Spezifität verbunden und weist eine Abhängigkeit vom Prostatavolumen und Alter des Patienten auf,3 sodass es als Biomarker in der Diagnostik des PCa kritisch bewertet wird.3 Bei einem erhöhten PSA-Wert oder einer auffälligen digital-rektalen Untersuchung ist eine Prostatabiopsie zur histologischen Sicherung eines PCa indiziert.2
Aufgrund ihrer hohen Sensitivität und Spezifität in der Darstellung tumorspezifischer Läsionen in der Prostata4–7 sind die Magnetresonanztomografie (MRT) und die damit mögliche gezielte Biopsie in der Diagnostik des PCa essenziell.4–7
Die Rolle neuer Biomarker
Weitere Biomarker werden in Zukunft eine diagnostische, prädiktive und prognostische Rolle in der Diagnostik und Therapie des PCa spielen. In der Diagnostik können sie hierbei in Hinischt auf die Indikationsstellung zur invasiveren Diagnostik oder über die Notwendigkeit weiterführender Diagnostik wie Rebiopsien eine Aussage treffen.
Prädiktive und prognostische Marker können die Tumoraggressivität besser stratifizieren und damit eine bessere Voraussage eines Therapieerfolgs oder Ansprechens auf eine Therapie ermöglichen. Dies ist für die Beratung der Patienten und die Entscheidung für die passende Therapie sowohl beim lokal begrenzten als auch beim metastasierten PCa essenziell.
Die Gewinnung von Biomarkern
Mögliche Biomarker beim PCa können über eine sogenannte «liquid biopsy» aus Körperflüssigkeiten wie Urin oder Blut oder auch aus dem Gewebe bestimmt werden. Exosomen (extrazelluläre Vesikel), in denen sowohl RNA- als auch Protein-basierte Marker nachweisbar sein können, oder zellfreie Nukleinsäuren (RNA, DNA) aus Serum, Plasma bzw. Urin können dabei genutzt werden.
Aus dem Blut können ebenso aus den zellulären Bestandteilen tumorspezifische RNA, DNA oder Proteine aus zirkulierenden Tumorzellen extrahiert werden. Auf RNA-Basis können sowohl Messenger-RNA (mRNA), nichtkodierende RNA oder regulatorisch wirkende Mikro-RNA (miR) als Biomarker eine Rolle spielen. Neben den Körperflüssigkeiten sind RNA, DNA oder Proteine Marker auf dem Tumorgewebe.8–10
Biomarkerpanels: eine Übersicht
Letztendlich können Mutationen (im Genom, also der DNA), die veränderte Expression (auf RNA-Ebene), die veränderte Funktion (auf Proteinebene) und sowohl die Morphologie (Bildgebung, Klinik) als auch Biomarker gemessen werden.
Einzelne Biomarker, aber auch Biomarkerpanels können in der Diagnostik und in der Risikostratifizierung beim PCa angewendet werden. Im Folgenden wird nun eine Übersicht über einzelne Biomarker gegeben. Ein Grossteil der hier genannten Biomarkerpanels kann kommerziell erworben werden.
Gewebebasierte Biomarker
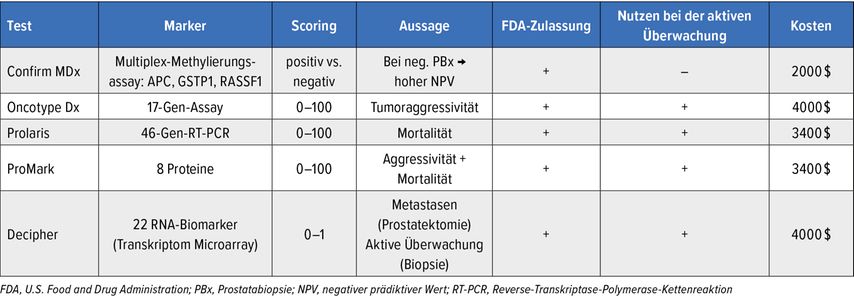
Prädiktive und prognostische Biomarkerpanels sind meist gewebebasiert. Hier zu erwähnen sind der ConfirmMDx®-, der OncotypeDx®-, der Prolaris®-, der Decipher®- oder der ProMark®-Test (Tab. 2).9
Tab. 2: Überblick über prädiktive und prognostische Biomarker beim PCa. Modifiziert nach Lokeshwar SD et al. 20229
Der Oncotype DX Genomic Prostate Score® (GPS) ist ein auf 17 Genen basierter Assay, der die Tumoraggressivität und das rezidivfreie Überleben anhand das Prostatabiopsiepräparats voraussagen kann.18,19
Der Decipher®-Test wiederum nutzt transkriptomweite RNA-Expressionsanalysen für 22 RN-Biomarker am in Paraffin eingebetteten Gewebe.20 Wie der OncotypeDx®-Test ist auch der Decipher®-Test von der FDA (U.S. Food and Drug Administration) zugelassen. Er dient v.a. der Voraussage von Metastasen anhand des Prostatektomiepräparats und der Voraussage der Tumorprogression bei Patienten mit aktiver Überwachung bei Niedrig- bis Intermediär-Risiko-PCa am Biopsiepräparat.9
Blutbasierte Biomarker
Blutbasierte diagnostische Biomarker-Panels sind neben dem PSA der Prostate Health Index (phi), der 4Kscore®- und der Proclarix-Test®. Einzelne miR (miR-223, miR-24 oder miR-375) oder Kombinationen aus miR scheinen ein PCa voraussagen zu können.
Urinbasierte Biomarker
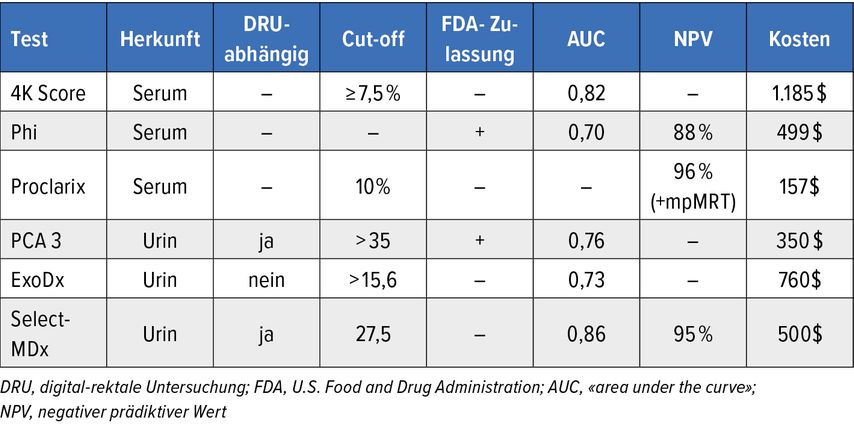
Urinbasierte diagnostische Biomarker sind die nichtkodierende RNA «Prostate Cancer Antigen Gene 3» (PCA3) oder solche, die über die Biomarker-Tests SelectMDx® oder Michigan Prostate Score (MiPS) ermittelt werden können8 (Tab. 1).
Tab. 1: Vergleich diagnostischer Marker in der Detektion eines signifikanten Prostatakarzinoms. Modifiziert nach Becerra MF et al. 20198
Auch im Urin nachgewiesene miR (miR-222-3p, miR24-3p, miR-30c-5p) oder Peptid-Panels können ein PCa voraussagen (Tab. 1).11
Spezifische Tests und ihre Kapazitäten
PCA3-Test
Der PCA3-Test ist mit PCA3 als nichtkodierender RNA ein genetischer Test für Urin. Er hat bei aggressiveren PCA eine grössere Voraussagekraft.12 In Kombination mit einer MRT konnte nachgewiesen werden, dass ein positiver PCA3-Test bei unauffälliger MRT oder unklaren Befunden in der MRT ein aggressives PCa voraussagen kann und somit eine Entscheidungshilfe in Bezug auf die Durchführung einer Prostatabiopsie darstellen könnte.13
Prostate Health Index
Der Prostate Health Index (phi), eine Kombination der Serummarker totales PSA, freies PSA und der [-2]proPSA, bietet eine bessere Voraussage zur Detektion eines PCa, insbesondere wenn hierzu das Verhältnis zum Prostatavolumen, der sogenannten phi-Dichte, genutzt wird.14
Proclarix®-Risiko-Score
Ein noch nicht durch die FDA oder die EMA (Europäische Arzneimittel-Agentur) genehmigter Test ist der Proclarix®-Risiko-Score. Dieser blutbasierte Risikoscore aus Thrombospondin-1, Cathepsin D, totalem PSA, freiem PSA und dem Patientenalter kann insbesondere in Kombination mit einer MRT mit einer Sensitivität von 97%, einer Spezifität von 26% und einem hohen negativen Vorhersagewert von 96% das Vorhandensein eines PCa voraussagen.15
Je aggressiver das PCa, desto höher auch der Risikoscore.15 Auch hier gilt wieder: Insbesondere Patienten mit einer negativen MRT oder unklaren Läsionen profitieren von einer molekularen Risikostratifizierung mittels des Proclaris®-Risiko-Scores.16
Stockholm-3-Test
Ein vielversprechender Marker in der Detektion eines PCa, aber auch als Entscheidungshilfe in Bezug auf die Durchführung einer Biopsie ist der Stockholm-3(STHLM3)-Test, der eine blutbasierte Markerkombination aus totalem PSA, freiem PSA, intaktem PSA, Hexokinase 2 (hk2) sowie genetischen Polymorphismen (232 «single nucleotid polymorphisms») darstellt.
Die Nutzung dieses Markers in Kombination mit der MRT betrifft v.a. seinen Einsatz in der Risikostratifizierung zur Durchführung einer Biopsie. Insgesamt führt sein Einsatz zu einer höheren Detektionsrate aggressiverer PCa und zur Vermeidung von Biopsien und somit zu einer Reduktion der Überdiagnostik beim PCa.17
Dieser Test wird derzeit an einer grossen schwedischen PCa-Screening-Kohorte untersucht. Kritisch zu betrachten sind die unterschiedlichen Cut-offs, die in den einzelnen Subkohorten genutzt werden.
Leitlinien und Empfehlungen
Insgesamt halten sich die nationalen und internationalen Leitlinien für den Einsatz von Biomarker-Panels in der Diagnostik und Prädiktion des PCa noch zurück.2,21
Lediglich die amerikanische NCCN(National Comprehensive Cancer Network)-Leitlinie gibt eine klare Empfehlung für den Einsatz des Decipher®-Tests zum Entscheid für die adjuvante Strahlentherapie beim PCa.22 Die Leitlinie der amerikanischen Krebsgesellschaft empfiehlt diese vor der aktiven Überwachung, der radikalen Prostatektomie oder der Strahlentherapie, wenn die weitere Therapie beeinflusst werden sollte.23
Insgesamt können Biomarker die Risikostratifizierung beim PCa in der Diagnostik, Prädiktion und Prognose unterstützen. Die Standard-Biomarker sind bislang der PSA-Wert und seine Derivate wie die PSA-Dichte, sie haben allerdings eine limitierte Aussagekraft. Die Kombination aus klinischen Parametern, Biomarkern und Bildgebung wird in Zukunft zur Risikostratifizierung genutzt werden.
Literatur:
1 Bray F et al.: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68(6): 394-424 2 Deutsche Krebsgesellschaft, AWMF: S3-Leitlinie-Prostatakarzinom. Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms, Langversion, Version 6.0, 2021, AWMF Registernummer: 043-022OL. Online unter http://www.leitlinienprogramm-onkologie.de/leitlinien/prostatakarzinom/ . Abgerufen am 08.08.2021 3 Merriel SWD et al.: A modified Delphi study to develop a practical guide for selecting patients with prostate cancer for active surveillance. BMC Urol 2021; 21(1): 18 4 Drost FH et al.: Prostate MRI, with or without MRI-targeted biopsy, and systematic biopsy for detecting prostate cancer. Cochrane Database Syst Rev 2019; 4: CD012663 5 Kasivisvanathan V et al.: MRI-targeted or standard biopsy for prostate-cancer diagnosis. N Engl J Med 2018; 378(19): 1767-77 6 Rouviere O et al.: Use of prostate systematic and targeted biopsy on the basis of multiparametric MRI in biopsy-naive patients (MRI-FIRST): a prospective, multicentre, paired diagnostic study. Lancet Oncol 2019; 20(1): 100-9 7 van der Leest M et al.: High diagnostic performance of short magnetic resonance imaging protocols for prostate cancer detection in biopsy-naive men: the next step in magnetic resonance imaging accessibility. Eur Urol 2019; 76(5): 574-81 8 Becerra MF et al.: Serum and urinary biomarkers for detection and active surveillance of prostate cancer. Curr Opin Urol 2019; 29(6): 593-7 9 Lokeshwar SD et al.: Optimal use of tumor-based molecular assays for localized prostate cancer. Curr Oncol Rep 2022; 24(2): 249-56 10 Uhr A et al.: An overview of biomarkers in the diagnosis and management of prostate cancer. Can J Urol 2020; 27(S3): 24-7 11 Hupe MC et al.: Diagnostic markers in urology. Urologe A 2021; 60(10): 1323-30 12 Hansen J et al.: Initial prostate biopsy: development and internal validation of a biopsy-specific nomogram based on the prostate cancer antigen 3 assay. Eur Urol 2013; 63(2): 201-9 13 Fenstermaker M et al.: Risk stratification by urinary prostate cancer gene 3 testing before magnetic resonance imaging-ultrasound fusion-targeted prostate biopsy among men with no history of biopsy. Urology 2017; 99: 174-9 14 Stephan C et al.: PHI density prospectively improves prostate cancer detection. World J Urol 2021; 39(9): 3273-9 15 Steuber T et al.: PROPOSe: A real-life prospective study of proclarix, a novel blood-based test to support challenging biopsy decision-making in prostate cancer. Eur Urol Oncol 2022; 5(3): 321-7 16 Morote J et al.: Who with suspected prostate cancer can benefit from Proclarix after multiparametric magnetic resonance imaging? Int J Biol Markers 2022; 37(2): 218-23 17 Moller A et al.: The Stockholm3 blood-test predicts clinically-significant cancer on biopsy: independent validation in a multi-center community cohort. Prostate Cancer Prostatic Dis 2019; 22(1): 137-42 18 Cullen J et al.: A biopsy-based 17-gene genomic prostate score predicts recurrence after radical prostatectomy and adverse surgical pathology in a racially diverse population of men with clinically low- and intermediate-risk prostate cancer. Eur Urol 2015; 68(1): 123-31 19 Klein EA et al.: A 17-gene assay to predict prostate cancer aggressiveness in the context of Gleason grade heterogeneity, tumor multifocality, and biopsy undersampling. Eur Urol 2014; 66(3): 550-60 20 Jairath NK et al.: A systematic review of the evidence for the decipher genomic classifier in prostate cancer. Eur Urol 2021; 79(3): 374-83 21 Mottet N et al.: EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer-2020 Update. Part 1: Screening, diagnosis, and local treatment with curative intent. Eur Urol 2021; 79(2): 243-62 22 NCCN Guidelines: NCCN Clinical Practice Guidelines in Oncology Prostate Cancer, 2022 23 Eggener SE et al.: Molecular biomarkers in localized prostate cancer: ASCO Guideline. J Clin Oncol 2020; 38(13): 1474-94r
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...