Behandlung von Nebenwirkungen beim Chemoimmunkonjugat
Autor:
Dr. med. Urs Breitenstein
Leiter Onkologie
Brustzentrum AG, Zürich
E-Mail: u.breitenstein@brust-zentrum.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Unerwünschte Arzneimittelwirkungen beim Chemoimmunkonjugat entstehen durch die gleichen Mechanismen wie die erwünschten Wirkungen. Durch erhöhtes Bewusstsein für ihr Vorkommen und ihre Charakteristika lassen sie sich jedoch prophylaktisch und therapeutisch gut kontrollieren.
Noch vor 25 Jahren wurden Patientinnen mit metastasierten Mammakarzinomen allein mit endokrinen oder zytostatischen Massnahmen therapiert. Schrittweise ergänzten andere Substanzklassen wie monoklonale Antikörper, antitumorale Tyrosinkinase-Inhibitoren (TKI), CDK4/6- sowie PARP-Inhibitoren als auch Immuntherapeutika die Behandlungsoptionen.
Seit Neuestem mischen Chemoimmunkonjugate («antibody-drug conjugate» [ADC]) nicht nur die Therapiealgorithmen des metastasierten Mammakarzinoms auf. Weitere Anwendungsmöglichkeiten beim Magenkarzinom, Kolorektal-, Lungen- und Blasenkarzinom sind in klinischer Umsetzung oder Testung. Grundsätzlich besteht das biologische Konstrukt eines ADC immer aus drei Grundelementen: dem Antikörper, dem Linker und dem Payload. Diese drei Komponenten zusammen mit dem Antigen-Targetmolekül sind Grundlage für die Wirkung und Nebenwirkungen dieser Substanzklasse.
Profil der Nebenwirkungen
Nebenwirkungen entstehen auf dem gleichen Wege wie die Wirkung der ADC. Sie treten als Folge von Antikörper-Charakteristika (humanisiert oder chimär), Linker-Stabilität (spaltbar oder nicht spaltbar), dem zytotoxischen Payload und der biologischen Distribution und dem Expressionsgrad des Target-Antigens in Geweben auf.
Durch Bindung des Medikamentenkonjugates an das Oberflächen-Antigen mit anschliessender Internalisierung des Antigen-/Antikörper-Komplexes und lysosomaler Degradation wird das Medikament (Payload) durch Abspaltung vom Linker intrazytoplasmatisch freigesetzt. Es entfaltet seine Wirkung in Abhängigkeit von seiner biologischen Aktivität (Tubulininhibition, Topoisomerasehemmung oder Alkylierung). Sekundäre Payload-Freisetzung aus der apoptotischen Tumorzelle führt zu einer zytotoxischen Einwirkung auf die Umgebungszellen in Unabhängigkeit von ihrer Antigenexpression. Dieser Bystander-Killing-Effekt erhöht die Wirkungseffizienz des ADC, insbesondere wenn im Rahmen einer Tumorheterogenität eine unterschiedliche und inhomogene Target-Expression vorliegt.
Nebenwirkungen von ADC können dort entstehen, wo im gesunden Gewebe eine erhöhte aberrante Target-Expression vorliegt, einerseits durch die direkte Wirkung und andererseits durch den Bystander-Effekt. Die Linker-Stabilität als Ursache von Nebenwirkungen ist ebenfalls von Bedeutung, wobei die Dekonjugation des Payload im Plasma im Rahmen der intravenösen Applikation eine untergeordnete Rolle spielt, da kaum freies Payload in der Blutstrombahn gemessen werden kann.
Anti-TROP2-ADC: Augenmerk Gastrointestinaltrakt
«Trophoblast cell surface antigen 2» (TROP2) wird auf einer Reihe von soliden Tumoren exprimiert, insbesondere beim tripelnegativen Mammakarzinom (TNBC). Im November 2021 wurde der erste ADC zur Behandlung des fortgeschrittenen TNBC auf Basis der Daten der ASCENT-Studie registriert.1
Sacituzumab-Govitecan
Sacituzumab-Govitecan ist ein humanisierter Anti-TROP2-IgG1-Antikörper, an den über einen hydrolysierbaren Linker vom Maleimid-Typ (CL2A) der hochwirksame Payload und Topoisomerase-I-Inhibitor SN-38, der aktive Metabolit von Irinotecan, im Verhältnis 1:7,8 gekoppelt ist.
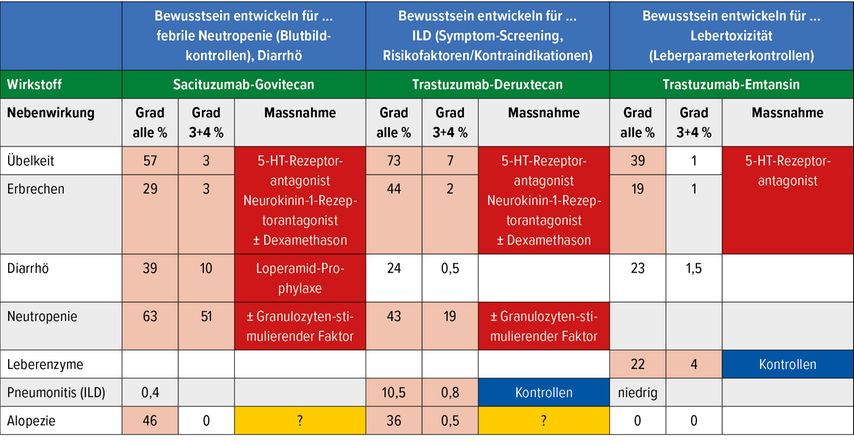
Sacituzumab-Govitecan verursacht klassische Nebenwirkungen, wie sie von einer konventionellen Chemotherapie bekannt sind (Nausea, Erbrechen, Diarrhö, Alopezie und Hämatotoxizitäten). Augenmerk muss auf die gastrointestinalen Haupttoxizitäten gerichtet werden (Nausea 57%, Grad ≥3: 2%; Erbrechen 29%, Grad ≥3: 3%; Diarrhö 59%, Grad ≥3: 10%). Eine antiemetische Prämedikation und eine Loperamid-Prophylaxe sind zu empfehlen.
Die Häufigkeit von febrilen Neutropenien liegt bei 6%. Daher ist eine Prophylaxe mit Granulozyten-stimulierendem Faktor (G-CSF) gerade bei Patientinnen mit starker zytostatischer Vorbehandlung zu diskutieren. Für Patientinnen kann es von Relevanz sein, dass dieser ADC eine sichtbare Alopezie (46%) verursacht, meist vom Grad 1 bis 2. Lungentoxizitäten treten selten auf (1/258 Patientinnen: <0,5%).
Datopotamab-Deruxtecan
Datopotamab-Deruxtecan (Dato-DXd) ist ebenfalls ein äusserst wirksamer Anti-TROP2-ADC (TROPION-PanTumor-01-Studie).2 Der Payload Deruxtecan ist in einem Kopplungsverhältnis 1:4 über einen spaltbaren Tetrapeptid-Linker mit dem Antikörper Datopotamab verbunden. Im Gegensatz zum Anti-HER2-ADC Trastuzumab-Deruxtecan verursacht Datopotamab-Deruxtecan keine Lungentoxizitäten. Deruxtecan scheint also nicht alleine für die erhöhte Lungentoxizität, wie sie bei Anti-HER2-ADC gesehen werden kann, verantwortlich zu sein.
Anti-HER2-ADC: Gefahr Lungentoxizität
Trastuzumab-Emtasin
Der erste Anti-HER2-ADC, welcher 2014 in der Schweiz zur Behandlung des fortgeschrittenen HER-positiven Mammakarzinoms von Swissmedic zugelassen wurde, ist Trastuzumab-Emtasin (T-DM1). Dieser ADC enthält den Anti-HER2-Antikörper Trastuzumab. Über einen Hydrolyse-stabilen Linker (MCC) ist der Payload Maytansinoid (DM1) im Verhältnis 1:4 gebunden und wirkt intrazellulär als Tubulininhibitor. Aktuell ist er sowohl für die metastasierte Situation (EMILIA-Studie, TH3RESA-Studie) als auch als adjuvante Therapie für Patientinnen mit fehlender partieller Remission (non-pCR) nach neoadjuvanter Behandlung zugelassen (KATHRIN-Studie).3–5
Mit diesem Anti-HER2-ADC konnten Onkologen rasch und ohne Probleme umgehen, da er relativ nebenwirkungsarm ist. Die gastrointestinalen Probleme sind meist milde ausgeprägt (Nausea 40%, überwiegend Grad 1–2: 39%). Als charakteristische Nebenwirkungen entpuppten sich die Lebertoxizität und die Thrombopenie, meist ebenfalls von mildem bis leichtem Ausmass.
Über alle klinischen Studien mit T-DM1 hinweg liegt die Inzidenz der Leberfunktionsstörungen bei 11–44% (Grad 3–4: 0,5–9%). Der Anstieg der Leberwerte geht mit der Entwicklung einer langsam progredienten Bystander-Thrombozytopenie einher. Über die Ätiologie und Pathogenese dieser Toxizität ist wenig bekannt. Ohne Dosisreduktionsmassnahmen oder Therapieunterbrüche kann das Bild einer portalen Hypertension mit Aszites, Splenomegalie und weiteren portal-hypertensiven Komplikationen entstehen.
Einzelberichte über diagnostische Leberbiopsien zeigten strukturelle Leberarchitekturveränderungen (nodulär regenerative Hyperplasie) mit Ausweitung der Lebersinusoide.6 Sowohl die Thrombopenie als auch die Leberreaktion ist nach Absetzen von T-DM1 reversibel. Blutbild und Leberwerte sollten unter einer länger dauernden T-DM1-Behandlung monitorisiert werden (Abb. 1).
Trastuzumab-Deruxtecan
Jüngst mischt der neue Anti-HER2-ADC Trastuzumab-Deruxtecan (T-DXd) den Therapiealgorithmus des metastasierten HER2-positiven Mammakarzinoms auf. Die DESTINY-Breast01- und DESTINY-Breast03-Studien7,8 katapultierten diesen ADC in die Zweitlinientherapie des metastasierten HER2-positiven Mammakarzinoms, sodass aktuell grosse Unklarheiten für den zeitlichen Einsatz und die Effizienz von T-DM1 oder Anti-HER2-TKI wie Lapatinib, Neratinib und Tucatinib nach Vorbehandlung mit T-DXd bestehen.
Wiederum ist der Anti-HER2-Antikörper die Basis des ADC. An diesen ist mit einem Verhältnis von 1:8 über einen enzymatisch spaltbaren Tetrapeptid-Linker der Topoisomerase-I-Inhibitor Deruxtecan DXd (Derivat von Exotecan) gebunden. Im Gegensatz zu T-DM1 weist T-DXd einen wesentlich potenteren Bystander-Killing-Effekt auf und verursachte deutlich mehr Nebenwirkungen. Nebst Nausea/Erbrechen (78%/46%) treten deutliche hämatologische Toxizitäten auf (Neutropenie 43%, Grad ≥3: 19%). Wie auch Sacituzumab-Govitecan verursacht T-DXd eine Alopezie in einem Ausmass von 36–48%, fast überwiegend Grad 1–2.
Hauptaufmerksamkeit muss auf die Lungentoxizität gerichtet werden. In der Phase-II-Studie DESTINY-Breast-01 trat diese Komplikation mit der Häufigkeit von 15,8% auf. 2,7% dieser pulmonalen Komplikationen endeten letal. Bereits in den Early-Access-Programmen als auch in der DESTINY-Breast-03-Studie wurde die Letalität durch ärztliche Informations- und Sensibilisierungsmassnahmen deutlich gesenkt.
Trastuzumab-Duocarmazin
Ein weiterer Anti-HER2-ADC wartet ebenfalls mit erhöhter Lungentoxizität auf. Trastuzumab-Duocarmazin (SYD985) zeigte in der TULIP-Phase-III-Studie bei vorbehandelten metastasierten HER2-positiven Patientinnen (≥2 Therapielinien) ein signifikant verlängertes progressionsfreies Überleben (PFS) gegenüber einer Behandlung nach Physician’s Choice. Der ADC bindet in einem Verhältnis von 1:2,4–2,8 über einen spaltbaren Linker das Alkylans Duocarmycin (DUBA). 7,6% aller Studienteilnehmenden in der Interventionsgruppe erlitten Lungentoxizitäten (Pneumonitis und ILD), wovon 2,4% schweren Grads ≥3 waren.
Zusätzlich entsteht eine ungewöhnliche okuläre Nebenwirkung bei insgesamt 78% aller Patientinnen (Konjunktivitis 38%, Keratitis 38%, Sicca 30% [17,6% schweren Grads ≥3]). Diese Nebenwirkungen am Auge führten bei 21% zu einer Unterbrechung der Behandlung.
Anti-HER2-Behandlung und interstitielle Lungenentzündung
Onkologen sind an pulmonale Toxizität als unerwünschte Arzneimittelwirkung gewöhnt. Mehrere Zytostatika können solche Reaktionen auslösen, vor allem Methotrexat, Bleomycin (10%), Pemetrexed (3,6%), Vinorelbin und auch gelegentlich Taxane. Fast alle biologisch wirksamen Inhibitoren können ebenfalls solche Toxizitäten verursachen.
Am häufigsten treten sie unter mTOR-Inhibitoren (11%), PIK3-Inhibitoren (3–25%), Checkpoint-Inhibitoren (1,1–3,6%) und insbesondere auch bei HER2-Inhibitoren auf (TKI bis 2,4%, ADC bis 15,8%). Folgende mögliche Mechanismen spielen bei Anti-HER2-ADC eine Rolle in der Induktion eines Lungenschadens:
-
HER2-abhängiger Uptake des ADC durch aberrante ERBB2-Expression in Lunge und Bronchialepithelien
-
HER2-unabhängiger ADC-Uptake in Alveolarmakrophagen
-
Bystander-Killing-Effekt durch ADC-Release aus Tumorzellen
-
Zirkulierender dekonjugierter Payload
Die interstitielle Lungenentzündung (ILD) unter T-DXd tritt während der ersten zwölf Behandlungsmonate auf. Spätere toxische Lungenreaktionen sind sehr selten.
Wichtig sind die Früherkennung der Toxizität, die differenzialdiagnostische Abgrenzung zum Lungeninfekt, ein sofortiges Absetzen des ADC und eine rasch einsetzende immunsuppressive Therapie gemäss Toxizitätsgraduierung. Therapie der Wahl sind Glukokortikosteroide. Bei Grad 1–2 eignen sich Prednison/Prednisolon in einer Dosierung von 0,5–1mg/kgKG. Bei Grad 3–4 muss eine rasche Einleitung von Steroid-Grammstössen in einer Dosierung von 500–1000mg/d über drei Tage erfolgen, bevor die Dosierung in Abhängigkeit vom Ansprechen schrittweise reduziert werden darf. Ein Rechallenge mit T-DXd nach ILD-Ereignis ist nur bei abgeheilter Grad-1-Toxizität erlaubt (Restartdosierung: 5,4mg/kg bei Erholung <28 Tagen, 4,4mg/kg bei Erholung >28 Tage). Eine ILD Grad 2–4 verbietet eine Medikamenten-Reexposition.
Zusammenfassend kann festgehalten werden, dass ADC zur Behandlung des metastasierten Mammakarzinoms (tripelnegativ, HER2+) äusserst wirksame Medikamente sind, welche in Abhängigkeit von Antikörper-Targets, der Linker-Stabilität und der Toxizität des Payloads Nebenwirkungen, unter anderem Lungentoxizitäten in Form einer ILD, verursachen können. Insbesondere bei Anti-HER2-ADC treten ILD gehäuft auf und können lebensbedrohliche Ausmasse (ARDS) annehmen. Eine Sensibilisierung der Onkologen auf ADC-spezifische Nebenwirkungen ist wichtig. Zusammen mit einem erhöhtenBewusstsein und medikamentös-supportiven Begleitmassnahmen sind ADC gut tolerierbare Medikamente.
Literatur:
1 Bardia A et al.: Sacituzumab Govitecan in metastatic triple-negative breast cancer. N Engl J Med 2021; 384: 1529-41 2 Bardia A et al.: Datopotamab deruxtecan (Dato-DXd), a TROP2-directed antibody-drug conjugate (ADC), for triple-negative breast cancer (TNBC). Ann Oncol 2021; 32(Suppl 2): S60-S78 3 Verma S et al.: Trastuzumab Emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012; 367: 1783-91 4 Krop I et al.: Trastuzumab emtansine versus treatment of physician’s choice in patients with previously treated HER2-positive metastatic breast cancer (TH3RESA): final overall survival results from a randomised open-label phase 3 trial. Lancet Oncol 2017; 18: 743-54 5 Von Minckwitz G et al.: Trastuzumab Emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019; 380: 617-28 6 Force J et al.: Nodular regenerative hyperplasia after treatment with Trastuzumab Emtansine. J Clin Oncol 2016; 34: e9-12 7 Modi S et al.: Trastuzumab Deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382: 610-21 8 Cortés J et al.: Trastuzumab Deruxtecan versus Trastuzumab Emtansine for breast cancer. N Engl J Med 2022; 386: 1143-54 9 Saura Manich C et al.: Primary outcome of the phase III SYD985.002/TULIP trial comparing [vic-] trastuzumab duocarmazine to physician’s choice treatment in patients with pretreated HER2-positive locally advanced or metastatic breast cancer. Annal Oncol 2021; 32(Suppl 5): S1283-46 10 Tarantino P et al.: Interstitial lung disease induced by anti-ERBB2 antibody-drug conjugates. JAMA Oncol 2021; 7: 1873-81
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...