ASH 2020 – Highlights zum multiplen Myelom
Autor:
Dr. med. Rouven Müller
Klinik für Medizinische Onkologie und Hämatologie
Universitätsspital Zürich
E-Mail: rouven.mueller@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die 62. Jahrestagung der Amerikanischen Gesellschaft für Hämatologie (ASH) fand pandemiebedingt erstmals im virtuellen Format statt. Von insgesamt 4800 eingereichten Abstracts befassten sich 688 Abstracts mit dem multiplen Myelom, was die Bedeutung dieser Entität und die Aktivität der klinischen und experimentellen Forschung in diesem Bereich unterstreicht.
Keypoints
-
Auch im Vergleich zur fortgesetzten KRd-Therapie über 12 Zyklen kann die Hochdosistherapie eine Verlängerung des progressionsfreien Überlebens erreichen.
-
Vierfachkombinationen unter Einsatz CD38-gerichteter Therapien erreichen hohe Ansprechraten, die Erhaltungstherapie in Kombination mit CD38-gerichteter Therapie vertieft das Ansprechen weiter.
-
Neue Zielantigene wie FcRH5 und GPRC5D sind vielversprechende Ansatzpunkte für Antikörper- und zukünftige zelluläre Therapien.
-
BCMA-gerichtete CAR-T-Zellen erzielen bisher unerreichte Ansprechraten bei stark vorbehandelten Patienten.
Am diesjährigen ASH-Meeting wurden unter anderem Updates zu bereits fortgeschrittenenen klinischen Studien präsentiert, wie zur italienischen FORTE-Studie, die den Stellenwert der Hochdosis-Chemotherapie im Kontext einer Therapie mit Carfilzomib/Lenalidomid und Dexamethason untersucht. Auch zur französischen IFM2009-Studie, die Langzeitergebnisse hinsichtlich des optimalen Zeitpunktes der autologen Stammzelltransplantation (ASCT) beschreibt, wurde ein Update vorgestellt. Gegenstand weiterer Präsentationen waren ein sehr interessantes Spektrum an CAR-T-Zell-Studien sowie Abstracts zum Einsatz bispezifischer Antikörper gegen BCMA und zu vielversprechenden weiteren myelomselektiven Zielantigenen. Darüber hinaus waren CD38-gerichtete immuntherapeutische Ansätze auch in diesem Jahr wieder Thema.
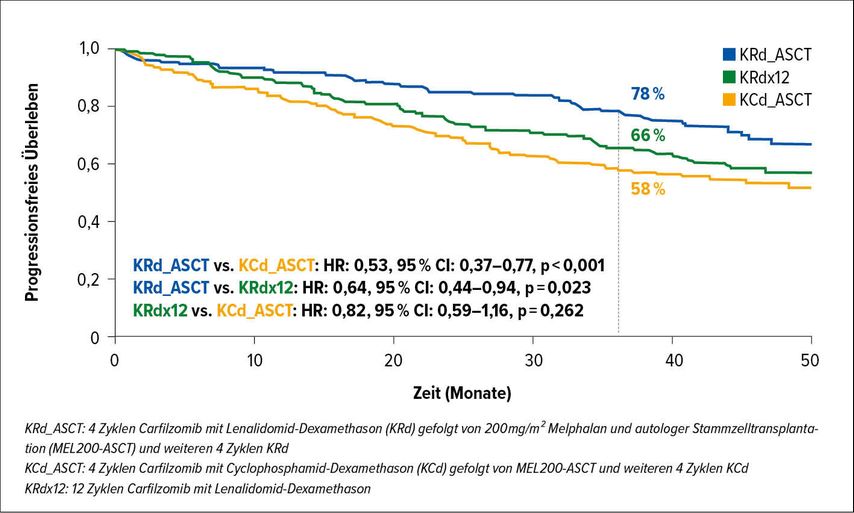
FORTE-Studie: Überlebensdaten
Die italienische FORTE-Studie genoss schon an den vergangenen ASH- und EHA-Kongressen eine hohe Aufmerksamkeit. Sie untersucht den Stellenwert der ASCT flankiert von entweder 4 Zyklen Carfilzomib/Lenalidomid und Dexamethason (KRd) oder 4 Zyklen Carfilzomib/Cyclophosphamid und Dexamethason (KCd) jeweils als Induktion und Konsolidierung (KRdx4-ASCT-KRdx4; KCdx4-ASCT-KCdx4) im Vergleich zu einer über 12 Zyklen kontinuierlich durchgeführten KRd-Therapie (KRdx12). Danach wird in zweiter Randomisierung 1:1 die Erhaltungstherapie mit KR oder R untersucht. Initiale Daten hatten eine vergleichbare Effektivität von KRd-ASCT und KRdx12 gezeigt. Zunächst hatten allenfalls Hochrisikopatienten von einer Hochdosistherapie profitiert und gleichzeitig war für beide Arme eine Überlegenheit gegenüber KCd-ASCT gezeigt worden.1 Daher wurden die nun präsentierten Überlebensdaten mit Spannung erwartet. Hinsichtlich des primären Endpunktes progressionsfreies Überleben (PFS) wurde nach einer medianen Beobachtungszeit von 45 Monaten das mediane PFS im KRd-ASCT-Arm nicht erreicht, im KRdx12-Arm betrug es 57 Monate, im KCd-ASCT-Arm 53 Monate. KRd-ASCT war gegenüber KCD-ASCT und KRdx12 jeweils signifikant überlegen (HR: 0,64, p=0,023; HR: 0,53, p<0,001) (Abb.1).Der Benefit zeigte sich über nahezu alle untersuchten Subgruppen, übersetzte sich jedoch bisher nicht in einen Benefit im Gesamtüberleben. Die Daten der zweiten Randomisierung zeigten nach einer Beobachtungsdauer von im Median 31 Monaten und medianer Behandlungsdauer in beiden Erhaltungstherapiearmen von 27 Monaten eine Konversionsrate minimaler Resterkrankung (MRD) von positiv zu negativ für 46% der Patienten im KR-Arm gegenüber 32% im R-Arm (p=0,04). Das 3-Jahres-PFS nach zweiter Randomisierung betrug 75% mit KR und 66% mit R (HR: 0,63, p=0,026). Auch dieser Benefit liess sich in den meisten Subgruppen beobachten, ein Benefit im Gesamtüberleben kristallisierte sich jedoch bisher noch nicht heraus. Die Nebenwirkungsrate war vergleichbar und akzeptabel, lediglich das Risiko für kardiovaskuläre Nebenwirkungen war im K-haltigen Erhaltungsarm leicht erhöht.2
Abb. 1: Vergleich des progressionsfreien Überlebens unter KRd_ASCT, KRdx12 und KCd_ASCT in der FORTE-Studie (nach Gay et al.)2
Zusammenfassend scheint auch in der FORTE-Studie für KRd analog zur 2017 publizierten IFM2009-Studie3 für Bortezomib, Lenalidomid und Dexamethason (VRd) trotz effizienter Tripelkombinationen die Hochdosistherapie mit Melphalan und ASCT hinsichtlich des progressionsfreien Überlebens vorteilhaft, wenn auch bisher das Gesamtüberleben nicht beeinflussend.
Langzeitanalyse IFM2009-Studie: frühe oder späte ASCT
Die zuvor zitierte IFM2009-Studie war auch in diesem Jahr vertreten mit einem Update zu Langzeitdaten nach Verlängerung der Nachbeobachtungszeit der Originalstudie um 4 Jahre. Die IFM2009-Studie untersucht prospektiv 8 Zyklen VRd vs. VRdx3, ASCT nach Melphalan 200mg/m2, VRdx2 gefolgt von einer Erhaltungstherapie mit Lenalidomid in beiden Armen.Auch nach einer mittleren Nachbeobachtungszeit von 93 Monaten ist hinsichtlich des medianen PFS der Transplantationsarm zu favorisieren, mit einem PFS-Benefit von ca. 12 Monaten. Von den Patienten mit Progression erhielten knapp 77% im VRd-Arm und 23% im Transplantationsarm beim ersten Rückfall eine ASCT. In beiden Armen erhielten ca. 40–50% der Patienten eine Pomalidomid-basierte Zweitlinienbehandlung und ein nur sehr kleiner Anteil von 14 bzw. 12 Patienten erhielt eine Carfilzomib- oder Daratumumab-basierte Therapie.
Die mediane Zeit von der Randomisierung bis zum Progress/Tod unter der ersten Folgetherapie (PFS2) war unter dieser Behandlung in beiden Armen vergleichbar (nicht erreicht in der Transplantationsgruppe vs. 95 Monate im VRd-Arm) und auch in den Subgruppen homogen. Die Zeit vom ersten Progress bis zum Progress/Tod unter der Zweitlinienbehandlung (zweites PFS) konnte in der VRd-Gruppe im Vergleich zur Transplantationsgruppe von 25 auf 36 Monate signifikant gesteigert werden. Die Gesamtüberlebensdaten nach 8 Jahren waren in beiden Armen mit 60,2% und 62,2% vergleichbar, sodass die Ergebnisse dahingehend interpretiert werden können, dass eine verzögerte Transplantation in der Zweitlinienbehandlung möglich ist und hinsichtlich PFS2 und Gesamtüberleben einen vergleichbaren Benefit bietet.4
Update der GRIFFIN-Studie nach 12Monaten Erhaltungstherapie
Die GRIFFIN-Studie untersucht bei Patienten mit neu diagnostiziertem multiplem Myelom (NDMM) den Stellenwert der Kombination aus Daratumumab mit VRd bei Patienten, die für eine Hochdosistherapie und ASCT infrage kommen. Die Primäranalyse dieser Phase-II-Studiekonnte bereits zeigen, dass die Hinzunahme des gegen CD38-gerichteten Antikörpers Daratumumab die Rate an stringent kompletten Remissionen (sCR) zum Ende der Konsolidierungsphase signifikant verbessern kann.5 Das aktuell am Kongress gezeigte Update umfasste das weitere Follow-up und die Analyse nach 12 Monaten Erhaltungstherapie.
Die Studienbehandlung bestand aus 4 Zyklen Induktionstherapie mit VRd +/– Daratumumabgefolgtvon einer Hochdosistherapie mit ASCT und im Anschluss 2 Zyklen Konsolidierung mit VRd +/– Daratumumab. Daraufhin wurde eine Erhaltungstherapie mit R +/– Daratumumab verabreicht.
Zum Ende der Konsolidierungsphase zeigte sich ein Benefit der Kombination R-Daratumumab mit einer ca. 10% höheren sCR-Rate (42,4% vs. 32,0%, p=0,068). Nach 12 Monaten Erhaltungstherapie mit R-Daratumumab vs. R akzentuierte sich der Unterschied mit einer sCR-Rate von 63,6% vs. 47,4% (p=0,0258). Die als sekundärer Endpunkt untersuchte MRD-Negativität auf Level 10–5 wie auch auf Level 10–6 zeigte jeweils einen klaren Benefit für die Kombination mit Daratumumab (62,5% vs. 27,2%, p<0,0001; 26,9% vs. 12,6%, p=0,014). Dies traf ebenfalls auf das geschätzte PFS zum Zeitpunkt 24 Monate mit einer Rate von 94,5% vs. 90,8% zu.6
Bispezifische Antikörper mit neuen Zielantigenen
Neben diesen wichtigen Updates zu fortgeschrittenen klinischen Studien wurden auch einige interessante Abstracts zu frühen Phase-I-Daten gezeigt. Eine erwähnenswerte Substanz ist hier der Fc-Rezeptor-Homolog-5(FcRH5)/CD3-bispezifische Antikörper Cevostamab (BFCR4350A). Das Zielantigen FcRH5 wird von B-Zellen und Plasmazellen exprimiert und findet sich mit nahezu 100%iger Prävalenz in Myelomzellen. Die vorgestellten Phase-I-Daten beschreiben die Dosisfindung und erste Daten zur klinischen Effektivität. Von den im Median mit 6 Vortherapien stark vorbehandelten Patienten konnte bei über der Hälfte ein Ansprechen erreicht werden (objektive Ansprechrate [ORR] 51,7%): Ein stringent vollständiges Ansprechen (sCR) wurde bei 10,3%, ein vollständiges Ansprechen (CR) bei 10,3%, ein sehr gutes partielles Ansprechen (VGPR) bei 13,8% und ein partielles Ansprechen (PR) bei 17,2% erzielt. Im Bezug auf die Nebenwirkungen fand sich ein steuerbares Toxizitätsprofil. Die Gefahr eines höhergradigen «cytokine release syndrome» (CRS) konnte durch eine schrittweise Dosiseskalation auf die Zieldosis in Zyklus 1 vermieden werden.7
Ein weiteres interessantes Antigen ist das «G-protein-coupled receptor family C group 5 member D» (GPRC5D). Ausser in Myelomzellen wird GPRC5D nur noch in Zellen des Haarfollikels exprimiert. Es ist Ziel der Substanz Talquetamab, eines bispezifischen Antikörpers.Die vorgestellten Phase-I-Daten konnten in einem ähnlich stark vorbehandelten Patientenkollektiv je nach Applikationsform (subkutan/intravenös) Gesamtansprechraten zwischen 67% und 78% induzieren. Das Ansprechen trat schnell, im Median nach einem Monat, auf. Seitens der Nebenwirkungen zeigten sich die substanzklassenspezifischen Nebenwirkungen mit CRS. Die maximal tolerable Dosis wird noch evaluiert.8
Zelluläre Therapien
Auch im Bereich der zellulären Therapien, hier mit dem Zielantigen «B-cell maturation antigen» (BCMA),zeigen sich erfreuliche Fortschritte. Exemplarisch sei ein Update der CARTITUDE-Studie erwähnt. Hier wurden Daten der Phase I und erste Phase-II-Daten gezeigt. Ciltacabtagene autoleucel (Cilta-cel) ist ein chimäres CAR-T-Konstrukt mit 2 BCMA-bindenden Domänen, die die Avidität steigern. Nach üblicher lymphodepletierender Konditionierung mit Fludarabin und Cyclophosphamid wurde nach 5–7 Tagen 0,75x106 CAR+ T-Zellen/kg Körpergewicht infundiert. Das untersuchte Patientenkollektiv hatte im Median 6 Vortherapien erhalten, 87,6% waren tripelrefraktär (immunmodulierende Substanzen, Proteasominhibitoren, anti-CD38-basierte Therapien), 41,2% waren pentarefraktär (Bortezomib, Lenalidomid, Carfilzomib, Pomalidomid, Anti-CD38-basierte Therapien) und 97,9% waren auf die zuletzt applizierte Therapie refraktär. In dieser sehr stark vorbehandelten Patientengruppe konnte bei knapp 95% ein Ansprechen erreicht werden. Die sCR-Rate erreichte beeindruckende 55,7%. Das PFS nach 6 Monaten lag bei 87,4% und das Gesamtüberleben bei 93,8%. Bei einer medianen Nachbeobachtungszeit von 8,8 Monaten wurde die mediane Ansprechdauer noch nicht erreicht. Die CRS-Rate war mit 94,8% hoch, Grad-3- bzw. Grad-4-CRS trat bei 4,1% auf. Es konnten hier in einem Kollektiv von stark vorbehandelten Patienten sehr überzeugende Ansprechraten erreicht werden, die weitere Nachbeobachtung wird über die Dauer des Ansprechens informieren.9
Literatur:
1 Gay F et al.: Carfilzomib lenalidomide dexamethasone (KRd) with or without transplantation in newly diagnosed myeloma (FORTE trial): efficacy according to risk status. EHA-Kongress 2019, Abstr.#S872 2 Gay F et al.: Survival analysis of newly diagnosed transplant-eligible multiple myeloma patients in the randomized FORTE trial. ASH-Meeting 2020; Abstr.#141 3 Attal M et al.: Lenalidomide, bortezomib, and dexamethasone with transplantation for myeloma. N Engl J Med 2017; 376(14): 1311-20 4 Perrot A et al.: Early versus late autologous stem cell transplant in newly diagnosed multiple myeloma: long-term follow-up analysis of the IFM 2009 Trial. ASH-Meeting 2020; Abstr.#143 5 Voorhees P et al.: Daratumumab, lenalidomide, bortezomib, and dexamethasone for transplant-eligible newly diagnosed multiple myeloma: the GRIFFIN trial. Blood 2020; 136(8): 936-45 6 Kaufman JL et al.: Daratumumab (DARA) plus lenalidomide, bortezomib, and dexamethasone (RVD) in patients with transplant-eligible newly diagnosed multiple myeloma (NDMM): updated analysis of GRIFFIN after 12 months of maintenance therapy. ASH-Meeting 2020; Abstr.#549 7 Cohen AD et al.: Initial clinical activity and safety ofBFCR4350A, a FCRH5/CD3 T-cell-engaging bispecific antibody, in relapsed/refractory multiple myeloma. ASH-Meeting 2020; Abstr.#292 8 Chari A et al.: A phase 1, first-in-human study of talquetamab, a g protein-coupled receptor family C group 5 member D (GPRC5D) x CD3 bispecific antibody, in patients with relapsed and/or refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr.#290 9 Madduri D et al.: CARTITUDE-1: phase 1b/2 study of ciltacabtagene autoleucel, a B-cell maturation antigen–directed chimeric antigen receptor T cell therapy, in relapsed/refractory multiple myeloma. ASH-Meeting 2020; Abstr.#177
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...