AML: stoffwechselspezifische Therapie heute – Immuntherapie morgen?
Autor:
PD Dr. med. Boris Eugen Schleiffenbaum
Hämatologie
Klinik im Park, Zürich
AndreasKlinik Cham, Hirslanden
Eine präklinische Studie zur CAR-T-Zell-Therapie verspricht, die Behandlung der akuten myeloischen Leukämie zu revolutionieren.
Keypoints
-
Neue CART-Zell-Therapien der zweiten Generation, die nach dem «target-antigen profiling» entwickelt und konstruiert sind, könnten in Zukunft die Therapie auch der myeloischen Erkrankungen revolutionieren.
-
Der Menin-Inhibitor Ziftomenib ist in der Therapie der NPM-1mut-AML wirksam.
-
Der Typ-II-FLT3-Inhibitor Quizartinib könnte «standard of care» in der Induktion der FLT3-ITD-AML werden.
-
Der Typ-I-FLT-3-Inhibitor Gilteritinib könnte «standard of care» in der Erhaltungstherapie post Transplantation bei MRD+ FLT3mut-AML werden.
-
Statine in der Prävention der AML?
Immuntherapien auch bei den myeloischen Erkrankungen?
Prof. Dr. med. Marion Subklewe hatte schon in einer ausserordentlich beeindruckenden Fortbildungsvorlesung auf die Schwierigkeiten in der Immuntherapie der akuten myeloischen Leukämie (AML) verwiesen, da die bisherigen Ansätze vor allem linienspezifisch sind und nur in ersten Ansätzen leukämieassoziiert und schon gar nicht leukämiespezifisch mit entsprechender «On-target»-Toxizität.
Da im Gegensatz zu der Situation mit B-Zellen eine linienspezifische Substitution myeloischer Zellen nicht möglich ist, ergibt sich daraus das Problem der schweren Neutropenie vor allem in der CAR-T-Zell-Therapie, in der das immunologische Agens im Körper der Patienten persistiert. Das Überangebot an Antigen führt zudem zu schweren weiteren Nebenwirkungen, wie einem verstärkten Zytokinfreisetzungssyndrom (CRS) oder verstärktem immuneffektorzellassoziiertem Neurotoxizitätssyndrom (ICANS), und ist darüber hinaus auch von immunologischer Bedeutung: Es ergibt sich daraus ein «antigen sink» mit der Folge einer T-Zell-Erschöpfung (die zu alledem in der AML meist schon vorbestehend ist).
Das kooperative Design von CAR-T-Zellen der zweiten Generation, das zwei Antigene – den eigentlichen Antigenrezeptor mit einem zweiten chimären kostimulierenden Rezeptor (CCR) – in derselben CAR-T-Zelle vereint, ist in dieser Situation ein neuer Ansatz, der zu einer zugleich selektiven wie auch effizienten Tötung der AML-Zellen führt, zumindest in einem humanisierten Maus-Modell.
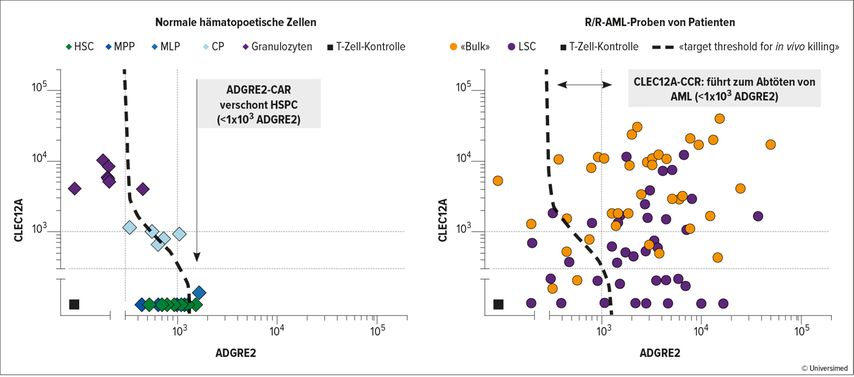
Voraussetzung dafür ist ein sehr sorgfältiges «target-antigen profiling», das sowohl die Verteilung und die Dichte der beiden Antigene auf den myeloischen Vorläuferzellen und Effektorzellen als auch auf den Tumorzellen verschiedenster AML-Patienten berücksichtigt, wie von Sascha Haubner in seinem wohl bahnbrechenden Vortrag während der «Plenary Session» gezeigt.1
Die Idee hinter diesem Konzept ist, dass die Kombination des primären Antigenrezeptors mit dem kostimulierenden Rezeptor es der CAR-T-Zelle erlaubt, nicht nur Tumorzellen zu töten, die das Antigen A in hoher Dichte exprimieren, sondern auch Tumorzellen mit einer niedrigen Expression des Antigens A und gleichzeitiger Expression des Antigens B, gegen das der kostimulierende Rezeptor gerichtet ist.
Aufgrund von quantitativen Koexpressionsstudien zu den beiden Ziel-Antigenen ADGRE2 und CLEC12 an Zellen von R/R-AML-Patienten im Vergleich mit der Expression beider Antigene auf den myeloischen Zellen normaler Spender konnten optimale Schwellenwerte ermittelt werden, die es den ADGRE2-CAR-T-Zellen erlauben sollten, nur Zellen mit einer ADGRE2-Expression >103 zu töten, während die CLEC12-CAR-T-Zellen solche mit einer ADGRE2-Expression <103 töten sollten, sofern sie CLEC12 koexprimierten (Abb. 1).
Abb. 1: Die Quantifizierung der Antigendichte zur Bestimmung eines therapeutischen Fensters. Modifiziert nach Haubner S et al.1
Das führte zur Konstruktion der ADCLEC.syn1-CART-Zelle, die den ADGRE2-1XX (CD28-CDζ1)-Rezeptor mit dem CLEC12-CCR(4-1BB)-Rezeptor koexprimiert. Diese CAR-T-Zelle lysierte in vitro Zellen, die ADGRE allein oder ADGRE2 und CLEC12 exprimierten, nicht aber Zellen, die nur CLEC12 exprimierten.
Im Xenograft-Tumor-Maus-Modell eliminierte ADCLEC.syn1 AML-Zelllinien, die ADGRE2 und CLEC12 in verschiedener Dichte exprimierten. Ähnlich rettete ADCLEC12.syn1 in einem «Patient derived xenograft»(PDX)-Modell die AML-infizierten Mäuse nicht nur, sondern eliminierte auch die Leukämiestammzellen (LSC) ohne Toxizität für die normalen humanen myeloischen Zellen (humanisierte NSG [NOD scid gamma]). ADCLEC12.syn.1 zeigte diese Effektivität in diesen AML-Maus-Modellen trotz der im Vergleich zu dem Effekt der CD19-CAR-T-Zellen in der Therapie der B-Zell-Non-Hodgkin-Lymphome (NHL) weitaus geringeren Antigendichte (5000 Moleküle/Zelle vs. >10000 Moleküle/Zelle).
Auf die Ergebnisse der ersten Phase-I-Studie am Menschen, die aus dem Erfolg der gerade präsentierten, präklinischen Arbeit resultiert und die schon rekrutiert, darf man sehr gespannt sein.
Menin-Inhibition
Ziftomenib inhibiert die Interaktion von Menin und KMT2A, indem es im Menin kompetitiv an der Tasche bindet, an der auch KMT2A bindet. Dadurch kommt es zu einer Auflösung des Transkriptionskomplexes aus Menin und KMT2A bzw. Menin, NPM1mut und KMT2A. Diese Auflösung des Transkriptionskomplexes wiederum reguliert die Transkription von MEIS1 und HOXA9 herunter und ermöglicht über die damit verbundenen epigenetischen Veränderungen eine Wiederaufnahme der Zelldifferenzierung und schlussendlich auch der Apoptose.2,3
In einer Phase-I/II-Studie an Patienten mit R/R-AML und NPM1mut (n=20) führte die Monotherapie mit Ziftomenib (600mg/d p.o.) zu einer aussergewöhnlich guten ORR von 45% und einer CR von 35% mit einer MRD-Negativität von 67% (4/6), u.a. auch bei Komutationen von FLT3 (CR 2/6) und IDH1/2 (CR 4/8), und einerviel versprechendenDauer des Ansprechens (median 8,2 Monate, medianes Follow-up 8,8 Monate). Auch Patienten mit einer Menin-Mutation (u.a. I349M und G331R) zeigten sehr häufig ein Ansprechen (mit Ausnahme der Menin-M327I-Mutation).4
Die Nebenwirkungen waren insgesamt überschaubar (Nausea, Diarrhö; Myelosuppression; wirkmechanismusspezifisch: Differenzierungssyndrom, jedoch keine Verlängerung der QTc).
Entsprechend wurde jetzt die KOMET-007-Studie für ND-AML aufgelegt, in der Ziftomenib in der Induktion zusätzlich zu einer ICT/non-ICT zum Einsatz kommen wird.5
FLT3-Inhibition in der Induktion, FLT3mut-spezifisch, oder was?
Typ-I- und Typ-II-FLT-Kinase-Inhibitoren zeigen grossen Nutzen in der Therapie von Patienten mit AML und FLT3-Mutation. Überraschenderweise zeigten auch Patienten mit FLT3-Wildtyp ein verbessertes Ansprechen unter einer Therapie mit den Typ-II-Inhibitoren Sorafenib und Quizartinib (Q), und R/R-AML-Patienten ohne FLT3-Mutation sprachen auf eine Q-Monotherapie an.
Das führte zum Design einer randomisierten, placebokontrollierten (PBO), doppelblinden Phase-II-Studie, die «3+7» (Cytarabin [AraC] 200mg/m2, Tag 1–7) + Idarubicin (Ida; 12mg/m2, Tag 1–3) + PBO vs. «3+7» + Quizartinib (Q; 60mg/m2, Tag 14?) in der Induktion (1/2 Zyklen) und Hochdosis-AraC ± Q über drei Zyklen bzw. Allo-TPL (allogene Stammzelltransplantation; Hochrisiko/intermediäres Risiko und MRD-Positivität) in der Konsolidation miteinander verglich.
273 Patienten (Einschlusskriterien 18–70 Jahre, medianes Alter 57 Jahre, 48–64 Jahre) wurden erfolgreich 2:1 randomisiert (Q: 180 Patienten/PBO: 93 Patienten; Patienten-Charakteristika balanciert). In beiden Armen der Studie erreichten etwa gleich viele Patienten eine CR/CRi (Q: 76,7%/PBO: 76,4%) und MRD-Negativität (Q: 41,5%/PBO: 41,6%). Bei einer medianen Beobachtungszeit von 17 Monaten fanden sich aber schon deutliche Unterschiede im EFS (Q: 16,6 Monate/PBO: 10,6 Monate; HR: 0,729; p=0,062) und im krankheitsfreien Überleben (DFS; Q: NR [nicht erreicht]/PBO: 15,4 Monate; HR: 0,643; p=0,050) mit einer dann doch sehr ausgeprägten Auswirkung auf das Überleben der Patienten (Zwei-Jahres-OS: Q: 63,5%/PBO: 47%; HR: ?; und medianes OS: Q: NR/PBO: 15 Monate; HR: 0,558; p=0,004). Unter der Therapie mit Q traten keine neuen, wesentlichen Nebenwirkungen auf.6
Schon bei der ersten Präsentation der Resultate der britischen Quizartinib-Studie am ASH-Jahrestreffen 2014 war neben den ausgeprägten Verbesserungen der Behandlung durch Quizartinib für die FLT3-ITD-Patienten ein Nutzen auch für die Patienten ohne Mutation beobachtet worden und letztendlich unerklärt geblieben.
Die vorliegende randomisierte Phase-II-Studie bestätigt nun diese Beobachtungen, wobei es unter Quizartinib offensichtlich nicht zu einer Verbesserung des Ansprechens auf die Therapie kommt. Das Überleben der Patienten aber wird unter Quizartinib sehr ausgeprägt verlängert. Soweit man es dem Abstract entnehmen kann, hat Quizartinib dabei keinen negativen, wohl aber auch keinen positiven Einfluss auf die Nebenwirkungen der Therapie.
Somit stellt sich die Frage, welche Wirkung Quizartinib auf die AML der ansprechenden Patienten hat, insbesondere unter dem Aspekt, dass Quizartinib einen nach heutigem Wissen ganz wesentlichen Parameter für die Tiefe und damit wohl auch die Qualität einer AML-Therapie, die MRD-Negativität, nicht zu beeinflussen scheint. Diese Frage wird noch lauter gestellt werden müssen, wenn sich die bisherigen Ergebnisse nach einer längeren Beobachtungszeit bestätigen sollten. Die Autoren der Studie erhoffen sich dabei Antwort aus den biochemischen und molekularbiologischen Untersuchungen etwaiger Biomarker.
Zu einem ganz anderen Ergebnis kam eine randomisierte Studie mit älteren Patienten mit de novo AML (DN-AML), inkl. auch Hochrisiko-Patienten mit MDS (>60 Jahre; 2014–2019 unabhängig vom FLT3-Status, 2019–2022 nur mit FLT3-Mutation), in der die Randomisierung vs. Placebo (1:1) erst nach dem ersten Zyklus der ICT (Daunorubicin 60mg/m2, Tag 1,3,5/AraC 100mg/m2, Tag 1–10+1 oder 2x Gemtuzumab) erfolgte und Quizartinib erst nach dem zweiten Zyklus (Daunorubicin/AraC vs. Daunorubicin/AraC/Cladribin vs. FLAG-Ida [Idarubicin, Fludarabin, hoch dosiertes Cytarabin und G-CSF]) zu 40mg/d über 14 Tage und nach dem dritten Zyklus (Daunorubicin/AraC, miniFLAG oder IDAC) zu 40mg wiederum über 14 Tage gegeben wurde; nach der hämatologischen Erholung folgte dann nochmals die Gabe von Quizartinib über 28 Tage.
In der Quizartinib-Gruppe wurden die Patienten nochmals 1:1 randomisiert (Erhaltungstherapie über 12x28 Tage vs. keine Erhaltungstherapie). Mit Quizartinib behandelte Patienten (FLT3wt/FLT3mut) zeigten keinen Unterschied im OS und RFS gegenüber Placebo, wobei für die Patienten mit FLT3mut zumindest ein Trend im OS festgestellt werden konnte. Auch die Quizartinib-Erhaltungstherapie brachte keinen therapeutischen Vorteil.7
Erklären lassen sich diese Ergebnisse, die im krassen Gegensatz zu der oben erwähnten Studie und der QuANTUM-First-Studie stehen, einerseits durch das andersartige, etwas kompliziert anmutende Studiendesign (im Alter waren die Studienpopulationen auch verschieden, wenn auch die spanische Studie Patienten bis zum Alter von 70 Jahren mit einschloss), andererseits wohl aber auch durch die fehlende statistische Power der Studie.8
Eine Phase-I/II-Studie aus Spanien untersuchte die Möglichkeit einer Tripeltherapie in der Behandlung älterer Patienten (>70 Jahre oder >65 Jahre, «unfit») mit ND-AML inklusive sekundärer AML (Phase II: n=61; 39%, HMA[«hypomethylating agents»]-exponiert 26%).9 In der Phase II erfolgte die Randomisierung zu einer Therapie mit Venetoclax (Ven; 400mg/d p.o. nach «ramp-up», Tage 1–28; jedoch nur Tage 1–14, wenn an Tag 14 Knochenmark-Blasten-frei; Tage 1–7 in CR), Azacitidin (Aza; 75mg/m2 s.c., Tage 1–7) und Quizartinib (60mg/d p.o., Tage 1–28) vs. Venetoclax (600mg/d nach «ramp-up», Tage 1–28; jedoch nur Tage 1–14, wenn an Tag 14 Knochenmark-Blasten-frei; Tage 1–7 in CR), AraC (20mg/d p.o., Tage 1–10) und Quizartinib (40mg/d p.o., Tage 1–28; R2PD [«recommended phase II dose»] aus der Phase I). CR/CRh/CRi (55 vs. 50%, n.s.), CR MRD-Negativität (32% vs. 16%, n.s.), EFS (8,03 vs. 6,50 Monate; p=0,87) und OS (14,47 vs. 9,27 Monate; p=0,4) waren im Trend, ohne statistische Signifikanz, etwas besser für die mit Aza behandelte Patientengruppe. FLT3-ITD-Patienten profitierten wesentlich (EFS: NR vs. 11,2 Monate; p=0,009; OS: NR vs. 9,03 Monate; p=0,04).
Patienten mit einer sekundären AML und HMA-exponierte Patienten hatten einen schlechteren Verlauf. Die schwersten Nebenwirkungen waren eine febrile Neutropenie, Pneumonie und Sepsis. Kardiale Nebenwirkungen wie eine QTc-Verlängerung traten nicht auf.
FLT3-Inhibition als Erhaltungstherapie nach Stammzelltransplantation
Sorafenib darf seit der Präsentation der entsprechenden Daten am ASH-Jahreskongress 2018 bzw. seit der Publikation der Daten als «standard of care» bei Patienten mit FLT3mut nach allogener Stammzelltransplantation betrachtet werden.10 Diese Studie wird jedoch von verschiedenen Seiten wegen ihrer Grösse und wegen des Studiendesigns hinterfragt, insbesondere weil ein Teil der Patienten FLT3-Inhibitoren als Salvage-Therapie vor der Transplantation erhalten hatte und schliesslich weil die Sorafenib-Behandlung «off-label» erfolgt und oft schlecht toleriert wird.
Eine randomisierte, placebokontrollierte Phase-II-Studie untersuchte nun die Wirkung eines Typ-I-Inhibitors der zweiten Generation, Gilteritinib (120mg/d p.o.), in der Erhaltungstherapie nach Stammzelltransplantation, die innerhalb von zwölf Monaten nach der Induktion/Konsolidation geplant sein musste. Von entscheidender Bedeutung sollte dabei der MRD-Negativitäts-Status werden, der hier mittels PCR/NGS in einer Sensitivität >10–6 bestimmt wurde. Die Gilteritinib-Erhaltungstherapie verbesserte die Prognose nur bei Patienten mit MRD-Positivität (OS: HR: 0,514; p=0,002; MRD-Negativität: HR: 1,213; p=0,575).
Die wichtigsten Nebenwirkungen der Gilteritinib-Therapie waren Neutropenie (abhängig von der gleichzeitigen Einnahme von Azole-Medikamenten mit resultierender Erhöhung der Gilteritinib-Spiegel) und eine versrärkte cGVHD (chronische Spender-gegen-Empfänger-Reaktion).11
Bezüglich der Bedeutung des MRD-Negativitäts-Status für die Wirksamkeit einer FLT3-Inhibitor-Therapie nach Stammzelltransplantation, in diesem Falle Quizartinib, kam auch die QuANTUM-First-Studie infrage, wobei die Ergebnisse dieser Post-hoc-Analyse weniger aussagekräftig sind, da die Therapie mit oder ohne Quizartinib nach der Transplantation ohne Randomisierung erfolgte.12
Kann man eine AML voraussagen und dann auch verhindern?
Prof. George S. Vassiliou berichtete in der «Presidential Session» über faszinierende Studien zur klonalen Hämatopoese (CH).13 Als Ergebnis dieser Studien konnte seine Gruppe ein Modell entwerfen, mit dem aufgrund der Art der CH (DNMT3A, JAK2, MPL, CALR, SRSF2, SF3B1, IDH2, TP53, TET2, U2AF1 und der VAF) sowie in Abhängigkeit von Geschlecht und Alter und sieben weiteren Parametern die Wahrscheinlichkeit für Patienten mit CH vorausgesagt werden kann, in den kommenden Jahren eine AML, ein MDS oder eine MPN zu entwickeln.14 Aus Daten von vor allem Erythrozyten im Blutausstrich (mittels «machine learning») und differenziellen Daten des quantitativen Blutbildes soll in Zukunft die Wahrscheinlichkeit einer CH vorausgesagt werden können.
Hat man damit einen Verdacht auf eine CH, kann man bei solchen Patienten ein NGS durchführen lassen. Ist die CH bestätigt, folgt dann die zuvor erwähnte Prädiktionsanalyse in Bezug auf eine AML, ein MDS oder eine MPN.
Dies ist von besonderer Bedeutung, da George S. Vassiliou Daten präsentierte, die hoffen lassen, dass man die CH u.U. mithilfe einer Statintherapie kontrollieren und damit auch die spätere Entwicklung einer myeloischen Erkrankung verhindern könnte.
Literatur:
1 Haubner S et al.: Differential target profiles and efficacy of ADLEC.syn1 and CD33-CARS in humanized AML models. EHA 2023; Abstr. #S104 2 Wang ES et al.: Preliminary data on a phase 1/2a first in human study of the menin-KMT2a (mll) inhibitor KO-539 in patients with relapsed or refractory acute myeloid leukemia. ASH 2020; Abstr. #115 3 Erba HP et al.: Update on a phase 1/2 first-in-human study of the menin-KMT2A (MLL) inhibitor ziftomenib (KO-539) in patients with relapsed or refractory acute myeloid leukemia. ASH 2022; Abstr. #64 4 Perner F et al.: MEN1 mutations mediate clinical resistance to menin inhibition. Nature 2023; 615(7954): 913-9 5 Fathi AT et al.: Activity, tolerability, and resistance profile of the menin inhibitor ziftomenib in adults with relapsed/refractory NPM1-mutated AML. EHA 2023; Abstr. #LB2713 6 Montesinos P et al.: Preliminary results of QUIWI: a double blinded, randomized clinical trial comparing standard chemotherapy plus quizartinib versus placebo in adult patients with newly diagnosed FLT3-ITD wild-type AML. EHA 2023; Abstr. #S130 7 Knapper S et al.: A randomised assessment of the sequential addition of the kinase inhibitor quizartinib to intensive chemotherapy in older acute myeloid leukaemia (AML) patients: results from theNCRI AML18 trial. EHA 2023; Abstr. #131 8 Erba HP et al.: Quizartinib plus chemotherapy in newly diagnosed patients with FLT3-internal-tandem-duplication-positive acute myeloid leukaemia (QuANTUM-First): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2023; 401(10388): 1571-83 9 Bergua Burgues JM et al.: Updated results of VEN-A-QUI study: a phase 1-2 trial to assess the safety and efficacy of triplets for newly diagnosed unfit AML patients: azacitidine or low-dose cytarabine with venetoclax and quirzatinib. EHA 2023; Abstr. #S132 10 Burchert A et al.: Sorafenib maintenance after allogeneic hematopoietic stem cell transplantation for acute myeloid leukemia with FLT3-internal tandem duplication mutation (SORMAIN). J Clin Oncol 2020; 38: 2993-3002 11 Levis M et al.: BMT-CTN 1506 (MORPHO): a randomized trial of the FLT3 inhibitor gilteritinib as post-transplant maintenance for FLT3-ITD AML. EHA 2023; Abstr. #LB2711 12 Schlenk R et al.: Impact of allogeneic hematopoietic cell transplantation in first complete remission plus FLT3 inhibition with quizartinib in acute myeloid leukemia with FLT3-ITD: results from QuANTUM-First. EHA 2023; Abstr. #S137 13Vassiliou GS: Clonal hematopoiesis – Causes and consequences. Presidential Session EHA 202314 Muxin Gu M et al.: Multiparameter prediction of myeloid neoplasia risk. EHA 2023; Abstr. #S121: «Web-Application»: https://muxingu.shinyapps.io/webapp/
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...