
AML – Hot Topics am EHA-Kongress
3. Medizinische Abteilung Hämatologisch-Onkologisches Zentrum
Hanusch-Krankenhaus, Wien
E-Mail: elisabeth.koller@wgkk.at
Mehr als 8000 Besucher fanden sich dieses Jahr zum Meeting der europäischen Hämatologen im an manchen Tagen über 40 Grad heißen Madrid ein. Der folgende Artikel konzentriert sich auf Präsentationen zum Thema „Therapie der akuten myeloischen Leukämie (AML)“ mit dem Fokus auf aktueller klinischer Relevanz.
Nach langer Durststrecke stehen nun einige Substanzen knapp vor der Zulassung für die Behandlung der AML. Ausführlich wurde auf dem Kongress der EHA auch die Thematik der minimalen Resterkrankung und ihrer Bedeutung für den Verlauf der AML-Therapie diskutiert.
Therapie mit Tyrosinkinaseinhibitoren
Midostaurin, ein Multikinaseinhibitor, der neben FLT3 auch andere Gene inhibiert, wurde aufgrund der positiven Daten der RATIFY-Studie bereits im April 2017 von der FDA für die Therapie der FLT3-positiven AML zugelassen.1 Neben Midostaurin befinden sich derzeit auch einige selektivere FLT3-Inhibitoren der 2. Generation in klinischer Erprobung.
R. Hills präsentierte einen Vergleich der Transplantationsrate bei 58 Patienten aus der AC220-002-Studie, die nach einer Second-Line-Therapie rezidiviert oder refraktär waren, mit Patienten aus einer historischen Kontrollgruppe aus der NCRI-Datenbank mit vergleichbaren klinischen Voraussetzungen.2 Quizartinib als Salvagetherapie war in allen klinischen Parametern überlegen. Die Remissionsrate lag bei 40 vs. 3 % , das mediane Gesamtüberleben (OS) bei 140 Tagen versus 54. Die Transplantationsrate konnte in der AC220-002-Studie von 8 auf 40 % (23/58) verbessert werden. Somit konnte Quizartinib zu einer wesentlichen Verbesserung der Ergebnisse beitragen und Patienten in dieser schwierigen Situation zumindest eine Chance auf eine allogene Transplantation und somit ein Überleben ermöglichen.3
Ebenfalls als Salvagetherapie wurde im Rahmen der CHRYSALIS-Studie, einer Phase-I/II-Studie mit Gilteritinib bei R/R FLT3-positiver AML, die minimale Resterkrankung nach Therapie mittels NGS untersucht. Gilteritinib ist ein selektiver FLT3/ASXL1-Inhibitor, die MTD-Dosis lag bei 300mg pro Tag, 80 Patienten konnten in die Studie eingeschlossen werden. 55 % der Patienten erreichten eine CR, CRi oder CRp, 20/80 (25 % ) erreichten eine molekulare Remission innerhalb der Nachweisgrenze des Leukämie-assoziierten Immunphänotyps (LAIP) von mindestens <10–2. Bei Patienten, bei denen eine molekulare Remission eintrat, lag das mediane Überleben bei 417 Tagen, bei Patienten ohne Ansprechen bei 199 Tagen. Gilteritinib wird derzeit sowohl in der Erhaltungstherapie als auch als in der Salvagetherapie in randomisierter Weise untersucht, die Erwartungen in die neuen FLT3-Inhibitoren sind hoch.
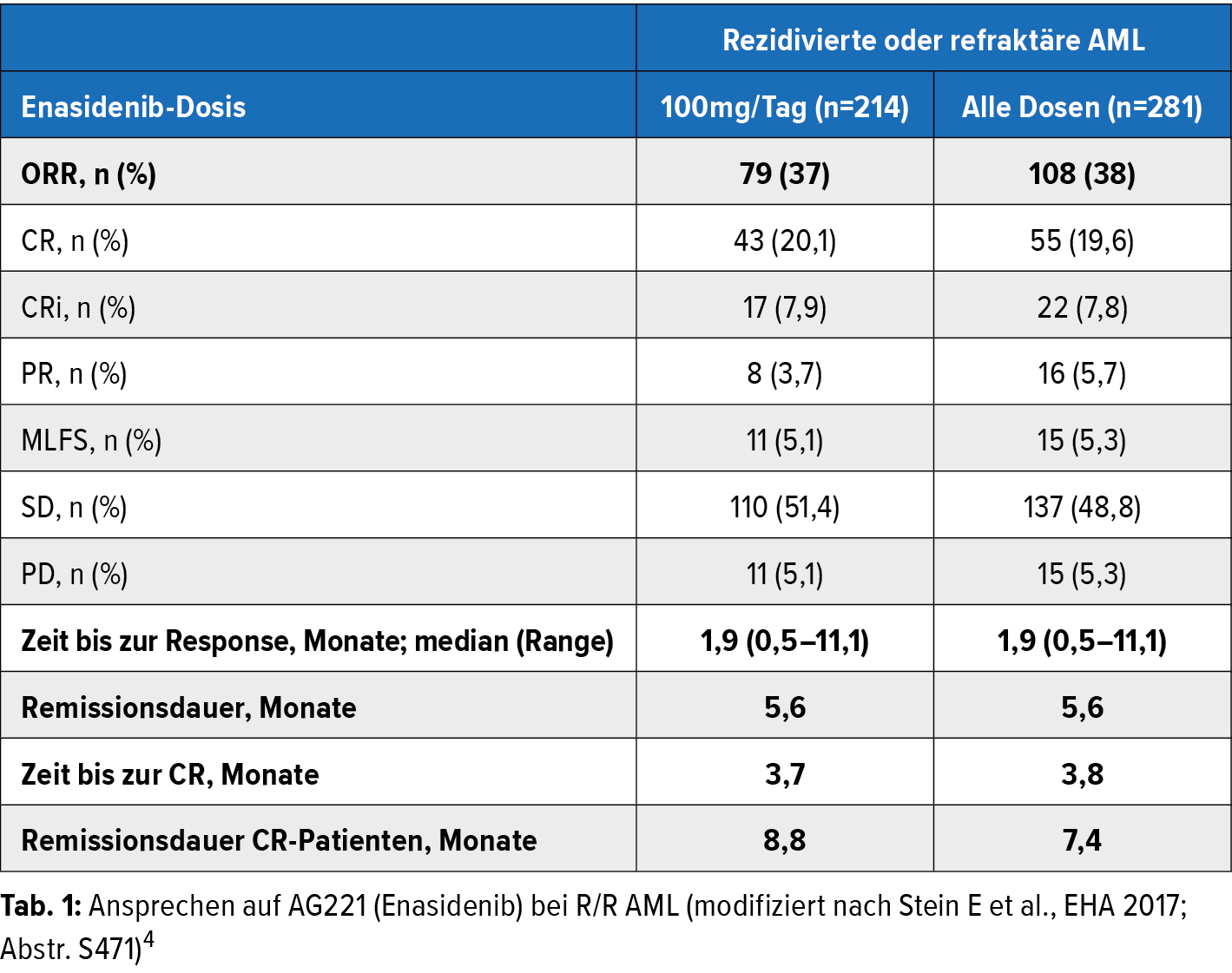
Weitere Targets in der AML-Therapie stellen die IDH-Mutationen dar (IDH1, IDH2), welche bei ca. 10–15 % aller AML-Patienten vorliegen. E. Stein präsentierte ein Update der Phase-I-Studie zur Dosiseskalation und Erweiterungsstudie mit Enasidenib (AG-221) bei AML oder MDS (RAEB) mit IDH2-Mutation.4 239 Patienten, entweder im Rezidiv, refraktär oder ungeeignet für eine intensive Chemotherapie, wurden in einer Dosis mit bis zu 650mg als Einzelsubstanz behandelt, ohne dass die maximal tolerierbare Dosis erreicht wurde. In der Expansionsstudie wurde Enasidenib in einer Dosis von 100mg/Tag gegeben. Die Ergebnisse der Monotherapie waren vielversprechend, die Patienten zeigten ein rasches Ansprechen und bei CR-Patienten hielt die Remission ca. 9 Monate im Median an (Tab. 1). Derzeit wird in einer randomisierten Phase-III-Studie AG-221 mit konventioneller Therapie verglichen (NCT02577406). Außerdem wird AG-221 in einer Phase-I7II-Studie in der Kombination mit Chemotherapie bei de novo aufgetretener AML mit IDH2-Mutation untersucht.
Study-Updates – Kombinationsstudien
Hypomethylierende Substanzen (HMA) wie Azacytidin und Decitabin stellen derzeit den Goldstandard für nicht intensiv behandelbare Patienten dar; besonders Patienten im MDS-Vorstadium und/oder mit ungünstigen genetischen Aberrationen scheinen von diesen Therapien zu profitieren. Leider ist derzeit kein Langzeitüberleben zu erreichen ohne nachfolgende Therapiekonzepte wie eine allogene Transplantation, die vielen dieser Patienten aufgrund biologischer Faktoren verwehrt bleibt. Somit ist das Feld weit geöffnet für eine Vielzahl von Kombinationstherapien mit HMA.
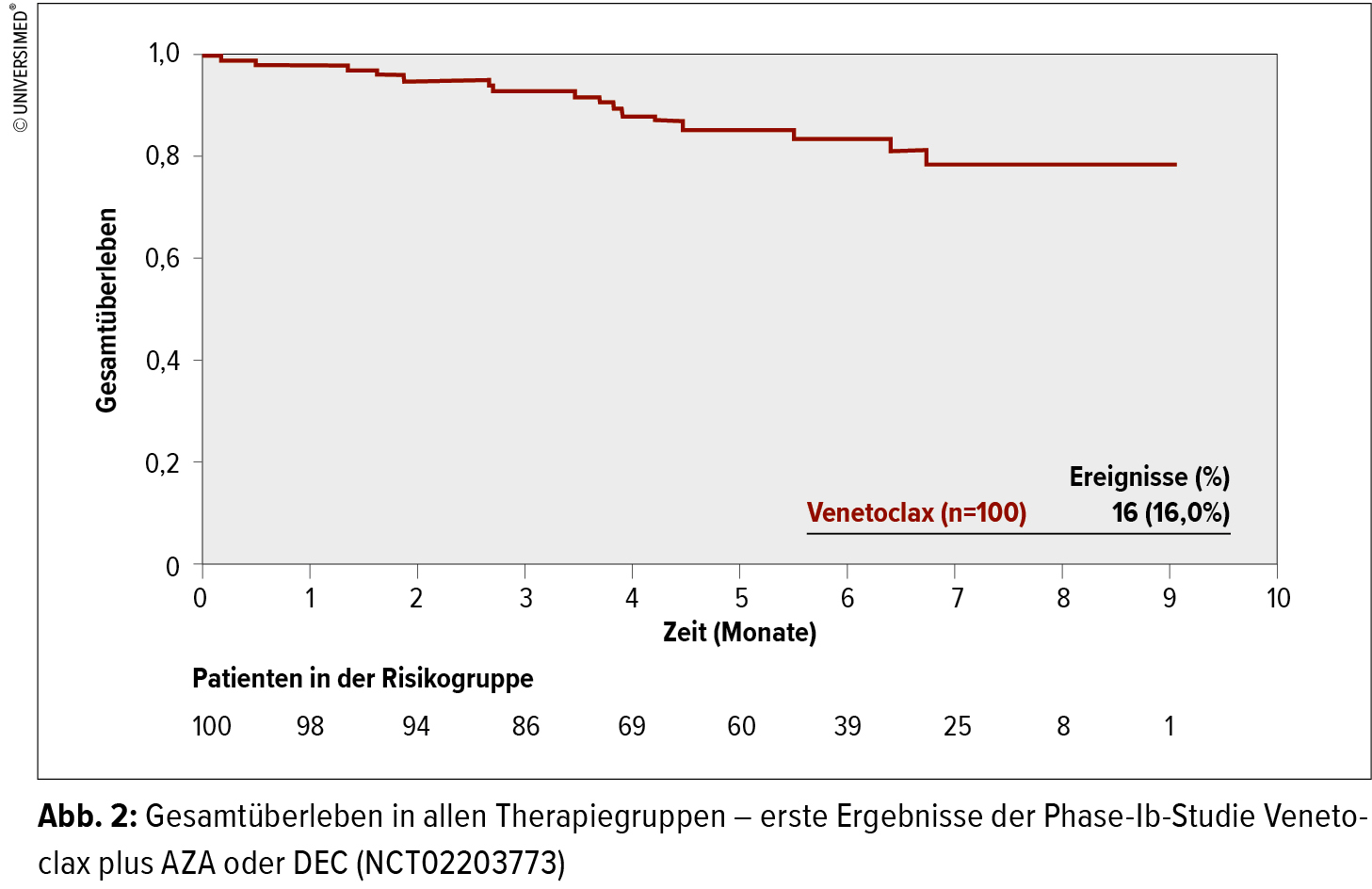
Venetoclax, ein oral verfügbarer BCL-2-Inhibitor, wurde als eine dieser Substanzen in einer Phase-Ib-Studie bei neu diagnostizierten AML-Patienten >65 Jahre, welche ungeeignet für eine intensive Therapie waren, in Kombination mit Azacytidin (AZA) oder Decitabin (DEC) verglichen.5 Die Daten von 100 inkludierten Patienten wurden präsentiert. Die Patienten erhielten Venetoclax nach einer Ramp-up-Phase in 2 verschiedenen Dosierungen: 400mg/Tag oder 800mg/Tag. Die Toxizität der Therapiekombination war tolerabel, es trat bei keinem Patienten ein Tumor-Lyse-Syndrom (TLS) ein. Das durchschnittliche Ansprechen in allen 4 Therapiegruppen lag bei 73 % (CR+ CRi), auch Patienten mit ungünstiger Zytogenetik zeigten ein gutes Ansprechen. Die Rate des medianen Gesamtüberlebens aller Studienpatienten lag bei 79 % nach 6 Monaten bzw. 70 % nach 12 Monaten. Unter Berücksichtigung dieser vielversprechenden Ergebnisse wird nun bereits in Kürze die Phase-III-Studie starten.
Ein weiteres Update mit längerem Follow-up der Kombination aus Venetoclax und niedrig dosiertem Cytarabin (LDARAC) wurde von A. H. Wei vorgestellt.6 Die Remissionsraten in der Monotherapie liegen bei ca. 19 % . Venetoclax in einer Dosierung von 600mg nach einer kurzen Ramp-up-Phase zeigte in der Kombination keine dosislimitierenden Toxizitäten, insbesondere auch kein TLS. Nach einem raschen Ansprechen mit einer medianen Zeit bis zur Response von einem Monat lag die Remissionsrate (CR, CRi) bei 62 % . Die Remissionen waren anhaltend (65 % nach 12 Monaten), das mediane Gesamtüberleben der Gesamtpopulation lag bei 12 Monaten. Eine randomisierte Phase-III-Studie der Kombination hat bereits begonnen.
Die Rationale der Therapiekombination von HMA und PD-1/PD-L1-Inhibitoren basiert auf der Tatsache, dass PD-1-positive Zellen bei AML-Patienten hochreguliert und mit einer Resistenz gegenüber AZA verbunden sind. Die Kombination von AZA und Nivolumab, einem PD-1-Inhibitor, wurde bei R/R AML untersucht, 42 Patienten hatten eine HMA-Vorbehandlung.7 Die bereits erwarteten Immuntoxizitäten der Grade 2–4 traten bei 16/42 Patienten auf (Pneumonitis, Nephritis, Hautreaktionen, Transaminitis), 2 Fälle von Zytokin-Release-Syndrom (CRS) wurden dokumentiert. Die ORR lag bei 32 % mit 22 % CR/CRi, das Überleben nach einem Jahr ohne allogene Transplantation bei 35 % in der Gesamtkohorte. Die Autoren konnten einen Zusammenhang herstellen zwischen dem Therapieerfolg der Patienten mit den T-Zell-Werten vor Therapiebeginn.
CPX-351 – Subgruppenanalysen
CPX-351 ist eine liposomale Formulierung von Cytarabin und Daunorubicin im Verhältnis 5:1. In einer randomisierten Phase-III-Studie mit dem Vergleich von CPX-351 und dem Standard 7+3 konnte bei älteren, jedoch intensiv behandelbaren Patienten ein signifikant längeres Gesamtüberleben erreicht werden.8
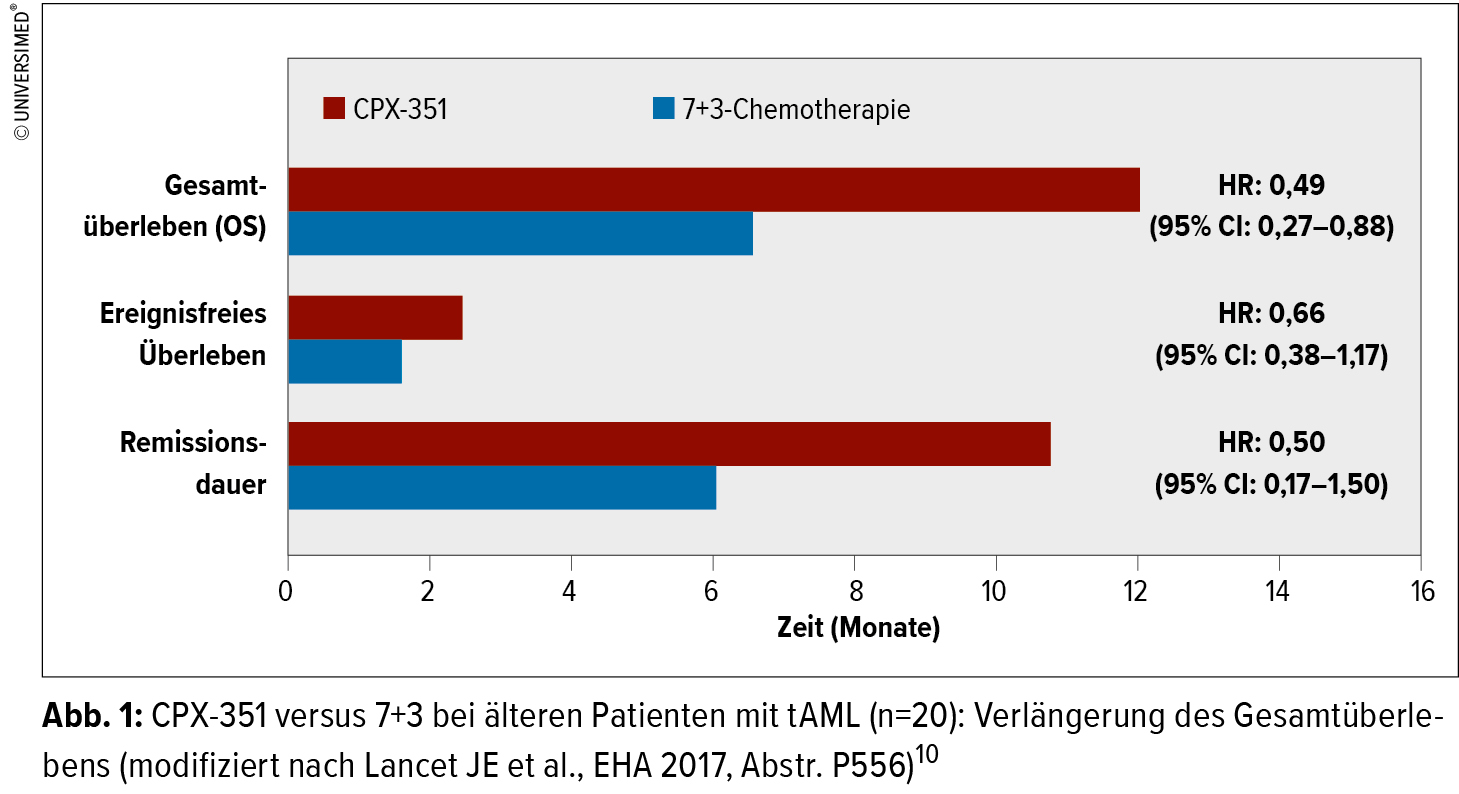
Zwei interessante Posterpräsentationen beschäftigten sich nun mit Subgruppenanalysen der randomisierten Studie. Patienten der genetisch ungünstigen Subgruppe – FLT3+-AML – hatten ein verlängertes OS (10,25 vs. 4,55 Monate; HR: 0,57) und eine größere Anzahl von Patienten aus dieser Gruppe konnte einer allogenen Transplantation unterzogen werden.9, 10 Auch bei der schwierigen Subgruppe der Patienten mit therapieassoziierter myeloischer Leukämie (tAML) zeigte sich bei 62 Patienten für CPX-351 ein signifikanter Überlebensvorteil, es konnte bei einer größeren Anzahl dieser Patienten eine CR erreicht bzw. eine allogene Transplantation durchgeführt werden (Abb. 1).
MRD
Die Bedeutung der Reduktion der Resterkrankung auf ein Minimum (MRD) in der AML-Therapie und ihre Auswirkung auf die weitere Therapie und das Gesamtüberleben der Patienten wurden in mehreren Arbeiten untersucht. MRD kann einerseits durch den Nachweis spezifischer genetischer Veränderungen und andererseits durch FACS-Analyse unter Nachweis eines sogenannten Leukämie-assoziierten Immunphänotyps (LAIP) bestimmt werden. Der optimale Zeitpunkt der Untersuchung ist nicht eindeutig klar, die meisten publizierten Studien untersuchen die MRD nach der 1. Konsolidierung sowie nach jedem weiteren Zyklus.
A. Venditti präsentierte eine Machbarkeitsstudie der GIMEMA, die die Postremissionstherapie bei AML-Patienten mit autologer oder allogener Transplantation je nach genetischer Risikogruppe bzw. dem molekularen Ansprechen untersuchte. Die MRD wurde nach Konsolidierung 1 mittels FACS-Analyse und Nachweis des Leukämie-assoziierten Immunphänotyps und genetischer Untersuchungen festgestellt.11 Niedrigrisikopatienten wurden autolog transplantiert, Hochrisikopatienten einer allogenen Transplantation unterzogen. Bei Patienten mit intermediärem Risiko wurde die Entscheidung vom Nachweis der MRD abhängig gemacht. 341/500 Patienten konnten nach Verabreichung der 1. Konsolidierungstherapie einer Risikogruppe zugeordnet werden: 114 (33 % ) der Niedrigrisikogruppe, 122 (36 % ) der Hochrisikogruppe und 78 (23 % ) der Gruppe mit intermediärem Risiko, davon waren 8 % ohne LAIP und wurden autolog transplantiert.
Die Autoren postulierten die Machbarkeit einer MRD-getriggerten Therapie im Rahmen einer multizentrischen Studie, eine allogene Transplantation konnte bei 27 (8 % ) der Patienten in der Gruppe mit intermediärem Risiko vermieden werden.
Bislang untersuchten die meisten Studiengruppen MRD mithilfe der FACS-Analyse oder des genetischen Nachweises von Einzelmarkern. Am EHA-Kongress wurde ein NGS-Panel, „myMRD™“, vorgestellt, welches das gesamte AML-Biomarker-Repertoire enthält und Rezidivklone bei >90 % aller rezidivierten Patienten nachweisen kann.12 Die Methode hat ein Nachweislimit von 0,5 % , im Fall von Einzelklonen wie z.B. FLT3-ITD von 0,1 % , und stellt somit ein vielversprechendes Werkzeug für die Therapieentscheidung bei AML dar.
Die AML ist eine äußerst heterogene Erkrankung, aber das verbesserte Verständnis der Pathogenese und der genetischen Architektur der AML ist ein starker Anreiz für die Entwicklung maßgeschneiderter Therapien bzw. Therapiekombinationen, die zunehmend Eingang in den klinischen Alltag finden werden.
1 Stone R Met al.: Midostaurin plus chemotherapy for acute myeloid leukemia with FLT3 mutation. N Engl J Med 2017; doi: 10.1056/NEJMoa1614359 [Epub ahead of print] 2 Hills R et al.: Quizartinib and bridge to transplant in FLT-3 –ITD AML patients after failure of salvage chemotherapy: a historical comparison with UK National Cancer Research Institute (NCRI) data. EHA 2017; Abstract S475 3 Jessica A et al.: Deep molecular response to gilteritinib improves survival in FLT-3 mutation-positive relapsed /refractory AML. EHA 2017; Abstr. S110 4 Stein E et al.: Enasidenib (AG221) in mutant-IDH2 relapsed or refractory AML (R/R AML): results of a phase 1 dose escalation and expansion study. EHA 2017; Abstr. S471 5 Pratz K et al.: Safety and efficacy of venetoclax in ccombination with decitabine or azacitidine in treatment-naive, elderly patients (>65 years) with acute myeloid leukemia (AML). EHA 2017, Abstr. S472 6 Wei AH et al.: Updated safety and efficacy results of phase 1/2 study of venetoclax plus low-dose cytarabine in treatment-naive AML patients aged ≥65 years and unfit for standard induction therapy. EHA 2017; Abstr. S473 7 Daver N et al.: Phase IB/II study of nivolumab in combination with azacytidine (AZA) in patients (pts) with relapsed acute myeloid leukemia. EHA 2017; S474 8 Lancet JE et al.: Final results of a phase III randomized trial of CPX-351 versus 7+3 in older patients with newly diagnosed high risk (secondary) AML. J Clin Oncol 2016; 34(suppl; abstr 7000) 9 Medeiros BC et al.: Overall survival and transplantation in patients with FLT3 mutations: subgroup analysis of a phase 3 study of CPX-351 versus 7+3 in older adults with newly diagnosed high-risk acute myeloid leukemia. EHA 2017; Abstr. P210 10 Lancet JE et al.: Overall survival with CPX-351 versus 7+3 in older adults with newly diagnosed, therapy related acute myeloid leukemia: subgroup analysis of a phase 3 study. EHA 2017; Abstr. P556 11 Venditti A et al.: Risk-adapted, MRD directed therapy for young adults with newly diagnosed AML: results of the AML1310 Trial of the GIMEMA Group. EHA 2017; S111 12 Mcclain V et al.: Next generation sequencing targeted panel for minimal residual disease monitoring in AML. EHA 2017; Abstr. P197
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


