Alles dreht sich um Venetoclax, oder doch nicht alles?
Autor:
PD Dr. med. Boris Eugen Schleiffenbaum
Hämatologie
Klinik im Park, Zürich
AndreasKlinik Cham, Hirslanden
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nachdem die Kombination von hypomethylierenden Substanzen (HMA) in Kombination mit Venetoclax zum Therapiestandard für ältere Patienten geworden ist,1 richtete sich am Jahreskongress der American Society of Hematology (ASH) 2021 wie schon in den Vorjahren ein Grossteil der Aufmerksamkeit auf Venetoclax-basierte Therapien.
Neu diagnostizierte AML bei Hochrisikopatienten
Stoffwechselspezifische Therapien
Für Patienten mit IDH1/2- und FLT3-Mutation gibt es zugelassene Medikamente, die in der Induktion neben «7+3» (Midostaurin)2 bisher vor allem als Monotherapie im rezidivierten/refraktären (R/R) Setting oder als «maintenance» nach Stammzelltransplantation eingesetzt wurden bzw. auch in Kombinationen mit HMA in Phase-II-Studien. Eine «open-label» Phase-III-Studie zeigte zwar im Vergleich Gilteritinib (2. Generation Typ-I-FLT3-Inhibitor [FLT3-I]; 120mg p.o., d1–28) plus Azacitidin (AZA; 75mg/m2 s.c., d1–7, 28d-Zyklus) vs. AZA ein signifikant verbessertes Ansprechen für die Zweifachkombination (Rate an zytogentischen Komplettremissionen [CRc]: 58,1 vs. 26,5%), aber kein verlängertes Gesamtüberleben (OS).3 Die Autoren machten hierfür das vom Studiendesign mögliche Cross-over vom AZA-Arm in den Kombinationsarm verantwortlich.
Dreifachkombinationen
Die australische Phase-II-Studie INTERVENE zeigte ein ausserordentliches Ansprechen auf die Dreifachkombination aus Midostaurin (1. Generation Typ-I-FLT3-I; 50mg p.o. zweimal täglich, d11–28), «low-dose» Cytarabin (LDAC; 20mg s.c., d1–10) und Venetoclax (VEN; 600mg p.o., d1–28). Die CRc betrug hier 77,8% und die OS-Rate nach 6 Monaten lag bei 81,3%, wobei die Beobachtungszeit bisher sehr kurz war.4
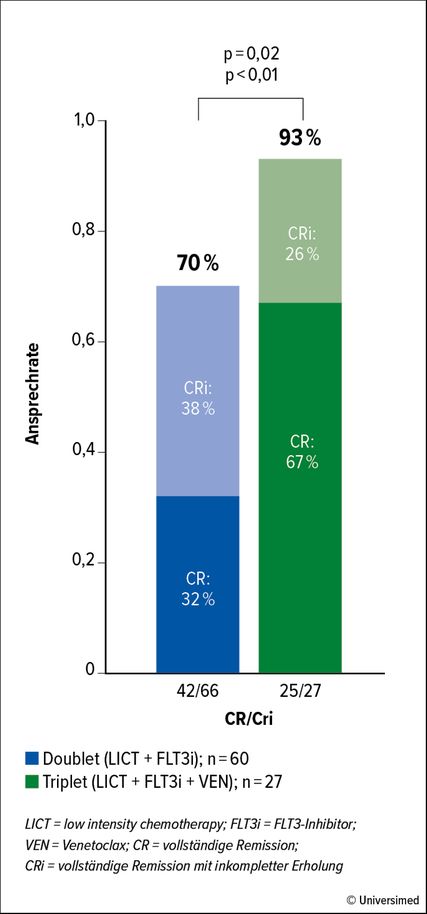
Abb. 1: Bestes Ansprechen unter Doublet- vs. Triplet-Therapie in der retrospektiven Studie des MD Anderson Cancer Center (modifiziert nach Yilmaz M et al.)5
In der Vorbereitung möglicher Studien zur Dreifachkombination unter Einschluss von Venetoclax untersuchte eine retrospektive Studie aus dem MD Anderson Cancer Center Triplet-Therapie gegen Doublet-Therapie: Als Triplet wurde eine «low intensity chemotherapy» (LICT) mit Decitabin(DEC) oder AZA verabreicht in Kombination mit einem FLT3-I (Midostaurin, Quizartinib, Sorafenib, Gilteritinib) plus Venetoclax. Die Doublet-Therapie bestand aus LICT mit DEC oder AZA oder LDAC oder Cladribin/LDAC in Kombination mit FLT3-I (Midostaurin, Quizartinib, Sorafenib).
Trotz dieses etwas «eigenartigen» Studiendesigns lassen die Ergebnisse doch aufhorchen: Die Rate an vollständigen Remissionen (CR) bzw. vollständigen Remissionen mit unvollständiger Erholung (CRi) lag bei 93% unter Triplet-Therapie vs. 70% unter Doublet-Therapie (Abb. 1). Die Rate an Patienten, die hinsichtlich einer minimalen Resterkrankung (MRD) negativ waren, betrug 96 vs. 54%.
Hinsichtlich des Gesamtüberlebens wurde der Median unter Triplet-Therapie nicht erreicht und lag unter Doublet-Therapie mit einem FLT3-I der 2. Generation bei 15,7 Monaten und bei 8,7 Monaten unter Doublet-Therapie mit einem FLT3-I der 1. Generation.5
Folgerichtig legte das MD Anderson Cancer Center daher eine Phase-Ib/II-Studie auf, die eine Dreifachkombination aus Quizartinib (30–40mg p.o., d1–28 [bis d14 in der Konsolidation, bis zu 12 Zyklen]), DEC (20mg i.v., d1–10 [bis d5 in der Konsolidation]) und VEN (400mg p.o., d1–21 [bis d14 in der Konsolidation]) mit vielvesprechendem Erfolg testete: Die CRc lag bei 100% (aber n=5) und das OS bei 14,5 Monaten. Die Mortalitätsrate nach 60 Tagen betrug 0%. Für 60% der Patienten stellte die Studienmedikation eine Bridging-Therapie bis zur Transplantation dar.6 Wegen der langen Aplasiezeiten wurde die Gabe von Quizartinib und VEN in der Phase II auf d1–14 beschränkt.
Daten aus einer Phase-I/II-Studie zeigten ebenfalls ein gutes Ansprechen auf die Kombination von VEN/AZA und Gilteritinib. Hervorheben muss man sicherlich die myelosuppressive Wirkung dieser Dreifachkombination, was einerseits eine Reduktion der Gilteritinib-Dosis auf 80mg und andererseits eine verkürzte Anwendung von VEN und AZA im 28-Tage-Zyklus notwendig macht.7
AGILE
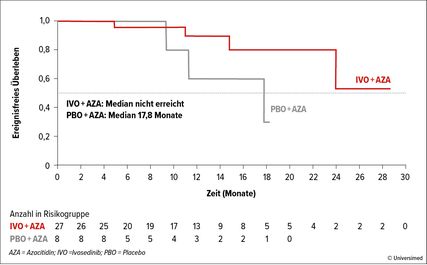
Abb. 2: AGILE-Studie: ereignisfreies Überleben der Patienten, die innerhalb von 24 Wochen eine Komplettremission erlangten (modifiziert nach Döhner H et al.)8
Für Patienten mit IDH1-Mutation zeigte die Phase-III-Studie AGILE sehr gute Daten für die Kombination aus Ivosidenib (500mg p.o., d1–28) plus AZA (75mg/m2 s.c./i.v., d1–7) vs. AZA. Die allgemeine Ansprechrate (ORR) betrug 62,6 vs. 18,9%. Die CR lag bei 47,2 vs. 14,9%. Im experimentellen Arm wurde der Median des ereignisfreien Überlebens (EFS) nicht erreicht und lag bei 17,8 Monaten unter AZA (HR: 0,33). Das OS betrug im Median 24,0 vs. 7,9 Monate (HR: 0,44),8 wobei hier sicherlich der direkte Vergleich mit dem jetzigen Therapiestandard VEN/AZA für die zukünftige Behandlung dieser Patienten entscheidend sein wird.
Olutasidenib
Eine Phase-II-Studie mit einem anderen IDH1-Inhibitor, Olutasidenib (150mg p.o. BID, d1–28), plus AZA (5mg/m2 s.c./i.v., d1–7) zeigte ebenfalls sehr gute Ansprechraten (CR/CRi: 64%). Der Median der Remissionsdauer wurde nicht erreicht,9 wobei es im Median 2,8 Monate bis zum ersten Ansprechen dauerte bzw. 4,0 Monate bis zum Erreichen der CR/CRi. Zu beachten bleibt eine Verlängerung der QTc sowie eine Erhöhung der Transaminasen und, wie bei allen IDH1-Inhibitoren, das Differenzierungssyndrom.
Eprenetapopt
Basierend auf den guten Daten mit APR-246 (Eprenetapopt), einem «first-in-class small molecule» aus einer Phase-Ib/II-Studie10, wurden am ASH-Meeting nun Daten der Phase-II-Studie präsentiert.11
APR-246 wird intrazellulär in Methylenequinuclidinon umgewandelt, welches kovalent an TP53 bindet und über eine Konformationsänderung desTP53-Moleküls dessen Funktion wiederherstellt und somit den Weg der Tumorzelle in die Apoptose freimacht. Gleichzeitig inhibiert es die Thioredoxin- und Glutaredoxin-Reduktase und vermindert damit die Konzentration an Glutathion, was den oxidativen Stress für die Zelle erhöht. Und schliesslich führt es über die Ferroptose, einen eisenabhängigen nicht apoptotischen Weg, zum Zelltod.
Präklinische Daten konnten einen Synergismus mit AZA zeigen. Die Gabe von APR-246 (4500mg/d i.v. über 6h, d1–4) in Kombination mit AZA (75mg/m2/d s.c., d8–12, 28d-Zyklus) an Patienten mit einem myelodysplastischen Syndrom bzw. neu diagnostizierter AML mit niedriger Blastenzahl führte zu einer raschen Reduktion der TP53-mutierten Varianten-Allelfrequenz (40/100 Patienten erreichten eine Clearance <5% nach «next-generation sequencing» [NGS]). Dies traf auch bei Patienten mit biallelischen oder multiplen Mutationen zu.
Dabei war die Toxizität relativ gering ausgeprägt (Grad≥3: febrile Neutropenie 33%, Pneumonie 25%, Nausea, Erbrechen, voll reversible Ataxie und Schwindel abhängig vom Alter und der GFR) mit einer 30d-Mortalität von 1% und 60d-Mortalität von 7%. Auch die klinischen Daten bei diesen schwer therapierbaren Patienten waren gut: 43 von 100 Patienten erreichten eine CR. Das mediane OS betrug 11,8 Monate, in der Gruppe der Patienten mit TP53-Mutation lag es bei 10,1 Monaten, ohne TP53-Mutation bei 15,8 Monaten.
Während des Kongresses wurden allerdings Daten einer Phase-III-Studie bekannt, die ihren primären Endpunkt (CR) nicht erreichte. Präsentator David Sallman erklärte dies einerseits mit einer in multizentrischen Studien nicht ausreichenden Adhärenz an das Dosierungsschema, andererseits mit dem Open-Label-Design der Studie, die den Therapiewechsel auf Wunsch der Patienten begünstigt.
Magrolimab
Im angeborenen Immunsystem wird die Phagozytose der Makrophagen durch prophagozytäre Signale wie Calreticulin und antiphagozytäre Signale wie CD47 geregelt. Krebszellen vermeiden die Phagozytose durch Überexpression von CD47, wie erstmals für die AML gezeigt.12 Magrolimab, ein humanisierter IgG4-anti-CD47-Antikörper, stellt die Phagozytose von Leukämiestammzellen (LSC) in vitro und in vivo wieder her.13 Als Monotherapie in der R/R AML war Magrolimab zwar sicher, aber ineffektiv.14 Aufgrund präklinischer Daten, die zeigten, dass AZA zu einer vermehrten Expression von Calreticulin auf AML-Zellen führt, wurde die Kombination von AZA und Magrolimab in einer Phase-Ib-Studie, diesmal mit grossem klinischem Erfolg, getestet.15, 16
Angesichts der Effektivität der Kombinationstherapie aus AZA (75mg/m2 s.c., d1–7) und VEN (400mg/d p.o., d1–28, nach «ramp up») in der Behandlung der AML war es naheliegend, diese Kombination um Magrolimab (Zyklus 1: 2x/w; Zyklus 2: 1x/w; ab Zyklus 3: alle 2w; 1mg/kg C1d1; 15mg/kg C1d4+8; 30mg/kg C1d11+) zu erweitern.17
Schon im 1. Zyklus erreichten 94% (15/16) der Patienten eine CRi, 81% eine CR mit einer CRc in 75% (9/12) und einer MRD-Negativitätsrate von 55% (7/13, MFC <0,01%). Bei einer noch sehr kurzen Beobachtungszeit (Median 3,4 Monate) kam es nur in 1/17 Fällen zu einem Rezidiv, 1 Patient in morphologisch Leukämie-freiem Status starb.
Die Ergebnisse der TP53-mutierten Patienten entsprachen denen der übrigen Patienten (CR/CRi: 100% [7/7], CR: 86% [6/7], CRc 75% [3/4], MRD-Negatitivtätsrate 57% [4/7]; 6/7 in Remission). Die Therapie wurde bestens vertragen (4-/8- Monats-Mortalität 0%; Elektrolytstörungen Grad 1+2; Grad 3+4: Pneumonie 32%, febrile Neutropenie 32%; Hyperbilirubinämie 11%, ALT-Erhöhung 11%). Die Patienten, die eine CR/CRi erreichten, erholten sich hämatologisch schnell. Der Magrolimab-Phagozytose-bedingte Hämoglobin-Abfall bot klinisch keine Probleme.
Die in dieser Phase-Ib/II-Studie beschriebene Kombinationstherapie der AML mit AZA/VEN/Magrolimab könnte einen erneuten Durchbruch in der Behandlung dieser Erkrankung bedeuten:
Die Ansprechraten der Hochrisiko-AML-Patienten (82% «adverse risk»; 47% «adverse cytogenetic risk»; 35% therapieassoziierte AML, 18% sekundäre AML) in dieser Studie in der Erstlinientherapie waren extrem hoch und die Nebenwirkungen sehr gering, obwohl es sich um eher ältere (im Mittel 70 Jahre) und gebrechliche Patienten (ECOG ≥ 2: 47%) handelte. Natürlich ist die Beobachtungszeit noch zu kurz, um den langfristigen Therapieerfolg zu beurteilen. Die Ansprechraten lassen diesbezüglich aber hoffen.
Mein Enthusiasmus speist sich aber auch aus dem der Studie unterliegenden biologischen Konzept. Nicht nur werden hier drei verschiedene, insgesamt gut verträgliche therapeutische Prinzipien (der hypomethylierende epigentische, teilweise wohl auch chemotherapeutische Ansatz von AZA; die Anti-Anti-Apoptose von VEN und die Reaktivierung der CD47-supprimierten Phagozytose von Magrolimab) miteinander kombiniert, darüber hinaus erscheint gerade diese Kombination biologisch sinnvoll. Die durch AZA und VEN bewirkten Schäden bzw. Veränderungen an der Tumorzelle induzieren die Expression von Calreticulin und machen so die Phagozytose der Zelle mit der Gabe des Anti-CD47-Antikörpers (Magrolimab) erst möglich.
Alle drei therapeutischen Prinzipien sind nicht mutationsspezifisch – was der Tumorzelle die Möglichkeit zum Ausweichen der Therapie durch erneute Mutation geben würde –, sondern zielen differenziell auf die AML-Zelle: CD47 ist ein LSC-Marker. Die Kombinationstherapie aus AZA und Magrolimab reduziert CD34+CD38-LSC im Knochenmark. Dies macht Hoffnung auf lang anhaltende Remissionen. Es darf angenommen werden, dass die Wirkung auf LSC wahrscheinlich in vermehrtem Masse, auch für die hier diskutierte Dreiertherapie nachgewiesen werden kann.
Es könnte aber durchaus sein, dass die Ergebnisse der nun notwendigen Phase-III-Studien so gut sein werden, dass sich die Frage nach einer Änderung des Therapiestandards auch für jüngere, fitte Patienten weg von der klassischen «3+7»-Induktion hin zu AZA/VEN/Magrolimab stellen könnte. Die Organisatoren des ASH scheinen diese Ansicht zu teilen, denn die «Ham-Wasserman Lecture» hatte Stammzellen zum Thema und die gemeinsame Veranstaltung von EHA und ASH thematisierte die CD47-Antikörper-Therapie.
Neue intensive Induktionstherapien
Die Kombination von Pro-Apoptose und Anti-Anti-Apoptose war schon das Prinzip der Kombinationstherapie AZA/VEN. Es liegt also nahe, VEN mit klassischen Induktionstherapien der AML zu kombinieren, so wie in der Phase-II-Studie, in der zum modifizierten FLAG-Ida (mit bis zu 5 Zyklen Konsolidation) die zusätzliche Gabe von VEN untersucht wurde. Bei einer 60d- Mortalität von 0% war die Ansprechrate wie auch das OS bemerkenswert. In dieser Population von vorwiegend Intermediate-Risk- (40%) und High-Risk-Patienten (42%) konnten 67% der Patienten zur Stammzelltransplantation gebracht werden. TP53-mutierte Patienten hatten jedoch auch unter dieser Therapie eine schlechte Prognose.18
CPX-351
CPX-351 (liposomales Daunorubicin/AraC in einem festen 1:5 molaren Verhältnis) ist etabliert in der Induktionstherapie der Hochrisiko-AML. Angesichts der Therapieerfolge der AZA/VEN-Kombinationstherapie stellt sich nun die Frage, welche der beiden Therapien Standard sein sollte in der Behandlung der Hochrisikopatienten.
Eine retrospektive Studie der Universität von Pennsylvania fand ein in etwa gleiches OS für die mit CPX-351 und die mit AZA/VEN behandelten Patienten. Es fällt schwer zu verstehen, warum diese Studie mit dem Preis für die beste orale Präsentation ausgezeichnet wurde, waren die CPX-351 (n=217) und AZA/VEN (n=439) zugeteilten Patienten bzw. deren Behandlungsmodalitäten doch kaum vergleichbar: Alter (67 vs. 75 Jahre), Art des Krankenhauses (akademisch/Stadtspital: 47% vs. 34%) und Zahl der Patienten, die transplantiert werden konnten (61% vs. 44%), unterschieden sich erheblich. Bemerkenswert ist, dass trotz dieses Missverhältnisses die mit AZA/VEN behandelten Patienten weniger febrile Neutropenien und weniger Infekte hatten und weniger lang hospitalisiert werden mussten.19
Real-World-Daten sollten dann ein insgesamt längeres OS für mit CPX-351 behandelte Patienten zeigen. Aber auch hier wurden ganz unterschiedliche Arten von Patienten miteinander verglichen. Dies zeigte sich darin, dass für die Patienten, die nach der Transplantation zensiert wurden, das OS in etwa gleich ausfiel und dass das OS nach erfolgter Transplantation ebenfalls für beide Gruppen in etwa gleich war. Mit anderen Worten: Es wurden wiederum viel mehr Patienten aus der CPX-351-Gruppe als aus der Ven/AZA-Gruppe transplantiert.20
Rezidivierte/refraktäre AML
Vom Therapieprinzip – MLL-1-Inhibition durch die Verdrängung des MLL-1 vom Menin – her besonders interessant war die Phase-I-Studie AUGMENT-101: Die stark vorbehandelten rezidivierten/refraktären (R/R) AML-Patienten mit NPM1-Mutation/MLL-Rearrangement sprachen auf die Monotherapie mit dem Menin-Inhibitor SNPX513 gut an (ORR: 55%; CRc: 24%, MRD-Negativitätsrate: 92%). Die Inhibition der Transkription im HOX/MEIS1-Stoffwechsel bewies die Menin-Inhibition als aktives Therapieprinzip. Bei 14% der Patienten kam es zu einem Differenzierungssyndrom.21
Die MRD-Negativität gilt auch in der AML als einer der entscheidenden prognostischen Faktoren. Nun ist einerseits die MRD in der AML nicht einfach und vor allem auch standardisiert messbar und andererseits stellt sich die Frage, was besser ist: repetitives Messen der MRD und frühzeitige Reinduktion im molekularen Rezidiv oder aber eine «Maintenance»-Prophylaxe?
Durch aufwendiges und auch teureres «next-generation sequencing» konnte nun gezeigt werden, dass molekulare Remissionen 2–9 Monate vor dem klinischen Rezidiv auftreten. Zum Teil zeigen sie also eine erhebliche Dynamik. Vor allem aber wurde gezeigt, dass neue Mutationen häufiger dem klinischen Rezidiv vorangehen als das Wiederauftreten vorbestehender Mutationen, was die MRD-Kontrolle über eine spezifische Mutation infrage stellen könnte.22
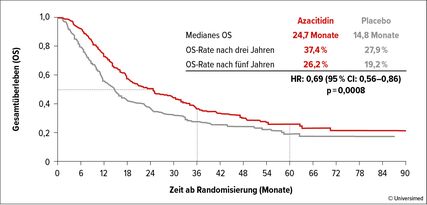
Auch dieses Jahr wurden Follow-up-Daten der QUAZAR-AML-001-Studie gezeigt, mit weiterhin deutlich verlängertem medianem OS (24,7 vs. 14,8 Monate; HR: 0,69; Abb. 3) für die mit dem oralen Azacitidin CC-486 behandelten Patienten. Die Kaplan-Meier-Kurven zeigten eine weitere Separation und damit den Langzeitvorteil vor allem für Intermediate-Risk- und NPM1-mutierte Patienten.23
Persönliches Fazit
Bei der AML handelt es sich nicht um eine singuläre Erkrankung, sondern eher um viele verschiedene Erkrankungen mit einem ähnlichen klinischen Erscheinungsbild. Die AML ist selten und die verschiedenen Mutationen und Komutationen sind komplex, zusätzlich müssen auch epigenetische Faktoren bedacht werden. Daher denke ich, dass in Zukunft eine weitergehende, umfassendere Zusammenarbeit vieler Zentren nötig sein wird. Das BEAT-Studienkonzept in den USA macht dies schon seit einigen Jahren in der Therapie der AML vor.
Entsprechend konnte nur aufgrund der in der HARMONY Alliance AML-Database gesammelten Daten gezeigt werden, dass Patienten mit der seltenen Komutation von RAD2 und DMNT3A eine massiv bessere Prognose haben unabhängig vom NPM1-Mutationsstatus und unabhängig von einer Stammzelltransplantation.24
In den USA werden AML-Patienten häufiger im ambulanten Setting behandelt, in dosisreduziertem Schema auch über 80-jährige.25 Wiederholt wies Naval Daver in seinen Präsentationen auch darauf hin, wie wichtig es sei, dass in den akademischen Zentren der USA die dort behandelten Patienten zumindest dreimal pro Woche von ihrem Arzt gesehen werden. Laut einer epidemiologischen Erhebung erhalten nur 13% der AML-Patienten in den USA eine volle molekulare Diagnostik und 66% der Patienten im Alter von mehr als 75 Jahren erhielten gar keine Therapie.26 Es liegt also an uns allen, nicht nur die Spitzenmedizin voranzutreiben, sondern sie auch für jeden verfügbar zu machen. Dies gilt für uns alle in unseren jeweiligen Ländern, aber auch global.
Sehr zu denken sollte es nicht nur uns, sondern allen Menschen weltweit und vor allem unserer politischen Führung geben, dass in der Zeit der Pandemie es weniger wahrscheinlich war, dass ein Patient eine Stammzelltherapie erhielt und dass die Wartezeiten auf diese kurative Therapie der AML länger waren.26 Dies kann nicht ohne Auswirkungen auf die Mortalität gewesen sein und gilt ähnlich wahrscheinlich auch für alle anderen Bereiche der Medizin ausserhalb der Therapie von AML-Patienten.
Literatur:
1 Pratz KW et al.: Delays in time to deterioration of health-related quality of life were observed in patients with acute myeloid leukemia receiving venetoclax in combination with azacitidine or in combination with low-dose cytarabine. ASH-Meeting 2020; Abstr. #589 2 Stone RM et al.: Midostaurin plus chemotherapy for acute myeloid meukemia with a FLT3 mutation. N Engl J Med 2017; 377(5): 454-64 3 Wang E et al.: Phase 3, open-label, randomized study of gilteritinib and azacitidine vs azacitidine for newly diagnosed FLT3-mutated acute myeloid leukemia in patients ineligible for intensive induction chemotherapy. ASH-Meeting 2021; Abstr. #700 4 Chua CC et al.: An Australasian Leukemia Lymphoma Group (ALLG) Phase 2 Study to investigate novel triplets to extend remission with venetoclax in elderly (INTERVENE) acute myeloid leukemia. ASH-Meeting 2021; Abstr. #368 5 Yilmaz M et al.: Hypomethylating agent (HMA) therapy and venetoclax (VEN) with FLT3 inhibitor “triplet” therapy is highly active in older/unfit patients with FLT3 mutated AML. ASH-Meeting 2021; Abstr. #798 6 Yilmaz M et al.: Quizartinib (Quiz) with decitabine (DAC) and venetoclax (VEN) is highly active in patients (pts) with FLT3-ITD mutated acute myeloid leukemia (AML) – RAS/MAPK mutations continue to drive primary and secondary resistance. ASH-Meeting 2021; Abstr. #370) 7 Short N et al.: A triplet combination of azacitidine, venetoclax and gilteritinib for patients with FLT3-mutated acute myeloid leukemia: results from a phase I/II study. ASH-Meeting 2021; Abstr. #696 8 Döhner H et al.: AGILE: a global, randomized, double-blind, phase 3 study of ivosidenib + azacitidine versus placebo + azacitidine in patients with newly diagnosed acute myeloid leukemia with an IDH1 mutation. ASH-Meeting 2021; Abstr. #697 9 Cortes J et al.: Olutasidenib (FT-2102) in combination with azacitidine induces durable complete remissions in patients with mIDH1 acute myeloid leukemia. ASH-Meeting 2021; Abstr. #698 10 Sallman D et al.: Eprenetapopt (APR-246) and azacitidine in TP53-mutant myelodysplastic syndromes. J Clin Oncol 2021; JCO2002341. Online ahead of print. 11 Sallman D et al.: Long term follow-up and combined phase 2 results of eprenetapopt (APR-246) and azacitidine (AZA) in patients with TP53 mutant myelodysplastic syndromes (MDS) and oligoblastic acute myeloid leukemia (AML). ASH-Meeting 2021; Abstr. #246 12 Jaiswal S et al.: CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis. Cell 2009; 138(2): 271-85 13 Majeti R et al.: CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells. Cell 2009; 138(2): 286-99 14 Vyas P et al.: Initial phase 1 results of the first-in-class anti-CD47 antibody HU5F9-G4 in relapsed/refractory acute myeloid leukemia patients. EHA 2018; Abstr. #PF232 15 Sallman D et al.: The first-in-class anti-CD47 antibody magrolimab (5F9) in combination with azacitidine is effective in MDS and AML patients: ongoing phase 1b results. Blood 2019; 134(Suppl_1): 569 16 Sallman D et al.: The first-in-class anti-CD47 antibody magrolimab combined with azacitidine is well-tolerated and effective in AML patients: phase 1b results. ASH-Meeting 2020; Abstr. #330 17 Naval D et al.: Phase I/II study of azacitidine (AZA) with venetoclax (VEN) and magrolimab (Magro) in patients (pts) with newly diagnosed older/unfit or high-risk acute myeloid leukemia (AML) and relapsed/refractory (R/R) AML. ASH-Meeting 2020; Abstr. #371 18 Lachowiez C et al.: Venetoclax combined with FLAG-IDA induction and consolidation in newly diagnosed acute myeloid leukemia. ASH-Meeting 2021; Abstr. #701 19 Matthews A et al.: Real world survival outcomes of CPX-351 versus venetoclax and azacitadine for initial therapy in adult acute myeloid leukemia. ASH-Meeting 2021; Abstr. #795 20 Grenet J et al.: Comparing outcomes between liposomal daunorubicin/cytarabine (CPX-351) andHMA+venetoclax as frontline therapy in acute myeloid leukemia. ASH-Meeting 2021; Abstr. #32 21 Stein E et al.: Safety and efficacy of menin inhibition in patients (pts) with MLL-rearranged and NPM1 mutant acute leukemia: a phase (Ph) 1, first-in-human study of SNDX-5613 (AUGMENT 101). ASH-Meeting 2021; Abstr. #699 22 Wienecke C et al.: Clonal relapse dynamics in acute myeloid leukemia following allogeneic hematopoietic cell transplantation. ASH-Meeting 2021; Abstr. #611 23 Wei A et al.: Long-term overall survival (OS) with oral azacitidine (Oral-AZA) in patients with acute myeloid leukemia (AML) in first remission after intensive chemotherapy (IC): updated results from the phase 3 QUAZAR AML-001 trial. ASH-Meeting 2021; Abstr. #871 24 Melchor RA et al.: Does RAD21 co-mutation have a role in DNMT3A mutated AML? Results of Harmony Alliance AML Database. ASH-Meeting 2021; Abstr. #608 25 Madarang E et al.: Octogenarians with AML can have durable remissions with venetoclax and hypomethylating agent therapy despite significant dose reductions. ASH-Meeting 2021; Abstr. #1259 26 Byrd J et al.: A retrospective observational real-world study of the characteristics, genomic analysis, treatment patterns and outcomes of patients (Pts) with newly diagnosed (ND) acute myeloid leukemia (AML) in the United States. ASH-Meeting 2021; Abstr. #3383 27 Chen C et al.: The impact of COVID-19 on acute myeloid leukemia (AML) treatment patterns in the United States: retrospective analysis of an electronic medical records (EMR) database. ASH-Meeting 2021; Abstr. #4139
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...