Adjuvante Therapie des Mammakarzinoms
Autorin:
OÄ Dr. Maria Gold
Klinische Abteilung für Innere Medizin 1
Universitätsklinikum St. Pölten – Lilienfeld
E-Mail: maria.gold@stpoelten.lknoe.at
Der größte Teil der Mammakarzinome befindet sich zum Zeitpunkt der Diagnose in einem frühen (nicht metastasierten Stadium) und wird in Abhängigkeit von Größe und Nodalstatus sowie Tumorbiologie mit einer (neo)adjuvanten, kurativen, systemischen Therapie behandelt.
In den meisten Fällen erfolgen zunächst die (meist brusterhaltende) Tumorektomie und intraoperative Sentinellymphknotenbiopsie, ggf. auch Axillendissektion, im Anschluss werden zur Reduktion des Rezidivrisikos eine adjuvante systemische Therapie und meist auch Radiotherapie etabliert.
Für die meisten Patient:innen mit HR-positivem, HER2-negativem Mammakarzinom bedeutet dies eine antihormonelle Therapie über fünf (bis sieben) Jahre, je nach Menopausenstatus und Tumorstadium mit Tamoxifen oder Aromatasehemmer +/– GnRH-Analogon und Bisphosphonate.
Wie von Prof. Michael Gnant auch am ASCO-Jahrestreffen 2023 in Chicago präsentiert, stimmten beim heurigen St.Gallen-Meeting in Wien 88% der Delegierten für eine Therapie mit Aromatasehemmern (AHT) über fünf Jahre bei Brustkrebs im Stadium I. Im Stadium II sprachen sich 68% für eine sieben- bis achtjährige Dauer der adjuvanten Therapie aus, im Stadium III 68,6% für zehn Jahre.
Eine adjuvante Chemotherapie ist speziell bei postmenopausalen Patient:innen in vielen Fällen nicht erforderlich (1–3 Lymphknoten befallen, Recurrence-Score ≤25).
TAILORx: Vorteile für spezifische Gruppe
Die Studie TAILORx ergab nur bei unter 50-jährigen Patient:innen mit HR-positivem, HER2-negativem und nodalnegativem Karzinom bei Vorliegen eines Recurrence-Scores von 16–25 eine zusätzliche Risikoreduktion durch eine adjuvante Chemotherapie.
Bei prämenopausalen Patient:innen mit Lymphknotenbefall bietet die Chemotherapie jedoch einen Vorteil gegenüber einer alleinigen endokrinen Therapie (z.B. in der Studie RxPONDER).
Bei insgesamt günstigerem Rezidivirisiko verglichen mit HER2-positiven und tripelnegativen Mammakarzinomen zeigt sich jedoch bei zunehmendem Lymphknotenbefall ein erhöhtes Risiko für Rückfälle, wobei diese insbesondere nach mehr als fünf Jahren auftreten. Im Stadium II wird etwa jede dritte Patientin ein Rezidiv erleiden, im Stadium III sind es sogar mehr als 50% der Betroffenen.
MonarchE: dem Rezidivrisiko begegnen
Diesem Rezidivrisiko wurde zunächst nach der MonarchE-Studie Rechnung getragen, die zur Zulassung von Abemaciclib bei Patient:innen mit erhöhtem Rezidivrisiko führte, definiert als Befall von vier oder mehr Lymphknoten bzw. von ein bis drei Lymphknoten und ein Tumor mit einer Größe von mehr als 5cm und/oder Grad-3-Differenzierung.
Bei adjuvanter Gabe von Abemaciclib über zwei Jahre in Kombination mit üblicher AHT konnte eine Verbesserung der Rate des Überlebens ohne invasive Erkrankung (iDFS) von 5,4% erzielt werden.
NATALEE: AHT + Ribociclib
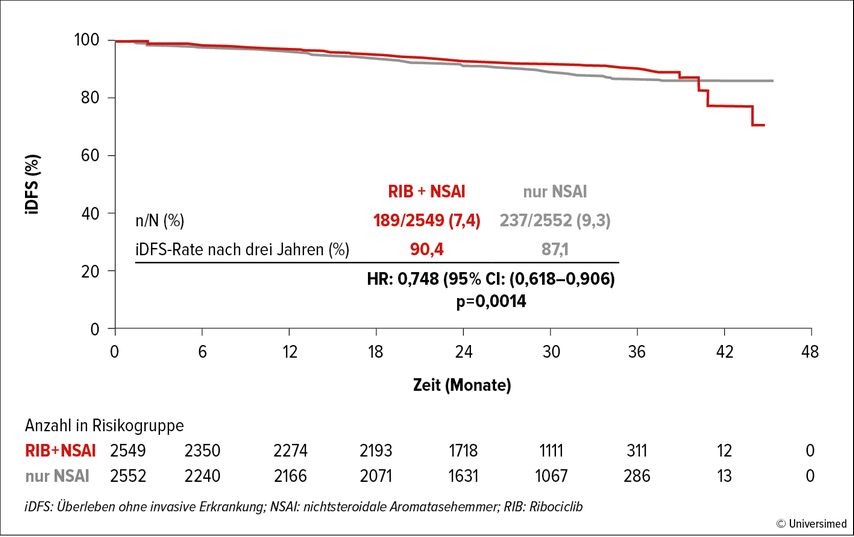
Beim diesjährigen ASCO-Jahrestreffen wurden nun auch die Daten der NATALEE-Studie präsentiert, in die über 5000 Patient:innen im Stadium II und III eingeschlossen worden waren. Bei T2,N0 musste entweder eine G3-Differenzierung oder G2 in Kombination mit einem ki67-Wert von ≥20% oder ein erhöhtes genomisches Risiko vorliegen.
Die Patient:innen wurden 1:1 randomisiert und erhielten entweder die übliche AHT oder AHT+Ribociclib über drei Jahre (anders als im metastasierten Setting mit einer 400-mg-Dosis, drei Wochen „on“, eine Woche „off“).
Der absolute Benefit im iDFS nach drei Jahren betrug 3,3%, das Risiko für eine invasive Erkrankung war gegenüber AHT alleine um 25% reduziert (Abb. 1).
In Zukunft stehen also zwei CDK4/6-Inhibitoren im adjuvanten Setting zur Verfügung. Es gab allerdings auch zahlreiche kritische Stimmen, die betonten, dass angesichts der Nebenwirkungen und der Therapiekosten eine sorgfältige Patient:innenauswahl nötig sein wird.
Eine Herausforderung:die gBRCA-Mutation
Ungeklärt ist derzeit beispielsweise auch noch, wie das Vorgehen bei Patient:innen mit gBRCA-Mutationen sein soll.
Kombinationsdaten von PARP-Inhibitoren und CDK4/6-Inhibitoren liegen noch nicht vor, von den meisten Expert:innen wird aufgrund der Toxizitäten auch davon abgeraten. Eine sequenzielle Therapie könnte eine Möglichkeit darstellen, Daten hierzu liegen aber auch noch nicht vor. Weitere Studien werden folgen.
POSITIVE: AHT bei Kinderwunsch
Bereits am SABCS im Dezember 2022 wurden von Ann Partridge die ersten Ergebnisse des POSITIVE-Trials präsentiert, bei dem prämenopausale Patient:innen mit HR-positivem Brustkrebs in den Stadien I–III, im Alter von bis zu 42 Jahren und mit bestehendem Kinderwunsch nach mindestens 18 bis max. 30 Monaten AHT eingeschlossen werden konnten.
Nach einer dreimonatigen Wash-out-Phase waren bis zu zwei Jahre Pause von der AHT für Konzeption, Geburt und Stillen erlaubt, anschließend wurde die AHT komplettiert, im Anschluss begann eine Follow-up-Phase von zehn Jahren.
Im bisherigen Follow-up-Intervall (drei Jahre) konnte kein erhöhtes Rezidivrisiko, weder lokal noch für Fernrezidive, gezeigt werden, die Langzeitdaten müssen natürlich noch abgewartet werden. Dennoch ist dies ein beruhigendes Zeichen für viele prämenopausale Patient:innen. Auch die Zahl der Komplikationen in der Schwangerschaft und bei der Geburt zeigte keine signifikanten Unterschiede zu Schwangeren ohne vorangegangene AHT.
Das frühe HER2-positive Mammakarzinom
Beim frühen HER2-positiven Mammakarzinom ist die neoadjuvante Chemotherapie in Kombination mit Trastuzumab +/– Pertuzumab der übliche Standard.
Die Bemühungen gehen hier in Richtung Deeskalation der Therapie, wie von Tolaney SM et al. bei kleinen (<3cm), nodalnegativen Tumoren mit Trastuzumab-Taxol gezeigt. Im Stadium I ist die anthrazyklinfreie Therapie mittlerweile üblich.
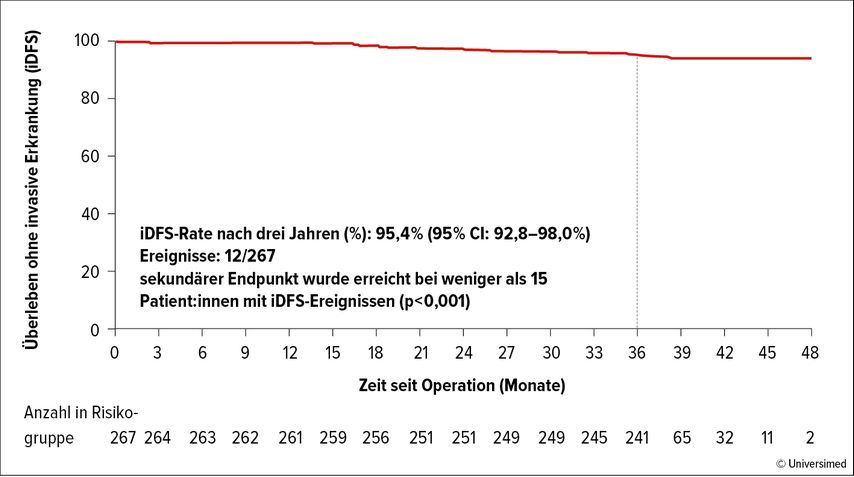
Ein weiterer interessanter Ansatz ist ein chemotherapiefreies Regime, diesbezüglich wurden rezent am ASCO-Jahrestreffen in Chicago von Javier Cortes die 3-Jahres-Daten der Studie PHERGain hinsichtlich des iDFS präsentiert (Abb. 2).
Abb. 2: Überleben ohne invasive Erkrankung in der PHERGain-Studie. Modifiziert nach Cortes J et al. 2023
In dieser Phase-II-Studie wurden Patient:innen mit HER-2-positivem EBC entweder in Arm A mit Chemotherapie und dualer HER-2-Blockade oder in Arm B nur mit Pertuzumab Trastuzumab randomisiert, Patient:innen mit HR-positivem Tumor in Gruppe B erhielten zusätzlich eine antihormonelle Therapie.
Vor Therapiestart und nach zwei Zyklen wurden F18-FDG-PET-Scans durchgeführt. Patient:innen in Arm A erhielten, unabhängig vom PET-Scan, insgesamt sechs Zyklen der Therapie, Patient:innen in Arm B komplettierten bei Ansprechen insgesamt acht Zyklen, bei Nichtansprechen wurde die Therapie auf den chemotherapiebasierten Ansatz gewechselt. Die Wahl der adjuvanten Therapie wurde in Abhängigkeit von neoadjuvantem Regime, pathologischem Ansprechen, HR-Status und klinischem Stadium zum Diagnosezeitpunkt gewählt.
Die koprimären Endpunkte waren das komplette pathologische Ansprechen(pCR)in Brust und Axilla in Arm B und das 3-Jahres-iDFS, das nun präsentiert wurde. Es lag bei 95,4% in der ITT-Population und erreichte damit den zweiten primären Endpunkt (p<0,001). Unter den chemotherapiefrei therapierten Patient:innen (PET-Ansprechen und pCR) lag das 3-Jahres-iDFS sogar bei 98,8%. Der Anteil an therapieassoziierten Nebenwirkungen war wie erwartet deutlich geringer (Grad 3 oder höher: 61,8 vs. 32,9%; p<0,001).
Dies zeigt, dass bis zu einem Drittel der Patient:innen mit HER2-positivem EBC von einem chemotherapiefreien Ansatz profitieren könnten.
Bei pCR nach neoadjuvanter Therapie erfolgt in Abhängigkeit vom initialen Risiko (v.a. Nodalstatus) eine adjuvante Komplettierung der Anti-HER-2-Therapie mit Trastuzumab +/– Pertuzumab auf ein Jahr.
Bei fehlender pCR nach neoadjuvanter Therapie ist nach den Ergebnissen der KATHERINE-Studie Trastuzumab Emtansin adjuvant für ein Jahr nach wie vor der Standard.
Als postneoadjuvante Therapieoption bei erhöhtem Rezidivrisiko steht in ausgewählten Fällen auch Neratinib nach beendeter Therapie mit Trastuzumab (≤1 Jahr) zur Verfügung.
Tripelnegativer Brustkrebs
Beim tripelnegativen Brustkrebs hat sich seit der Studie KEYNOTE-522 ab dem Stadium II die neoadjuvante Therapie mit Pembrolizumab zusätzlich zur bestehenden Chemotherapie mit Paclitaxel/Carboplatin und Anthrazyklin/Cyclophosphamid etabliert, gefolgt von einem halben Jahr adjuvanter Pembrolizumab-Gabe, unabhängig vom pCR-Status nach neoadjuvanter Therapie.
Der größte Benefit der adjuvanten Fortsetzung der Immuntherapie hat sich hierbei für die partielle Remission in der Kategorie RCB-II gezeigt, bei pCR liegen auch ohne adjuvante Therapie ausgezeichnete Überlebensraten vor, sodass, auch unter Berücksichtigung der nicht unbeträchtlichen physischen und finanziellen Toxizitäten, die adjuvante Fortführung in diesem Setting kritisch evaluiert werden wird.
Bei fehlender pCR wird derzeit – bei fehlender klarer Datenlage – abhängig vom BRCA-Mutationsstatus und von der Toleranz der neoadjuvanten Immuntherapie die adjuvante Therapie mit Capecitabin +/– Pembrolizumab bzw. Olaparib +/– Pembrolizumab empfohlen.
In Summe haben die letzten Jahre deutliche therapeutische Verbesserungen gebracht, angesichts der laufenden Studien wird es weiterhin spannend bleiben.
Literatur:
• Chan A et al.: Final efficacy results of neratinib in HER2-positive hormone receptor-positive early-stage breast cancer from the phase III ExteNET trial. Clin Breast Cancer 2021; 21(1): 80-91 • Cortes J et al.: 3-year invasive disease-free survival (iDFS) of the strategy-based, randomized phase II PHERGain trial evaluating chemotherapy (CT) de-escalation in human epidermal growth factor receptor 2-positive (HER2[+]) early breast cancer (EBC). JClin Oncol 2023; 41(Suppl. 14): Abstr. #LBA506 • ESMO Guidelines Early Breast Cancer • Johnston SRD et al.: Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2-, node-positive, high-risk, early breast cancer (monarchE). J Clin Oncol 2020; 38(34): 3987-98 • Kalinsky K et al: 21-Gene assay to inform chemotherapy benefit in node-positive breast cancer. NEJM 2021; 385(25): 2336-47 • Masuda N et al: Adjuvant capecitabine for breast cancer after preoperative chemotherapy. N Engl J Med 2017; 376(22): 2147-59 • Minckwitz G et al.: Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019; 380: 617-28 • Minckwitz G et al: Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. N Engl J Med 2017; 377: 122-31 • Partridge AH et al.: Interrupting endocrine therapy to attempt pregnancy after breast cancer. NEJM 2023; 388(18): 1645-56 • Schmid P et al.: Pembrolizumab for early triple-negative breast cancer. N Engl J Med 2020; 382(9): 810-21 • Slamon DJ et al.: NATALEE: Phase III study of ribociclib (RIBO) + endocrine therapy (ET) as adjuvant treatment in hormone receptor–positive (HR+), human epidermal growth factor receptor 2–negative (HER2–) early breast cancer (EBC). J Clin Oncol 2019; 37(Suppl. 15): Abstr. #TPS597 • Sparano JA et al.: Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer. N Engl J Med 2018; 379(2): 111-21 • Tolaney SM et al: Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer: final 10-year-analysis of the open-label, single-arm, phase 2 ATP trial. Lancet Oncol 2023; 24(3): 273-85 • Tutt ANJ et al: Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer. N Engl J Med 2021; 384: 2394-405
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...