Traitement de la vascularite associée aux ANCA: existe-t-il des alternatives sansstéroïdes?
Compte-rendu:
Dre Corina Ringsell
Rédactrice
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dans les années 1950, environ 90% des patient·es souffrant d’une vascularite associée aux anticorps cytoplasmiques antineutrophiles (ANCA) décédaient dans l’année qui suivait le début du traitement.1 Cela a changé grâce aux nouvelles thérapies, dont les effets secondaires sont désormais au centre des préoccupations. Cela est particulièrement vrai pour l’administration de stéroïdes. L’exposé du Dr méd. Cédric Jäger, médecin adjoint en néphrologie, Centre universitaire de médecine interne, Hôpital cantonal de Bâle-Campagne, a présenté des alternatives possibles.
Keypoints
-
Le traitement d’induction apporte de bons taux de rémission, mais présente une morbidité élevée due aux effets secondaires des stéroïdes.
-
La dose et la durée du traitement sont déterminantes pour les effets secondaires.
-
Les régimes à faible dose sont bénéfiques.
-
L’avacopan réduit les besoins en stéroïdes.
Les vascularites associées aux ANCA (VAA) sont des maladies auto-immunes chroniques qui s’accompagnent d’une inflammation systémique et d’une nécrose des petits vaisseaux sanguins.2 Elles sont très rares, avec une incidence d’environ 20/1000000habitants/an. Rapporté à la Suisse, cela donne, selon C. Jäger, environ 180nouveaux cas par an.
Sur le plan clinique, on distingue plusieurs phénotypes: la granulomatose avec polyangéite (GPA, anciennement maladie de Wegener) est la forme la plus fréquente en Europe, suivie de la polyangéite microscopique (PAM), la plus rare étant la granulomatose éosinophile avec polyangéite (EGPA, anciennement syndrome de Churg-Strauss).
Contexte: qu’est-ce qui caractérise les vascularites associées aux ANCA?
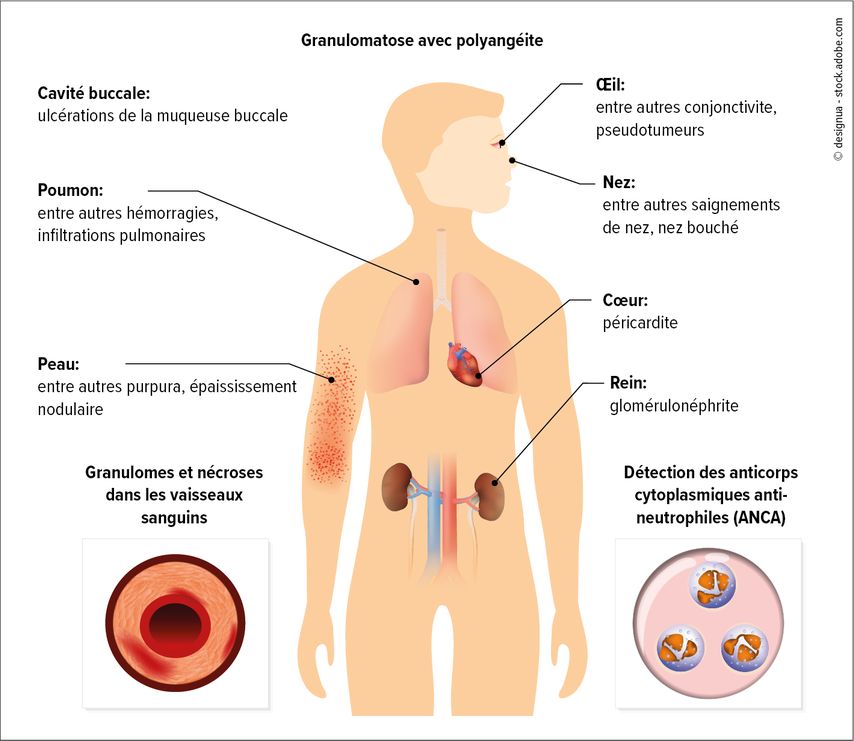
La VAA est une maladie systémique avec différentes manifestations au niveau des organes. Les organes les plus touchés sont les poumons (GPA, PAM: 60–80%) et les reins (GPA: 60–80%, PAM: 80%). Très souvent (jusqu’à 95% des cas), la GPA touche également la gorge, le nez et les oreilles. D’autres manifestations fréquentes affectent la peau, les yeux et les nerfs périphériques.3L’apparition d’une VAA est favorisée par une interaction entre des prédispositions génétiques dues à des polymorphismes de différents gènes HLA et des facteurs environnementaux tels que les polluants atmosphériques, en particulier les silicates, les infections ou les drogues, surtout la cocaïne.4Une association avec la MAP a été démontrée pour la nicotine. Il en résulte une dérégulation du système immunitaire avec une perte de la tolérance immunitaire des lymphocytes T aux antigènes des granulocytes neutrophiles.
Physiopathologie et diagnostic de la vascularite associée aux ANCA
Différents déclencheurs entraînent un amorçage des neutrophiles et une translocation de l’antigène à la surface, en particulier de PR3 et de MPO.3Les antigènes sont reconnus comme étrangers et des anticorps (ANCA) nouvellement formés contre PR3 ou MPO activent les neutrophiles. Il en résulte des réactions inflammatoires qui endommagent l’endothélium des petits vaisseaux sanguins. En même temps, une voie alternative du complément est activée, impliquant spécifiquement l’anaphylatoxine C5a.4,5
La détection des ANCA joue un rôle central dans le diagnostic. On distingue ici la GPA, où l’on détecte plus souvent des anticorps anti-PR3, et la MAP, où l’on trouve plus souvent des anticorps anti-MPO.5 C. Jäger a toutefois souligné que l’absence d’ANCA n’excluait pas la maladie, car il existe aussi des vascularites ANCA négatives. Une biopsie et un examen histologique sont alors indiqués.5
Traitement des vascularites associées aux ANCA
Les objectifs du traitement sont d’obtenir une rémission et de la maintenir. Pour ce faire, une thérapie d’induction est utilisée pendant trois à six mois afin d’endiguer le processus inflammatoire et de minimiser les dommages tissulaires. Elle est suivie d’un traitement d’entretien de 24 à 48mois afin d’éviter une rechute.6 Selon C. Jäger, des études récentes montrent toutefois qu’un traitement d’entretien plus long pourrait être nécessaire.
Fig. 1: La vascularite associée aux ANCA est une maladie systémique qui peut provoquer différents symptômes
Dans le cas du traitement d’induction, on fait la distinction entre les manifestations de la maladie qui mettent en danger les organes ou la vie du/de la patient·e et celles qui ne les mettent pas en danger.6Dans son domaine, la néphrologie, il s’agit généralement des formes qui mettent en danger les organes ou la vie, a expliqué C.Jäger. Le traitement d’induction consiste alors en une combinaison de glucocorticoïdes et de rituximab, un anticorps monoclonal anti-CD20, ou de cyclophosphamide, un alkylant. Tous deux agissent au niveau de la communication entre les lymphocytesT et les lymphocytes B. Le rituximab appauvrit les cellules B alors que le cyclophosphamide agit principalement sur les cellules T.6 Ces deux substances sont plus ou moins aussi efficaces, mais la plupart des centres favorisent désormais le rituximab en raison de son meilleur profil d’effets secondaires, selon C. Jäger. L’administration de stéroïdes se faisait traditionnellement à hautes doses pendant neuf à 15mois, conformément aux anciennes recommandations de la European League Against Rheumatism (EULAR).7Cela peut provoquer les effets secondaires connus, parfois graves, entre autres des infections, une prise de poids, une résistance à l’insuline, un risque cardiovasculaire accru, une perte osseuse.8 Les recommandations actuelles de l’EULAR conseillent donc une réduction progressive de la dose de stéroïdes.6
Augmentation de la mortalité en cas de vascularite associée aux ANCA – également liée au traitement?
Alors que dans les années 1950, environ 90% des patient·es atteint·es de VAA décédaient au cours de la première année de monothérapie par corticostéroïdes, en 2000, ce chiffre était d’environ 20% après cinq ans. Mais ce taux est toujours plus élevé que dans la population générale.1Toutefois, en y regardant de plus près, on constate des différences entre la première année de traitement et après la première année, a déclaré C. Jäger. Ainsi, une grande partie des patient·es meurent d’une infection au cours de la première année, ce qui pourrait être dû aux stéroïdes. Ensuite, les décès cardiovasculaires et les tumeurs malignes dominent.1
Une étude observationnelle rétrospective japonaise a cherché à savoir si les taux élevés d’infection au cours de la première année étaient dus à la thérapie aux stéroïdes ou à la durée de l’administration de stéroïdes.9 L’étude a porté sur 167patient·es d’un âge médian de 77ans, dont environ 80% présentaient une vascularite associée à la MPO. Il s’est avéré que les patient·es ayant reçu des doses élevées de stéroïdes sous forme de thérapie pulsée présentaient un risque d’infection plus élevé que les patient·es ayant reçu des doses plus faibles de stéroïdes au cours des 90premiers jours, mais également pendant une période plus longue. Cela a aussi eu un impact sur le taux de mortalité: les patient·es hospitalisé·es en raison d’une infection grave (virale, bactérienne, fongique) ou recevant des antibiotiques par IV en raison d’une infection bactérienne présentaient un taux de mortalité nettement plus élevé.9
Mais la durée du traitement par stéroïdes a également une influence, comme le montrent des données provenant des États-Unis.10 Sur 147patient·es atteint·es de VAA, il s’est avéré que ceux/celles qui avaient reçu des stéroïdes pendant plus de six mois présentaient des taux d’infection nettement plus élevés que ceux/celles qui avaient été traité·es pendant moins de six mois.10
L’étude PEXIVAS, publiée en 2020, visait à déterminer si une plasmaphérèse était nécessaire ou non en cas de VAA. Deux schémas différents de tapering des stéroïdes ont également été étudiés.11 La dose initiale était la même dans les deux bras de l’étude (60mg/j), mais elle a été réduite plus rapidement dans un bras (5mg/j aux semaines 15–16 par rapport à 5mg/j aux semaines 23–52). Les deux régimes ne différaient pas en termes de rémissions ou d’insuffisance rénale chronique terminale. Cependant, la dose plus faible de stéroïdes a entraîné moins d’infections au cours de la première année.11
Réduire davantage les stéroïdes ou les éviter complètement?
Dans une petite étude portant sur un total de 50patient·es, un schéma d’induction spécial a été choisi. Tous/toutes ont reçu du rituximab plus du cyclophosphamide; un groupe a reçu de la méthylprednisolone les jours 0 et 7 et de la prednisolone les jours 2 à 6. L’autre groupe a reçu une dose unique de méthylprednisolone, suivie d’une semaine de prednisolone à 60mg/j, puis d’une semaine de prednisolone à 45mg/j. Les deux groupes ont été traités avec succès. Tous/toutes les patient·es ont obtenu une rémission complète, mais seulement 12% ont souffert d’infections graves.12«Si l’on compare cela aux données des grandes études sur la vascularite, où il y a jusqu’à 30% d’infections graves, il faut dire que c’est un super taux de rémission avec moins d’infections», a souligné C. Jäger, tout en nuançant le fait qu’il ne s’agissait pas d’une étude contrôlée.
Une étude menée auprès de 11 patient·es âgé·es, dont 80% présentaient une atteinte rénale, a cherché à déterminer s’il était possible de se passer totalement de stéroïdes. Ces patient·es ont également été induit·es par le rituximab avec/sans cyclophosphamide. Aucun stéroïde n’a été administré. Cependant, tous/toutes les patient·es ont atteint une rémission complète après six mois.13
Depuis l’année dernière, le traitement d’induction par avacopan est également autorisé en Suisse. L’avacopan se lie au récepteur C5a des neutrophiles et inhibe la voie alternative du complément.14Dans l’étude de phase III ADVOCATE, 331patient·es ont été randomisé·es pour recevoir soit de l’avacopan 2x30mg/j, soit des stéroïdes en plus du rituximab ou du cyclophosphamide. À la semaine26, il n’y avait pas de différence en termes de rémission (72% par rapport à 70%, p<0,001). En ce qui concerne la rémission persistante après 52semaines, l’avacopan était significativement supérieur à la prednisone (66% par rapport à 55%, p=0,007). De plus, l’avacopan a amélioré le DFGe de 7ml/min par rapport à 4ml/min dans le groupe prednisone.14Une analyse post-hoc a porté sur les patient·es dont le DFGe était <20ml/min, les patient·es <15ml/min étant exclus. Dans ce petit sous-groupe, l’avacopan a apporté un net bénéfice, avec une amélioration du DFGe de 16ml/min (par rapport à 8ml/min).15 Dans l’ensemble, l’indice de toxicité des glucocorticoïdes était meilleur, il y avait moins d’effets secondaires associés aux stéroïdes, surtout en ce qui concerne les infections.16
C. Jäger a fait remarquer qu’en raison de la conception de l’étude, le groupe Avacopan n’était pas complètement exempt de stéroïdes. Pendant la période de dépistage, qui durait au maximum 14jours, il était encore possible d’utiliser des stéroïdes. Au moment de l’inclusion dans l’étude, la dose maximale autorisée était de 20mg, qui devaient être éliminés en l’espace de quatre semaines.
À qui l’avacopan est-il destiné?
C. Jäger a identifié trois groupes de patient·es susceptibles de bénéficier d’un traitement par avacopan:
-
en cas de risque élevé d’effets secondaires des stéroïdes en raison de comorbidités
-
en cas de risque élevé d’effets secondaires dus à des thérapies répétées en raison d’une évolution récurrente ou réfractaire
-
en cas d’atteinte rénale grave17
En Suisse, la thérapie est actuellement remboursée par la caisse-maladie pour une durée maximale d’un an, a souligné l’intervenant.
Source:
Forum d’expert·es FOMF Update Nephrologie, 6 mars 2025, en ligne
Littérature:
1 Flossmann O; European Vasculitis Study Group: Ann Rheum Dis 2011; 70: 488-94 2 Lamprecht P et al.: Front Immunol 2018; 9: 680 3 Kitching AR et al.: Nat Rev Dis Primers 2020; 6: 71 4 Furuta S, Jayne DR: Kidney Int 2013; 84: 244-9 5 Geetha D, Jefferson JA: Am J Kidney Dis 2020; 75: 124-37 6 Hellmich B et al.: Ann Rheum Dis 2024; 83: 30-47 7 Yates M et al.: Ann Rheum Dis 2016; 75: 1583-94 8 Hoes JN et al.: Nat Rev Rheumatol 2010; 6: 693-702 9 Waki D et al.: Medicine 2020; 99: e19173 10McGregor JG et al.: Clin J Am Soc Nephrol 2012; 7: 240-7 11 Walsh M et al.: N Engl J Med 2020; 382: 622-31 12 Pepper RJ et al.: Rheumatology 2019; 58: 260-8 13 Farrah TE et al.: Nephrol Dial Transplant 2021 29; 36: 739-42 14 Jayne DRW; ADVOCATE Study Group:N Engl J Med 2021; 384: 599-609 15 Cortazar FB; ADVOCATE Study Group: Kidney Int Rep 2023; 8: 860-70 16 Stone JH et al.: Semin Arthritis Rheum 2022; 55: 152010 17 van Leeuwen JR et al.: Drug Des Devel Ther 2025; 19: 23-37
Das könnte Sie auch interessieren:
Nouvelle option thérapeutique: zanubrutinib plus obinutuzumab
Le traitement combiné par zanubrutinib plus obinutuzumab promet de bons résultats dans le traitement du lymphome folliculaire. Il a fait l’objet de l’étude ROSEWOOD, qui est présentée ...
Points forts du congrès de l’ASH sur la LMA: les inhibiteurs de la ménine sont prometteurs
Lors du dernier congrès annuel de l’American Society of Hematology (ASH), d’innombrables données d’études passionnantes et porteuses d’espoir sur la leucémie myéloïde aiguë (LMA) ont été ...
Mise à jour lors de l’APCCC 2024
Depuis 2015, la Prof. Dre méd. Silke Gillessen et le PD Dr méd. Aurelius Omlin organisent tous les deux ans une conférence de consensus sur le cancer de la prostate avancé (APCCC) en ...