Nouvelle option thérapeutique: zanubrutinib plus obinutuzumab
Auteure:
PD Dre méd. Karin Hohloch
Fachärztin für Medizinische Onkologie, Hämatologie und Allgemeine Innere Medizin
Klinik für Hämatologie und Onkologie Hirslanden Zürich
E-mail: karin.hohloch@kho.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le traitement combiné par zanubrutinib plus obinutuzumab promet de bons résultats dans le traitement du lymphome folliculaire. Il a fait l’objet de l’étude ROSEWOOD, qui est présentée dans l’article suivant.
Le lymphome folliculaire (LF) est le deuxième lymphome non hodgkinien (LNH) le plus fréquent et représente environ 5% de toutes les néoplasies hématologiques.1 Dans les pays occidentaux, le taux d’incidence standardisé selon l’âge est de deux à quatre cas de LF pour 100000 personnes par an.
Les développements dans le traitement du LF, notamment l’introduction des anticorps (AC) anti-CD20 et plus récemment le traitement par cellules CAR-T et les AC bispécifiques, ont permis d’améliorer significativement le taux de survie.2–4 Malgré d’importants progrès réalisés dans le traitement, le lymphome folliculaire reste cependant une maladie incurable avec des récidives continues et des intervalles sans maladie plus courts au cours de l’évolution.
Environ 80% de l’ensemble des patient·es présentent une évolution indolente avec une espérance de vie presque normale, 20% présentent une évolution agressive ainsi que des récidives précoces et fréquentes, et décèdent le plus souvent du lymphome.3 L’hétérogénéité clinique de la maladie représente un défi pour trouver le traitement approprié au moment opportun en tenant compte de l’âge, des comorbidités et de la probabilité de récidive.4
Étude ROSEWOOD
L’étude ROSEWOOD5 a évalué l’efficacité et la sécurité du traitement combiné par zanubrutinib plus obinutuzumab (ZO) par rapport à l’obinutuzumab (O) en monothérapie chez des patient·es atteint·es de lymphome folliculaire en rechute ou réfractaire (r/r) et ayant reçu au moins deux lignes de traitement antérieures.
Elle visait à développer de nouvelles options thérapeutiques pour les patient·es chez qui les traitements de référence ne sont plus efficaces en raison de rechutes ou de résistances.
Conception de l’étude et méthodologie
217 patient·es atteint·es de LF r/r, avec un statut de performance ECOG de 0–2 (grade1–3a) et ayant reçu ≥2 lignes de traitement antérieures ainsi qu’un AC anti-CD20, ont été randomisé·es selon le ratio 2:1 dans une étude de phaseII.
Dans ce cadre, 145 patient·es ont reçu ZO et 72 O. Dans les deux bras, l’obinutuzumab a été administré à la dose de 1000mg les jours 1, 8 et 15 du cycle 1 ainsi que le jour 1 des cycles 2 à 6, puis 1 fois toutes les huit semaines en traitement d’entretien (20 perfusions, traitement d’entretien sur 2 ans). Dans le bras sous traitement combiné, le zanubrutinib a été administré 2 fois par jour à la dose de 160mg.
Le critère d’évaluation primaire était le taux de réponse globale (ORR), déterminé par TEP-TDM. Les critères d’évaluation secondaires étaient la durée de la réponse (DOR), la survie sans progression (PFS) et la survie globale (OS).
Résultats
Le critère d’évaluation primaire de l’étude (ORR) a été atteint. Après une durée de suivi moyenne de 20,2 mois, le traitement combiné par ZO a révélé un ORR significativement plus élevé (69%) par rapport à la monothérapie par O (46%). Le taux de rémissions complètes (CR) était de 39% dans le groupe sous ZO et de 19% dans le groupe sous monothérapie.
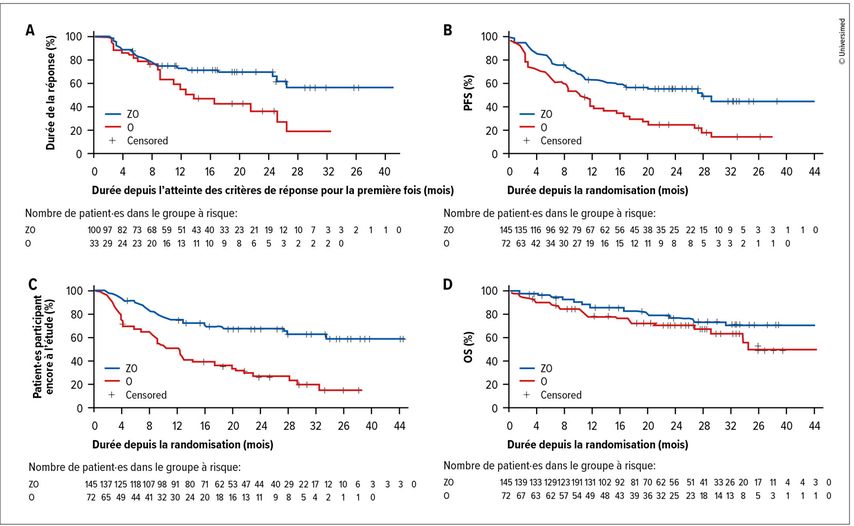
Les critères d’évaluation secondaires (DOR, PFS, OS) ont également été atteints (Fig. 1). La DOR n’était pas encore atteinte dans le bras sous ZO, alors qu’elle était de 14 mois en médiane dans le bras sous O. La PFS médiane était de 28,0 mois sous ZO par rapport à 10,4 mois sous O, ce qui indique une nette amélioration de l’efficacité du traitement combiné. Le délai jusqu’au prochain traitement (TTNT) n’a pas encore pu être évalué sous ZO et était de 14 mois dans le bras sous O. L’OS à 24 mois était de 77% sous ZO par rapport à 71% sous O.
Fig. 1: Durée de la réponse (DOR), survie sans progression (PFS), délai jusqu’au prochain traitement (TTNT) et survie globale (OS) dans l’étude ROSEWOOD, sous zanubrutinib plus obinutuzumab (ZO) par rapport à sous obinutuzumab (modifiée selon Zinzani PL et al.).5 A: DOR médiane pas encore atteinte sous ZO, DOR médiane sous O: 14 mois. B: La PFS médiane était significativement prolongée sous ZO (courbe bleue; 28,0 mois; IC à 95%: 16,1–NE) par rapport à sous O (courbe rouge; 10,4 mois; IC à 95%: 6,5–13,8); HR: 0,50 (IC à 95%: 0,33–0,75; p<0,001). C: TTNT sous ZO: pas encore évaluable, TTNT sous O: 12,2 mois. D: OS à 24 mois de 77% sous ZO par rapport à 71% sous O.
En cas de progression sous O, les patient·es pouvaient toutefois passer dans le bras sous ZO (changement de traitement: 34 patient·es).
Sécurité et tolérance
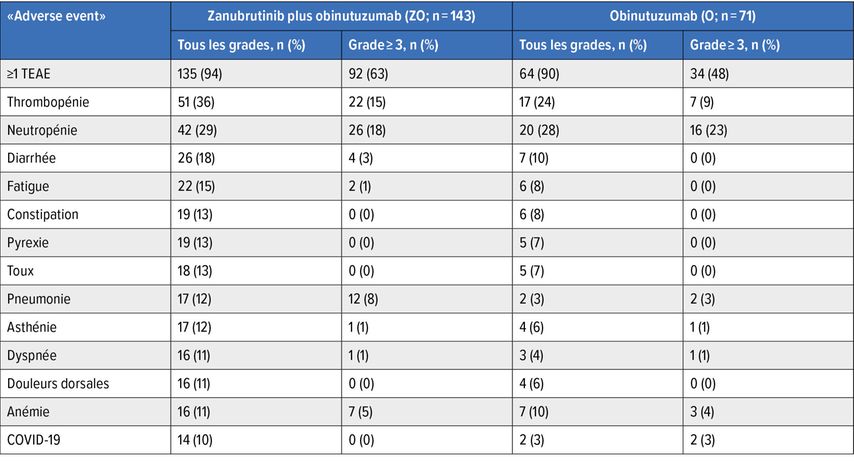
Les effets secondaires du traitement combiné par ZO étaient maîtrisables et correspondaient au profil de sécurité attendu des différents médicaments. Les effets secondaires les plus fréquents sous ZO étaient la thrombopénie, la neutropénie, la diarrhée et la fatigue. Des effets secondaires sévères (grade≥3) sont survenus chez 63% des patient·es dans le groupe sous ZO et chez 48% dans le groupe sous O (Tab. 1). Les infections étaient numériquement plus élevées dans le bras sous traitement combiné par rapport au bras sous monothérapie par O.
Tab. 1: Toxicités. Le taux d’effets secondaires sévères ≥3 était plus élevé sous ZO que sous O (63 par rapport à 48%). Les thrombopénies et les pneumonies sévères ainsi que la diarrhée et la dyspnée étaient plus fréquentes sous ZO, alors que la pyrexie (13 par rapport à 20%) et les réactions liées à la perfusion (3 par rapport à 10%) étaient plus fréquentes sous monothérapie par l’obinutuzumab. La neutropénie de grade≥3 (24 par rapport à 23%) et l’anémie (5 par rapport à 6%) étaient similaires dans les deux groupes. Au total, 20 et 21% des patient·es sous ZO ont reçu du G-CSF, 3 et 4% ont reçu ≥1 concentré érythrocytaire, 6 et 3% ont reçu ≥1 concentré plaquettaire.
La durée du traitement dans le bras sous ZO était toutefois presque deux fois plus longue que dans le bras sous monothérapie par O (12,2 par rapport à 6,5 mois), de sorte que, par rapport à la durée du traitement, le risque d’infection était comparable dans les deux bras.
Les effets secondaires d’intérêt particulier sous inhibiteurs de la BTK étaient les hémorragies et les arythmies. Des hémorragies sont survenues chez 28% des patient·es sous ZO et chez 13% des patient·es sous O. Des hémorragies sévères sont survenues chez deux patient·es dans chacun des deux groupes. Une fibrillation auriculaire (FA) s’est produite chez 3% des patient·es dans le bras sous ZO et 1% dans le bras sous monothérapie par O; un patient du bras sous ZO a présenté une FA de grade≥3.
Conclusion
L’étude ROSEWOOD a révélé que le traitement combiné par zanubrutinib plus obinutuzumab chez les patient·es atteint·es de LF r/r est une option thérapeutique prometteuse qui offre des taux de réponse significativement plus élevés et une survie sans progression prolongée par rapport aux traitements disponibles jusqu’à présent à partir de la troisième ligne (à l’exception du traitement par cellules CAR-T et de celui par AC bispécifiques). Le profil de sécurité du traitement combiné était acceptable et le traitement était bien toléré.
Le choix de l’obinutuzumab en monothérapie comme bras de comparaison, qui n’est pas autorisé ou établi dans cette indication, est inhabituel et a été fait pour permettre une meilleure comparabilité entre les deux bras. Une autre raison était que nombre de patient·es avaient déjà reçu le rituximab lors de traitements antérieurs ou étaient réfractaires au rituximab (53%).
Pour déterminer le positionnement de ZO dans l’algorithme thérapeutique du lymphome folliculaire, une comparaison avec d’autres combinaisons très efficaces est nécessaire. L’étude de phaseIII MAHOGANY (ZO par rapport à R2) est actuellement menée à cet effet (ClinicalTrials.gov identifier: NCT05100862).
Toutefois, des options thérapeutiques supplémentaires autorisées et très efficaces sont d’ores et déjà disponibles à partir de la troisième ligne de traitement pour les patient·es atteint·es de LF r/r, par exemple R2, l’AC bispécifique mosunetuzumab, le traitement par cellules CAR-T Tisa-cel ainsi qu’une greffe allogénique de cellules souches qui sera probablement de moins en moins utilisée à l’avenir.
Littérature:
1 Carbone A et al.: Follicular lymphoma. Nat Rev Dis Primers 2019; 5(1): 83 2 Salles G, Ghesquières H: Current and future management of follicular lymphoma. Int J Hematol 2012; 96(5): 544-51 3 Sarkozy C et al.: Cause of death in follicular lymphoma in the first decade of the rituximab era: a pooled analysis of French and US cohorts. J Clin Oncol 2019; 37(2): 144 4 Zinzani PL et al.: Current and future therapies for follicular lymphoma. Exp Hematol Oncol 2024; 13(1): 87 5 Zinzani PL et al.: ROSEWOOD: a phase II randomized study of zanubrutinib plus obinutuzumab versus obinutuzumab monotherapy in patients with relapsed or refractory follicular lymphoma. J Clin Oncol 2023; 41(33): 5107-17
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...