Nouveaux dispositifs et thérapie génique
Compte-rendu:
Reno Barth, Journaliste médical
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lors du congrès européen sur l’insuffisance cardiaque Heart Failure 2025, des études s et des mises à jour d’études ont été présentées, fournissant des données sur un dispositif innovant de surveillance de l’insuffisance cardiaque ainsi que sur la première thérapie génique dans l’amylose à transthyrétine avec cardiomyopathie.
Keypoints
-
L’arrêt de l’antagoniste du récepteur des minéralocorticoïdes (ARM) augmente directement le risque d’événements CV, y compris les décès d’origine CV.
-
L’ARM et les iSGLT2 sont plus efficaces lorsqu’ils sont combinés.
-
Un capteur implanté dans la veine cave inférieure détecte une congestion.
-
La première thérapie génique dans l’amylose à transthyrétine a fait l’objet d’une étude de phase I.
-
Le vutrisiran a également fait ses preuves dans de nouvelles analyses de l’étude d’autorisation.
L’étude complémentaire randomisée en aveugle menée dans le cadre de l’étude de phase III FINEARTS-HF suggère qu’il est préférable de ne pas arrêter l’antagoniste du récepteur des minéralocorticoïdes (ARM) non stéroïdien finérénone après un traitement prolongé. L’étude FINEARTS-HF, présentée pour la première fois lors du congrès 2024 de l’ESC, a révélé que la finérénone réduisait en médiane significativement le critère d’évaluation primaire combiné (tous types d’événements d’insuffisance cardiaque ainsi que de décès d’origine cardiovasculaire [CV]) à 32 mois par rapport au placebo (RR: 0,84; IC à 95%: 0,74–0,95; p=0,007) chez les personnes atteintes d’insuffisance cardiaque et présentant une fraction d’éjection ventriculaire gauche préservée ou légèrement réduite (HFpEF et HFmrEF, FEVG ≥40%). La mortalité CV a été numériquement réduite dans le groupe sous finérénone, mais pas significativement. Les résultats primaires étaient cohérents à travers tous les sous-groupes prédéfinis et indépendants de la FEVG ainsi que du traitement antérieur par des iSGLT2. Des hyperkaliémies avec un taux de potassium >6,0mmol/l sont survenues chez 86 personnes (3,0%) dans le groupe sous finérénone et 41 personnes (1,4%) dans le groupe sous placebo. Aucune hyperkaliémie fatale n’a été observée. La qualité de vie s’est également améliorée sous finérénone.1
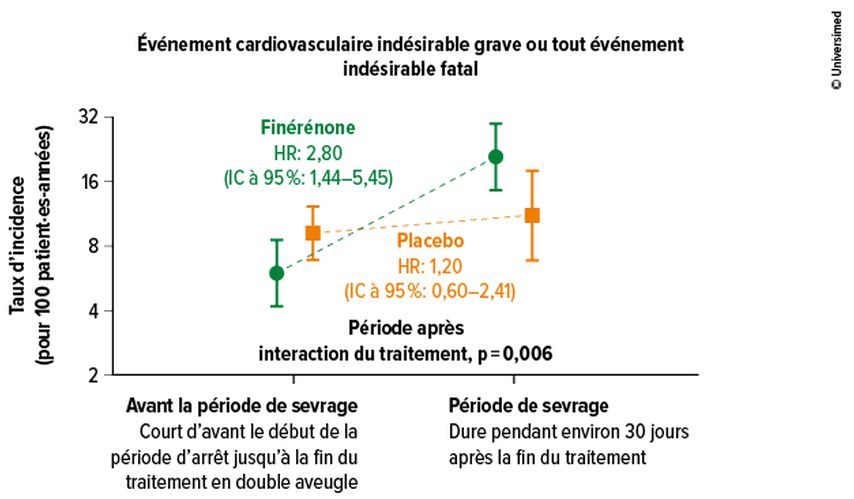
La conception de FINEARTS-HF prévoyait une phase d’arrêt en aveugle après la fin de la phase d’étude en double aveugle, suivie d’une nouvelle évaluation après 30 jours en moyenne. Les résultats de cette tentative d’arrêt ont été présentés dans le cadre du congrès européen Heart Failure 2025: «L’objectif de cette approche était de déterminer ce qui se passe lorsque les patient·es arrêtent le traitement à l’étude», a déclaré Muthiah Vaduganathan, Brigham and Women’s Hospital et Harvard Medical School, Boston, États-Unis.
Ces résultats suggèrent que l’arrêt de l’ARM ne constitue pas une stratégie pertinente. Alors qu’aucune augmentation significative du nombre d’événements CV, y compris des décès d’origine CV, n’a été constatée dans le groupe sous placebo, ils ont été multipliés par 2,8 après l’arrêt de la finérénone. Le taux d’événements était donc plus faible dans le groupe sous placebo par rapport au groupe sous traitement actif après l’arrêt (Fig.1).2 Des effets d’arrêt similaires, bien que moins prononcés, ont été rapportés sous iSGLT2. «Les données corroborent la position des directives», a déclaré M. Vaduganathan. Celles-ci exigent la prise permanente de traitements d’entretien en cas d’insuffisance cardiaque. L’étude sera publiée prochainement dans le journal de l’American College of Cardiology. Lors de la discussion des résultats, Maria Rosa Costanzo, Midwest Cardiovascular Institute, Naperville, États-Unis, a souligné l’importance des études d’arrêt, qui fournissent des informations importantes pour l’utilisation de nouveaux médicaments dans la pratique clinique quotidienne ainsi que pour l’élaboration des directives.
Traitement combiné par un iSGLT2 et un ARM testé de manière contrôlée
L’étude académique SOGALDI-PEF, dont les résultats ont été présentés par Joao Pedro Ferreira, Université de Porto, Portugal, dans le cadre du congrès Heart Failure 2025, a examiné les effets d’un traitement combiné par un ARM et un iSGLT2 dans un groupe de patient·es atteint·es d’HFpEF ou d’HFmrEF par rapport à un iSGLT2 en monothérapie. L’étude a porté sur l’association dapagliflozine plus spironolactone par rapport à la dapagliflozine en monothérapie pendant 12 semaines. Un troisième bras initialement prévu sous spironolactone en monothérapie a été interrompu au vu des études de phase III comme EMPEROR-Preserved et DELIVER, car il n’était plus acceptable sur le plan éthique de priver les patient·es atteint·es d’insuffisance cardiaque d’un iSGLT2. L’étude a porté sur une population multimorbide. Plus de 40% des patient·es souffraient d’une maladie rénale chronique et plus de 50% de fibrillation auriculaire. L’âge moyen était de 76 ans.
Le traitement combiné a entraîné une réduction du NT-proBNP (de 11%) plus importante que celle observée sous la dapagliflozine en monothérapie. La proportion de patient·es ayant obtenu une réduction d’au moins 20% du NT-proBNP a plus que doublé dans le bras sous traitement combiné par rapport au bras sous dapagliflozine en monothérapie. Cela s’est fait au prix d’une augmentation plus importante du taux de potassium sous traitement combiné. Une baisse de la pression artérielle systolique en dessous de 100mmHg ou une réduction du DFGe d’au moins 40% se sont également produites plus fréquemment sous traitement combiné.3
Surveillance cardiaque au moyen d’un capteur implanté dans la veine cave inférieure
Des données sur un nouveau dispositif (FIRE1) destiné à améliorer la prise en charge de l’insuffisance cardiaque ont été présentées par Kevin Damman, University Medical Center, Groningen, Pays-Bas, avec l’étude FUTURE-HF.4 La sécurité à long terme, la précision des mesures et le bénéfice clinique d’un capteur implantable dans la veine cave inférieure (VCI) pour la surveillance ambulatoire à distance ont été étudiées. Le capteur mesure les changements de la veine cave, qui peuvent être considérés comme un paramètre de substitution de la congestion. Ces paramètres sont nécessaires, car une augmentation du volume n’est pas nécessairement corrélée à une augmentation immédiate de la pression. «Le système vasculaire compense les changements de volume afin de stabiliser la précharge du cœur dans les limites physiologiques», explique M. Damman.
Le capteur utilisé dans l’étude FUTURE-HF mesure l’aire ainsi que la collapsibilité de la VCI. Il est positionné sous les veines hépatiques et transmet sans fil les données de la VCI en continu pour une surveillance à distance des patient·es. Les changements structurels de la VCI peuvent être utilisés comme indicateurs précoces d’une surcharge de volume, en tant que mesures de pression isolées. «Sur la base de ces mesures, il sera possible à l’avenir de réagir à une détérioration de la situation clinique avant qu’une décompensation ne survienne», explique M. Damman.
Un total de 65 adultes hospitalisés pour insuffisance cardiaque au cours de l’année précédente et présentant des taux élevés de NT-proBNP, bien que sous traitement médicamenteux optimal, ont été inclus dans 18 centres. Tou·tes les patient·es de l’étude se sont fait implanter le capteur lors d’une intervention ambulatoire. Les données ont été lues par les patient·es, l’équipe de l’étude ayant accès aux données du capteur via un système basé sur le cloud.
L’implantation et le transfert des données ont été couronnés de succès chez l’ensemble des patient·es, sans aucun événement indésirable grave lié au dispositif ou à l’intervention. Le capteur a démontré une précision de mesure élevée et constante après 12 mois, sans étalonnage supplémentaire, en utilisant des valeurs mesurées par TDM comme référence. Les modifications des paramètres mesurés ont été suivies d’un ajustement du traitement médicamenteux. Cela a entraîné des améliorations cliniques significatives. 50% des patient·es ont ainsi obtenu une amélioration de leur classe NYHA et le taux médian de NT-proBNP a diminué de 1697ng/l (1144–2613) au début de l’étude jusqu’à 989ng/l (718–2073) après 12 mois. Cela s’est accompagné d’une réduction de 75% du nombre d’événements cliniques par rapport à l’année précédant l’inclusion dans l’étude.
Le signal de la VCI peut devenir anormal environ 90 jours avant un épisode d’insuffisance cardiaque et se normaliser après une adaptation réussie du traitement.4 Dans une prochaine étape de développement, une application pour smartphone sera utilisée pour la surveillance des données, afin d’aider les patient·es à s’autogérer sous surveillance médicale.
Amylose à transthyrétine: première thérapie génique basée sur CRISPR-Cas9
Marianna Fontana, University College London, Grande-Bretagne, a présenté une approche radicale dans le traitement de l’amylose à transthyrétine avec cardiomyopathie (ATTR-CM). Dans le cas de l’ATTR-CM, un mauvais repliement de la molécule de transport transthyrétine (TTR) entraîne le dépôt de fibrilles amyloïdes TTR dans le myocarde. Les approches thérapeutiques actuelles reposent sur la stabilisation de la TTR ou sur l’inhibition de la synthèse de la TTR dans le foie. Cette dernière a été tentée au moyen d’une thérapie génique basée sur CRISPR-Cas9, qui inactive de manière ciblée le gène TTR et doit ainsi empêcher à long terme la synthèse de la transthyrétine dans le foie. Le médicament de thérapie génique nexiguran ziclumeran (nex-z) a été étudié dans le cadre d’une étude de phase I5 dans une population mixte de 36 patient·es atteint·es des formes héréditaire (ATTRv-CM) et sauvage (ATTRwt-CM). Tou·tes les patient·es ont reçu une perfusion intraveineuse unique de nex-z (0,7 ou 1,0mg/kg ou 55mg en dose fixe). Le critère d’évaluation primaire de l’étude était la variation de la concentration sérique de TTR. Différents paramètres cliniques tels que le NT-proBNP, la TnT hs, la distance parcourue au test de marche de 6 minutes (6MWT), le score total du KCCQ ainsi que la classe NYHA ont été relevés comme critères d’évaluation secondaires, et la durée de suivi était d’au moins 12 mois. 97% étaient des hommes, la moitié souffraient d’insuffisance cardiaque avancée de classe NYHA III. En revanche, la classe NYHA IV constituait un critère d’exclusion.
Le traitement par nex-z s’est avéré très efficace, entraînant une baisse du taux de TTR de 93% pour la forme ATTRwt et de 85% pour la forme ATTRv en l’espace de 12 mois. Les valeurs obtenues sont restées stables pendant deux ans. Sur le plan clinique, des signes de stabilisation de la maladie ont été observés, avec des taux de NT-proBNP, de TnT-hs et des résultats au 6MWT inchangés. La classe NYHA s’est stabilisée ou améliorée chez 88% des personnes atteintes d’ATTRwt et chez 100% de ceux atteintes d’ATTRv. La qualité de vie s’est améliorée de manière cliniquement significative et la tolérance au traitement était bonne.5 Des réactions à la perfusion sont survenues chez 14% des patient·es, mais elles étaient généralement légères et transitoires. Une étude de phase III portant sur nex-z est en cours, sur la base de laquelle une autorisation pourrait être obtenue.
Plus de données sur le vutrisiran: efficacité et tolérance confirmées
Le «small interfering RNA» vutrisiran est déjà autorisé dans l’indication d’ATTR-CM. L’étude internationale de phase III HELIOS-B, multicentrique, en double aveugle, randomisée, contrôlée par placebo portant sur ce médicament a mis en évidence une réduction significative du risque concernant le critère d’évaluation primaire (mortalité globale, événements CV répétés) sur une période de 42 mois par rapport au placebo. La qualité de vie s’est également stabilisée sous vutrisiran, alors qu’elle a diminué progressivement sous placebo.6
Dans le cadre du congrès Heart Failure 2025, de nouvelles analyses et données issues du collectif HELIOS-B ont été présentées. Elles sont concrètement tirées du suivi d’autres patient·es sur 42 mois en ce qui concerne la mortalité CV et la mortalité globale ainsi que l’incidence des événements CV sur 36 mois. À la date de limite en novembre 2024, 96,3% des patient·es de l’étude disposaient de données sur 42 mois. Les données actuelles corroborent les résultats publiés de l’évaluation primaire. Sur une période de 42 mois, le vutrisiran a diminué la mortalité globale de 36% dans l’ensemble de la population de l’étude et de 42% dans la population sous monothérapie. La mortalité CV a été réduite d’environ un tiers dans les deux populations. Les hospitalisations pour insuffisance cardiaque étaient également significativement moins fréquentes sous vutrisiran.7
Source:
Heart Failure congrss, du 17 au 20 mai 2025, à Belgrade
Littérature:
1 Solomon SD et al.: N Engl J Med 2024; 391: 1475-85 2 Vagunathan M et al.: Blinded withdrawal of Finerenon after long term treatment in FINEARTS-HF. HeartFailure Congress 20253 Ferreira JP et al.: SOdium-Glucose cotransporter 2 inhibitor with and without an ALDosterone AntagonIst for heart failure with preserved ejection fraction. SOGALDIPEF trial. Heart Failure Congress 2025 4 Damman K et al.: Long-term safety, accuracy, and utility of a novel implantable IVC sensor for remote HF management. The FUTURE-HF study portfolio: 12 months.Heart Failure Congress 2025 5 Fontana M et al.: CRISPR gene editing with nexiguran ziclumeran in ATTR cardiomyopathy: treatment effect in hereditary vs. wild-type disease. Präsentiert auf dem Heart Failure Congress 2025 6 Fontana M et al.: N Engl J Med 2025; 392: 33-44 7 Witteles R et al.: Vutrisiran reduces all-cause mortality, cardiovascular mortality and cardiovascular events in patients with transthyretin amyloid cardiomyopathy: analysis from the HELIOS-B trial. Heart Failure Congress 2025
Das könnte Sie auch interessieren:
Tumeurs du foie et des voies biliaires
Les lésions hépatiques focales sont souvent détectées lors d’examens par TDM, IRM ou échographie, non seulement en gastroentérologie et en hépatologie, mais aussi en médecine interne et ...
Les médicaments biologiques dans le traitement de l’asthme
À quoi faut-il faire attention dans le cadre d’une biothérapie chez les asthmatiques? Quand faut-il la commencer et combien de temps faut-il la poursuivre? Le Pr Dr méd. Christian ...
Comorbidités dans la BPCO
Les patient·es atteint·es de BPCO souffrent souvent de diverses comorbidités qui peuvent avoir une influence négative sur l’évolution de la maladie, indépendamment de la sévérité de la BPCO.1 C’était le thème de la présentation du Dr méd. Thomas Sigrist, chef du département de médecine interne, médecin-chef de pneumologie, Clinique Barmelweid, à Barmelweid.