Mise à jour de la gestion du traitement de l’infection à Helicobacter pylori
Auteur:
Pr Dr méd. Dres. h.c. Peter Malfertheiner1,2
1Ehemaliger Direktor der Klinik für Gastroenterologie, Hepatologie und Infektiologie
Otto-von-Guericke Universität Magdeburg
2Medizinische Klinik II
LMU Klinikum, München
E-mail: peter.malfertheiner@med.ovgu.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’infection à H.pylori est un point de départ décisif pour le développement d’un cancer de l’estomac. Cette évolution peut être évitée par une éradication précoce de H.pylori, raison pour laquelle des stratégies de prévention «screen/test and treat» pour H.pylori sont recommandées dans le monde entier. L’augmentation de la résistance aux antibiotiques, qui n’épargne pas H.pylori, constitue un problème pour le traitement.
Les données épidémiologiques actuelles montrent que plus de 40% de la population mondiale est touchée par une infection à H.pylori. Contrairement à ce que l’on pourrait penser, l’infection à H.pylori continue d’être fréquemment détectée chez les enfants et les adolescents, en particulier chez les enfants originaires de pays où les normes d’hygiène sont limitées.1
L’indication de traitement de l’infection à H.pylori a connu un changement de paradigme décisif depuis que la gastrite à H.pylori a été définie comme une maladie infectieuse dans le consensus de Kyoto et qu’elle a été intégrée comme entité nosologique autonome dans la dernière «Classification internationale des maladies» (CIM 11).2
Indications de traitement en présence de H.pylori
En cas de détection de H.pylori, il y a toujours une indication de traitement, même en l’absence de symptômes cliniquement perceptibles à ce moment-là. Le raisonnement sous-jacent est que la gastrite à H.pylori s’accompagne de modifications structurelles de la muqueuse gastrique et d’effets sur la physiologie gastrique, et qu’elle constitue un point de départ potentiel de complications telles que l’ulcère peptique et le cancer de l’estomac.3
Il existe un certain nombre d’indications cliniques pour lesquelles la détection de H.pylori est indispensable et bien établie dans la pratique clinique (Fig. 1).
Fig. 1: Indications de traitement de l’infection à H.pylori ou risques supplémentaires de comorbidité
Prévention du cancer de l’estomac
La stratégie «screen and treat» pour H.pylori dans la prévention du cancer de l’estomac revêt une importance particulière et fait l’objet d’efforts mondiaux.
On sait que la gastrite à H.pylori est un point de départ essentiel de l’apparition d’un cancer de l’estomac dans 90% des cas. Une série d’autres facteurs jouent certes un rôle favorisant la carcinogenèse gastrique, mais ils revêtent une importance secondaire. Il convient de mentionner la virulence accrue de certaines souches de H.pylori, les facteurs génétiques familiaux prédisposants et les facteurs environnementaux, y compris les habitudes alimentaires et le mode de vie. Le risque de cancer de l’estomac augmente avec l’âge.3–5
La progression de la gastrite à H.pylori vers le développement potentiel d’un cancer de l’estomac permet de stopper le processus malin en éradiquant H.pylori. Cette mesure est plus efficace avant l’évolution de la gastrite à H.pylori vers une gastrite atrophique de stade avancé.5–7
Chez les patient·es souffrant déjà d’une gastrite atrophique sévère avec métaplasie intestinale, un risque résiduel plus ou moins élevé de développement d’un cancer de l’estomac subsiste, même après une éradication réussie de H.pylori, et nécessite pour cette raison une surveillance endoscopique et histologique régulière. Cela reste indispensable même chez les patient·es ayant subi une résection endoscopique d’un cancer de l’estomac précoce.3,5,8
Les stratégies de prévention «screen/test and treat» pour H.pylori doivent tenir compte de différents aspects et scénarios cliniques. Les personnes ayant des antécédents familiaux de cancer de l’estomac présentent un risque accru supplémentaire et un test de dépistage de H.pylori est fortement recommandé. Les consensus internationaux recommandent un dépistage généralisé de H.pylori, y compris chez les personnes asymptomatiques vivant dans des régions à forte incidence de cancer de l’estomac.3,5 Les réflexions sur l’intégration du dépistage de H.pylori dans les mesures de prévention générales sont de plus en plus prises en compte. Une option possible et également avantageuse pour le dépistage du cancer de l’estomac est le test de dépistage de H.pylori dans le cadre du dépistage du cancer colorectal.3
Différentes méthodes diagnostiques sont envisagées pour la stratégie de prévention «screen and treat» pour H.pylori. En principe, les méthodes de détection directe non invasives (test respiratoire à l’urée [UBT], test d’antigène dans les selles) sont privilégiées aux méthodes basées sur l’endoscopie. Des tests sérologiques peuvent également être utilisés, mais l’une des méthodes de détection directe susmentionnées doit être employée pour confirmer une infection H.pylori existante avant un traitement d’éradication si des anticorps anti-H.pylori ont été détectés. Dans le cas de constellations de risques spécifiques chez les patient·es asymptomatiques, l’endoscopie reste également indispensable pour la prévention.3,5
Le défi de la résistance aux antibiotiques
Dans le traitement de l’infection à H.pylori, le défi particulier réside dans l’augmentation constante de la résistance aux antibiotiques qui se dessine depuis de nombreuses années et qui concerne notamment deux des antibiotiques les plus puissants: la clarithromycine et la lévofloxacine. En 2017, l’OMS a inclus les souches de H.pylori résistantes à la clarithromycine dans la liste des agents pathogènes prioritaires résistants aux antibiotiques.9 Une méta-analyse portant sur 248 études a révélé un taux de résistance primaire à la clarithromycine de 27% à l’échelle mondiale.10 En Europe, des études ont été menées tous les 10 ans, la dernière en 2018, et ont mis en évidence des taux de résistance primaire à H.pylori de 21,4% pour la clarithromycine, de 15,8% pour la lévofloxacine et de 38,9% pour le métronidazole.11 D’autres données comparables sur la résistance aux antibiotiques proviennent du registre européen de gestion de H.pylori (Hp-EuReg).12,13 De ces chiffres découle la recommandation évidente de la réalisation d’un test de résistance aux antibiotiques (TRA) avant d’initier des traitements à base de clarithromycine, de lévofloxacine et de métronidazole, en cas d’utilisation d’antibiotiques présentant un taux de résistance élevé. En raison des taux de résistance faibles, situés autour de 1% dans la plupart des pays européens, cette exigence ne s’applique pas à l’amoxicilline. Une analyse récente de l’évolution dans le temps de la résistance aux antibiotiques chez les enfants a démontré que la résistance à l’amoxicilline reste également faible et constante à l’échelle mondiale (4%).14
Le TRA peut être réalisé sur des cultures de H.pylori ou directement par des tests moléculaires sur des échantillons de muqueuse gastrique. On dispose à ce jour d’une expérience limitée en matière de tests moléculaires sur des échantillons de selles.15 Bien que le TAR deviendra à l’avenir une stratégie importante dans le choix des antibiotiques pour l’éradication de H.pylori, il reste pour l’instant peu utilisé dans la pratique clinique en raison de la complexité et de la rareté des cultures de H.pylori, ainsi que de la disponibilité réduite et des coûts des technologies de tests moléculaires, sans oublier les insuffisances de facturation.
Une attention particulière et croissante est accordée à l’établissement de l’«antibiotic stewardship» en relation avec la résistance aux antibiotiques de H.pylori. Idéalement, cela peut se faire en formant des équipes de gastroentérologues, de microbiologistes et de pharmacologues cliniques. Les tâches comprennent la pose d’un diagnostic précis ainsi que l’utilisation correcte des antibiotiques et des médicaments concomitants. Le choix des antibiotiques repose sur les modèles de résistance aux antibiotiques ainsi que sur les connaissances thérapeutiques issues des études cliniques, en tenant compte de la posologie et du mode d’administration appropriés. L’état de santé général des patient·es, y compris l’adaptation des antibiotiques à la fonction hépatique et rénale, ainsi que les interactions potentielles avec d’autres médicaments doivent être pris en compte dans le concept thérapeutique. Une durée de prise optimale contribue à limiter le développement de la résistance, à minimiser les effets secondaires et à améliorer l’observance des patient·es.15
Recommandations thérapeutiques dans la pratique
Aujourd’hui, le consensus international recommande la quadrithérapie à base de bismuth en première intention pour l’éradication de H.pylori.3,16 À cet effet, les patient·es prennent pendant 10 jours un inhibiteur de la pompe à protons (IPP; p.ex. oméprazole) et une préparation associant sel de bismuth, tétracycline et métronidazole (Pylera®). En cas de prise correcte, le succès thérapeutique est de 90%. Dans certains endroits, les composants du traitement à base de bismuth sont uniquement disponibles en tant que substances individuelles, ce qui nécessite de prolonger la durée du traitement à 14 jours. La trithérapie à base d’IPP plus les deux antibiotiques clarithromycine et amoxicilline reste une alternative en première intention, mais son utilisation doit être soumise à l’une des conditions suivantes: il convient a) d’exclure la résistance à la clarithromycine chez chaque patient·e ou b) de choisir l’approche empirique incluant la surveillance de la résistance aux antibiotiques dans une communauté régionale, qui ne doit pas dépasser un taux de résistance de 15% pour la clarithromycine.3 L’évolution de la résistance aux antibiotiques doit faire l’objet d’une surveillance continue à l’échelle régionale.
Lors de la prescription d’un traitement de l’infection à H.pylori, il est également utile de prendre en compte la prise antérieure des antibiotiques macrolides, quinolone et nitroimidazole. Les médicaments prescrits précédemment ne doivent pas être réutilisés de manière empirique. Le pays d’origine des patient·es doit également être pris en considération pour le choix du traitement d’éradication, en raison des différences de prévalence globale de H.pylori et de données sur la résistance aux antibiotiques.
Les trithérapies à base de lévofloxacine sont envisagées après l’échec des traitements de première intention, mais, en raison des données sur l’augmentation de la résistance, elles font l’objet d’une mise en garde supplémentaire et, le cas échéant, doivent uniquement être utilisées après avoir réalisé un TRA.
L’amoxicilline reste un antibiotique essentiel dans les traitements d’éradication et un composant fixe des trithérapies en raison de son taux de résistance quasi négligeable.
Les propriétés pharmacologiques et pharmacodynamiques de l’amoxicilline nécessitent une augmentation du pH gastrique jusqu’à une valeur aussi proche que possible de 6 afin d’obtenir un effet d’éradication maximal de H.pylori. Lorsque le pH gastrique augmente jusqu’à une valeur proche ou supérieure à 6, cela favorise la croissance de H.pylori et rend l’agent pathogène plus vulnérable pendant sa phase de croissance; en même temps, le pH élevé augmente la biodisponibilité et l’efficacité des antibiotiques dans l’estomac. Cela a également permis de poser les bases pour le développement des bithérapies. Le traitement par IPP plus amoxicilline à haute dose reste un traitement efficace pour l’éradication de H.pylori, même s’il ne trouve pas sa place en première intention.3,4,16
L’association de P-CAB («potassium-competitive acid blockers») et d’amoxicilline constitue une évolution de la bithérapie à base d’IPP plus amoxicilline. La suppression de la sécrétion d’acide plus prononcée de cette nouvelle classe de substances a conduit à un effet d’éradication plus élevé.17,18 Les P-CAB ne sont pas encore disponibles pour tous en Europe.
Des probiotiques sélectifs sont actuellement utilisés en complément du traitement de première intention à base d’antibiotiques et sont indiqués au cas par cas. Ils entraînent une réduction significative des effets secondaires, notamment gastro-intestinaux, dus au traitement de première intention de l’infection à H.pylori et peuvent ainsi contribuer à un effet d’éradication légèrement supérieur en raison de l’amélioration possible de l’observance.3,4 Des études sont en cours pour évaluer le potentiel des probiotiques à devenir à l’avenir un traitement de l’infection à H.pylori. Sous le slogan «microbial fighters» en tant qu’alternative aux antibiotiques, les probiotiques sélectifs peuvent s’appuyer sur de multiples fonctions, telles que le renforcement du système immunitaire, l’inhibition de la colonisation et la sécrétion de bactériocines, pour lutter contre H.pylori dans son habitat, l’estomac humain.
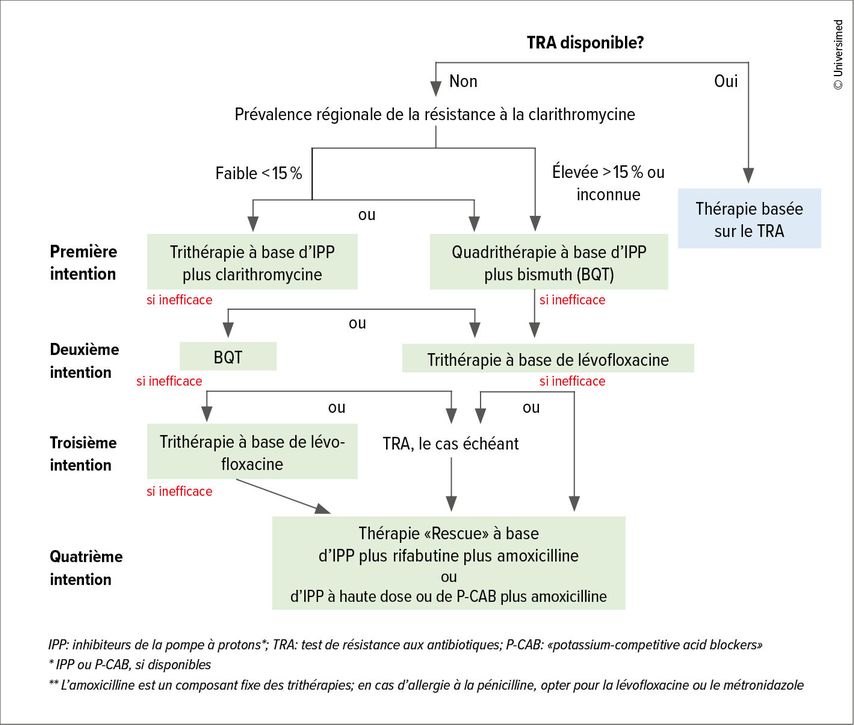
Il est recommandé d’effectuer un contrôle de l’efficacité du traitement 4 à 8 semaines après la fin du traitement chez chaque patient·e ayant subi une éradication de H.pylori. Le test respiratoire à l’urée 13C non invasif (ou le test d’antigène dans les selles) est privilégié, en tenant compte du fait que les IPP doivent être arrêtés au moins 2 semaines et les antibiotiques 4 semaines avant la réalisation du test. En cas d’échec du traitement de première intention, il est recommandé de procéder comme indiqué dans l’algorithme (Fig. 2).1
Fig. 2: Algorithme thérapeutique en cas d’infection à H.pylori (modifiée selon Malfertheiner et al. 2023)4
Littérature:
1 Chen YC et al.: Global prevalence of helicobacter pylori infection and incidence of gastric cancer between 1980 and 2022. Gastroenterol 2024; 166: 605-19 2 Sugano K et al.: Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015; 64: 1353-67 3 Malfertheiner P et al.; European Helicobacter and Microbiota Study group: Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022; gutjnl-2022-327745 4 Malfertheiner P et al.: Helicobacter pylori infection. Nat Rev Dis Primers 2023; 9: 19 5 Liou JM et al.: Screening and eradication of Helicobacter pylori for gastric cancer prevention: the Taipei global consensus. Gut 2020; 69: 2093-112 6 Rugge M et al.: RE.GA.IN.: the Real-world Gastritis Initiative-updating the updates. Gut 2024; 73: 407-41 7 Ford AC et al.: Helicobacter pylori eradication therapy to prevent gastric cancer: systematic review and meta-analysis. Gut 2020; 69: 2113-21 8 Dinis-Ribeiro M et al.: The road to a world-unified approach to the management of patients with gastric intestinal metaplasia: a review of current guidelines. Gut 2024; 73: 1607-17 9 World Health Organization: List of bacteria for which new antibiotics are urgently needed. 2017. http://www.who.int/mediacentre/news/releases/2017/bacteriaantibiotics-needed; zuletzt aufgerufen am 15.1.2025 10 Sholeh M et al.: The prevalence of clarithromycin-resistant Helicobacter pylori isolates: a systematic review and meta-analysis. Peer J 2023; 11: e15121 11 Megraud F et al.: Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut 2021; 70: 1815-22 12 Bujanda L et al.; The Hp-EuReg Investigators: Antibiotic resistance prevalence and trends in patients infected with Helicobacter pylori in the period 2013-2020: results of the European Registry on H. pylori Management (Hp-EuReg). Antibiotics 2021; 10: 1058 13 Bujanda L et al.: Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut 2021; 70: 1815-22 14 Salahi-Niri A et al.: Global prevalence of Helicobacter pylori antibiotic resistance among children in the world health organization regions between 2000 and 2023: a systematic review and meta-analysis. BMC Med 2024; 22: 598 15 Moss SF et al.: Evolving concepts in Helicobacter pylori management. Gastroenterol 2024; 166: 267-83 16 Chey WD et al.: ACG Clinical Guideline: Treatment of Helicobacter pylori infection. Am J Gastroenterol 2024; 119: 1730-53 17 Hu Y et al.: Effects of amoxicillin dosage on cure rate, gut microbiota, and antibiotic resistome in vonoprazan and amoxicillin dual therapy for Helicobacter pylori: a multicentre, open-label, non-inferiority randomised controlled trial. Lancet Microbe 2024; 100975 18 Jiang Y et al.: P-CAB versus PPI in the eradication of Helicobacter pylori: a systematic review and network meta-analysis. Therap Adv Gastroenterol 2024; 17: 17562848241241223
Das könnte Sie auch interessieren:
L’influence de l’environnement et de la génétique sur l’indice de masse corporelle
Le PD Dr méd. Stefan Bilz, clinique d’endocrinologie, de diabétologie, d’ostéologie et des maladies métaboliques, Hôpital cantonal de Saint-Gall, HOCH Health Ostschweiz, a mis en lumière ...
Utilisation pertinente des GLP-1-RA dans le traitement de l’obésité
Le Pr Dr méd. Bernd Schultes, Centre du métabolisme de Saint-Gall, a abordé les agonistes des récepteurs au GLP-1 (GLP-1-RA) dans le traitement de l’obésité lors de sa présentation au ...
Mise à jour 2025 de l’ECCO
Le congrès 2025 de l’European Crohn’s and Colitis Organisation (ECCO) s’est tenu à Berlin du 19 au 22 février, sous le thème «Durabilité dans les maladies inflammatoires chroniques de l’ ...