CAR-T-Zellen und BiTEs: neue Ansätze in der Therapie der rheumatoiden Arthritis
Bericht:
Reno Barth
Ungeachtet der grossen therapeutischen Erfolge, die seit der Jahrtausendwende in der Behandlung der rheumatoiden Arthritis erzielt werden konnten, ist die Erkrankung nach wie vor unheilbar und mit hohem Leidensdruck sowie hohen Kosten assoziiert. Fortschritte und alternative Ansätze sowohl in der Prävention als auch in der Therapie zeichnen sich jedoch ab.
Präventionsstudien
Nahrungsergänzungsmittel
Im Bereich der Primärprävention der rheumatoiden Arthritis (RA) wird unter anderem Nahrungsergänzung untersucht, erläutert Dr. med. Diane van der Woude vom Leiden University Medical Center. Ein Kandidat ist Vitamin D, das an der Regulation von Genen beteiligt ist, die eine Rolle in Entzündungsprozessen spielen, und das im Tiermodell bei Autoimmunerkrankungen erfreuliche Ergebnisse gebracht hat. Beim Menschen liegen widersprüchliche Resultate aus Beobachtungsstudien vor. Ebenfalls von Interesse sind Omega-3-Fettsäuren (EPA) aus Fischöl. Die dahinterstehende Hypothese begründet sich in der Rolle dieser Fettsäuren für den Eicosanoid-Metabolismus. Was die Supplementierung von Vitamin D und Omega-3-Fettsäuren bringt, wurde in der placebokontrollierten VITAL-Studie mit mehr als 25000 gesunden Teilnehmer:innen untersucht.
Endpunkt war die Inzidenz von Autoimmunerkrankungen. Die im Jahr 2022 publizierte Auswertung über fünf Jahre zeigte, dass der primäre Endpunkt in der Placebo-Gruppe signifikant häufiger eintrat als in der EPA/Vitamin-D- und der Vitamin-D/Placebo-Gruppe. Für EPA/Placebo war die Effektgrösse vergleichbar, der Vorteil gegenüber Placebo jedoch nicht signifikant. Für die RA war die Inzidenz unter der Kombination EPA/Vitamin D im Vergleich zu Placebo sogar um 80% reduziert.1 Nach dem Ende der Studie wurden die Teilnehmer:innen über weitere drei Jahre beobachtet. In dieser Zeit konnten sie ihre Nahrungsergänzung weiter einnehmen, was weniger als ein Drittel auch tat: 28,3% gaben die Einnahme von Vitamin D und 22,9% die von Omega-3-Fettsäuren an. Daten aus der Nachbeobachtung von VITAL mit acht Jahren Beobachtungszeit wurden 2024 veröffentlicht. Sie zeigen, dass der Effekt von Vitamin D über die Jahre verschwindet. Für Fischöl ging zwar die Signifikanz (knapp) verloren, der Effekt war mit einem Faktor 0,64 für die RA-Inzidenz jedoch so gross, dass er als Signal gewertet werden könne, so van der Woude. Im Hinblick auf die Gesamtheit der Autoimmunerkrankungen war das Ergebnis für die Omega-3-Fettsäuren auch in der Verlängerung von VITAL signifikant.2 Dies sei insofern erklärbar, so van der Woude, als es zu einem Einbau der Omega-3-Fettsäuren in Zellwände komme und damit eine Wirkung lange über das Absetzen hinaus nicht überraschend komme.
Medikamentös
Eine Reihe von Präventionsstudien mit medikamentösen Interventionen wurde in Populationen mit besonders hohem RA-Risiko durchgeführt. Eine Übersichtsarbeit über diese Studienlandschaft wurde 2023 veröffentlicht. Bei den einzelnen Arbeiten ist auf eine wichtige Unterscheidung zu achten, so van der Woude: In die meisten Studien wurden nur symptomatische Personen mit positivem Antikörpernachweis eingeschlossen, lediglich eine Arbeit berücksichtigte Antikörper-negative Hochrisikopersonen, die unter Arthralgien litten. Als Interventionen wurden konventionelle DMARDs («disease-modifying anti-rheumatic drugs»), Biologika oder Glukokortikoide eingesetzt. Die meisten Studien zeigten keinen Effekt im Sinne eines Rückgangs von RA-Diagnosen, der Wirkung der DMARDs entsprechend aber zum Teil Besserung der Symptomatik. Lediglich mit dem Fusionsprotein Abatacept, das die Aktivierung von T-Zellen blockiert, wurde eine signifikante Reduktion der Progression zur RA erreicht.3
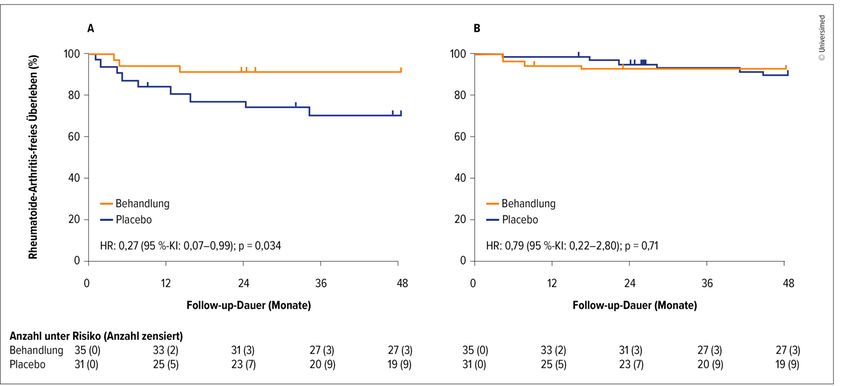
Van der Woude weist jedoch auf neue Daten aus der Studie TREAT EARLIER hin, die die Wirksamkeit von Methotrexat sowohl bei Antikörper-positiven als auch -negativen Risikopersonen untersuchte. Die Studie zeigte in der Gesamtpopulation keinen Effekt der Intervention. Auch in der ACPA-positiven Gruppe zeigte sich lediglich in den ersten Monaten eine Reduktion der Zahl an RA-Diagnosen. Ein bemerkenswertes Ergebnis brachte jedoch eine weitere Differenzierung der ACPA-negativen Kohorte. Wurde diese nämlich anhand eines Risikoscores in höheres oder niedrigeres Risiko geteilt, so erwies sich bei höherem Risiko MTX als signifikant und anhaltend wirksam in der Prävention manifester RA.4 Ausschlaggebend für die Risikobewertung waren dabei vor allem Auffälligkeiten in der Bildgebung (MRT), so van der Woude. Bei ACPA-negativen Personen ohne besondere Risikofaktoren zeigte MTX keine Wirkung, die Inzidenz von RA war in dieser Population allerdings insgesamt minimal. Die mangelnde Wirksamkeit der Intervention bei ACPA-positiven Patient:innen könne daran liegen, dass diese im Krankheitsverlauf zu weit fortgeschritten seien, als dass sich eine vollausgeprägte RA noch verhindern liesse (Abb. 1).
Abb. 1: 4-Jahres-Follow-up der TREAT-EARLIER-Studie (MTX) bei ACPA-negativen Patient:innen mit klinisch suspekter Arthralgie. Arthritisfreies Überleben unter MTX vs. Placebo; A: erhöhtes Risiko, B: niedriges Risiko für persistierende inflammatorische Arthritis
Therapeutische Interventionen
CAR-T-Zellen
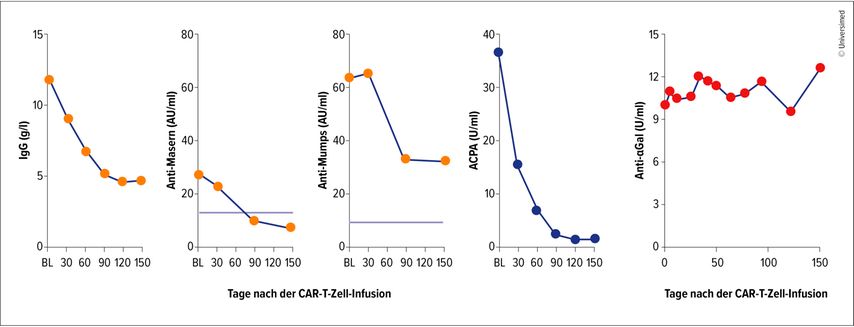
Neue Ansätze in der Therapie der RA machen nun erstmals Hoffnung auf Heilung oder zumindest eine anhaltende stabile Remission. Dies trifft in besonderem Mass auf den Einsatz von CAR-T-Zellen zu. CAR(«chimeric antigen receptor»)-T-Zellen sind gentechnisch veränderte T-Zellen mit synthetischen antigenspezifischen Rezeptoren, die sich bei den meisten dieser Therapien gegen CD19 auf B-Zellen richten. Mit CAR-T-Zellen werden so eine vollständige Depletion der CD19-positiven B-Zellen und damit eine Neuprogrammierung der Immunantwort erreicht. CAR-T-Zellen werden heute in der Onkologie sowie (bislang nur in kleinen Fallserien) bei Autoimmunerkrankungen eingesetzt. So wurden auch mehrere Patient:innen mit polyrefraktärer seropositiver RA mit CAR-T-Zellen behandelt.5 CAR-T-Zellen bieten sich besonders in jenen schwierigen Fällen an, bei denen eine komorbide RA neben anderen Autoimmunerkrankungen vorliegt. Dies zeigt der Fall einer Patientin mit Myasthenia gravis und RA, die mit CAR-T-Zellen erfolgreich behandelt werden konnten. Von besonderem Interesse an diesem Fall sind laut van der Woude jedoch die Antikörperprofile, die mit dem Fall publiziert wurden. So kam es nach der Behandlung zu einem schnellen und stabilen Abfallen der ACPA in Richtung null. Im Gegensatz dazu veränderten sich die für die Myasthenia gravis typischen Antikörper gegen den Acetylcholinrezeptor nicht – obwohl auch die Myasthenia gravis klinisch auf die Behandlung ansprach. Daraus könne man schliessen, erläutert van der Woude, dass Anti-AchR-Antikörper im Gegensatz zu ACPA nicht aus dem CD19-Kompartment kommen. Auch durch Impfungen induzierte Antikörper gingen nach CAR-T-Zell-Therapie zurück. Im Falle der Masern (nicht aber von Mumps) sogar so weit, dass mit einem Verlust der Impfwirkung gerechnet werden muss6 (Abb. 2).
Abb. 2: Antikörperprofile (IgG, Anti-Masern, Anti-Mumps, ACPA, Anti-Alpha-Gal) nach CART-T-Zell-Infusion
In einem weiteren Fall mit komorbider RA und multipler Sklerose war die CAR-T-Zell-Therapie zwar initial erfolgreich, es kam jedoch nach acht Monaten zu einem Rezidiv, dem mit einer Stammzelltransplantation erfolgreich begegnet werden konnte.7 In diesem Fall stelle sich angesichts der Krankengeschichte (die RA trat in der Folge einer Behandlung der MS mit Alemtuzumab auf) auch die Frage, ob es sich hier um eine «normale» rheumatoide Arthritis gehandelt habe, so van der Woute. Eine alternative Erklärung wäre, dass eben nicht mit Sicherheit davon ausgegangen werden könne, dass jede individuelle RA auf CAR-T-Zell-Therapie anspricht.
Factbox
Neue Ansätze in der Therapie der RA machen nun erstmals Hoffnung auf Heilung oder zumindest anhaltende stabile Remission.Einen völlig neuen Weg beschritt eine chinesische Gruppe mit der Herstellung von CAR-T-Zellen der vierten Generation, die nicht nur B-Zellen depletieren, sondern zusätzlich Antikörper gegen die Zytokine TNF-α und Interleukin 6 produzieren. Diese Zellen führten bei drei Patient:innen mit refraktärer RA innerhalb von 120 Tagen zu einem vollständigen Verschwinden der Krankheitsaktivität. Die Anti-CCP-Antikörper fielen bei allen drei Patient:innen deutlich ab, verschwanden aber nur bei zwei vollständig.8 Es sei allerdings unklar, so van der Woude, auf welche Komponente der CAR-T-Zellen dieser Erfolg zurückzuführen sei. Letztlich stelle sich aber die Frage, in welchen Fällen die toxische Konditionierung und die hohen Kosten der CAR-T-Zelltherapie angesichts der zahlreichen verfügbaren Alternativen zu rechtfertigen seien.
BiTE-Antikörper, S1P-Modulatoren, PD-1-Agonisten
Einen weiteren neuen, ebenfalls aus der Onkologie kommenden Ansatz in der Therapie der RA stellen BiTE-Antikörper («Bi-specific T-cell Engagers») dar. Diese Antikörper bestehen aus zwei scFv-Fragmenten, von denen eines Selektivität für ein Antigen auf einer Zielzelle aufweist, das andere spezifisch an Oberflächenproteine von T-Zellen bindet. Richtet sich eines der scFv-Fragmente gegen CD19, so führt dies zur Depletion CD19-positiver B-Zellen. Mit Blinatomumab wird ein solcher Antikörper bereits in Studien am Menschen untersucht.9 Die Infusion muss stationär über mehrere Tage unter hämodynamischem Monitoring erfolgen und wird zweimal, mit fünf Tagen Pause dazwischen, verabreicht. Inflammatorische Reaktionen während der Infusion sind häufig. Bislang wurden Daten zur Behandlung von sechs Patient:innen mit refraktärer RA publiziert. Ähnlich wie mit CAR-T-Zellen trat bei allen Patient:innen eine schnelle Reduktion der Krankheitsaktivität ein. Bei fünf der sechs Patient:innen wurde jedoch zu Woche 16 eine Behandlung mit Abatacept begonnen. So blieb die Remission über sechs Monate stabil, mit Ausnahme eines Patienten, bei dem zwischenzeitlich ein Flare auftrat.10
Auch Sphingosin-1-Phosphat-Rezeptor-Modulatoren (S1P-Modulatoren) könnten in Zukunft in der Behandlung der RA eine Rolle spielen. Diese Substanzen behindern Lymphozyten bei der Migration aus lymphatischen Organen und haben sich in der Therapie der multiplen Sklerose bewährt. In der Indikation RA liegen bislang ermutigende Phase-I-Daten für den S1PR1-Agonisten Proximod vor. Problematisch könnten bei einem Teil der Proband:innen erhöhte Leberenzyme werden, so van der Woude.11 Nicht über die Phase 2 hinausgekommen ist der PD1-Agonist Peresolimab. Dabei handelt es sich gewissermassen um den Gegenpart zu den in der Onkologie eingesetzten Checkpoint-Inhibitoren. Durch Aktivierung des Checkpoints soll die Aktivität des Immunsystems gedämpft werden. In einer kontrollierten Studie in der Indikation RA zeigte sich zwar Überlegenheit gegenüber Placebo,12 die Entwicklung wurde jedoch eingestellt. Van der Woude betont aber, dass Forschungen zu weiteren PD-1-Agonisten noch im Gange sind. Mit den FcRn-Blockern befindet sich eine weitere neue Medikamentengruppe in klinischer Entwicklung. FcRn ist ein neonataler Fc-Rezeptor, der nach der Geburt den Abbau von IgG verhindert. Folglich wird durch die Blockade von FcRn der IgG-Abbau gefördert. FcRn-Blocker stellen daher eine Therapieoption bei Antikörper-mediierten Erkrankungen wie der Myasthenia gravis dar. Von den drei in dieser Indikation zugelassenen FcRn-Blockern wird Nipocalimab nun auch in der Behandlung der RA untersucht. Die Studienpatient:innen waren ACPA- oder RF-positiv und hatten auf TNF-Inhibitoren nicht angesprochen. Im Vergleich zu Placebo erwies sich Nipocalimab im Hinblick auf den DAS28-CRP nicht als signifikant überlegen.13 Allerdings zeigt eine Subgruppenanalyse bei Patient:innen mit hohen ACPA-Titern eine DAS28-CRP-Remissionsrate von 40%. Auf Basis dieser Daten könnten in Zukunft weitere Studien geplant werden.
Immer wieder ORAL Surveillance: Wie sicher sind JAK-Inhibitoren?
Nach wie vor intensiv diskutiert werden Sicherheitsfragen zu den Januskinase(JAK)-Inhibitoren. Hintergrund dieser Debatte ist die 2022 publizierte Studie ORAL Surveillance, die für den JAK-Inhibitor Tofacitinib in den Dosierungen 5mg BID und 10mg BID im Vergleich zu TNF-Inhibitoren (jeweils vor dem Hintergrund einer MTX-Therapie) erhöhte Raten für kardiovaskuläre Ereignisse (MACE) und Krebs fand. Vor allem für die Dosierung von 5mg BID ergeben sich allerdings sehr hohe «numbers needed to harm», konkret 567 für MACE, 276 für Krebs und 763 für tiefe thrombovenöse Ereignisse.14 Van der Woude weist zusätzlich auf Subgruppenanalysen hin, die zeigen, dass das erhöhte MACE-Risiko nur auf Patient:innen mit kardiovaskulärer Vorerkrankung zutrifft15 und vom erhöhten Krebsrisiko nur Raucher:innen betroffen sind.16 Auch ist unklar, ob Tofacitinib das Risiko erhöht oder ob TNF-Inhibitoren das Risiko senken. In diese Richtung weist eine Netzwerk-Metaanalyse, die für TNF-Inhibitoren ein niedrigeres Krebsrisiko auch im Vergleich zu Methtotrexat oder Placebo fand.17 Die JAK-pot-Studie erhob das kardiovaskuläre Risiko unter RA-Therapien auf Basis europäischer Register und fand in den adjustierten Analysen keine Risikoerhöhung durch JAK-Inhibitoren. In der Subpopulation der Patient:innen über 50 Jahre mit mindestens einem kardiovaskulären Risikofaktor waren JAK-Inhibitoren sogar mit einem niedrigeren Risiko assoziiert als Anti-TNF-Biologika.18 Diese widersprüchlichen Daten lassen unterschiedliche Interpretationen zu. So betonen die Autoren von JAK-pot, dass sich die Populationen der Studien unterschieden, da in ORAL Surveillance nur unzureichend kontrollierte Patient:innen eingeschlossen waren. Des Weiteren kamen in JAK-pot unterschiedliche JAK-Inhibitoren zum Einsatz und es sei nicht geklärt, ob Unterschiede zwischen den verschiedenen Substanzen im Hinblick auf Risiken bestehen. Möglicherweise könnte auch besseres Risikomanagement in den europäischen Gesundheitssystemen das kardiovaskuläre Risiko in JAK-pot reduziert haben.
Quelle:
WIN(What’s new in)-Session «Rheumatoid Arthritis», EULAR 2025, Barcelona
Literatur:
1 Hahn J et al.: Vitamin D and marine omega 3 fatty acid supplementation and incident autoimmune disease: VITAL randomized controlled trial. BMJ 2022; 376: e066452 2 Costenbader KH et al.: Vitamin D and Marine n-3 Fatty acids for autoimmune disease prevention: outcomes two years after completion of a double-blind, placebo-controlled trial. Arthritis Rheumatol 2024; 76(6): 973-83 3 van Steenbergen HW et al.: Rheumatoid arthritis prevention in arthralgia: fantasy or reality? Nat Rev Rheumatol 2023; 19(12): 767-77 4 Dumoulin QA et al.: Development of rheumatoid arthritis after methotrexate in anticitrullinated protein antibody-negative people with clinically suspect arthralgia at risk of rheumatoid arthritis: 4-year data from the TREAT EARLIER trial. Lancet Rheumatol 2024; 6(12): e827-e836 5 Lidar M et al.: CD-19 CAR-T cells for polyrefractory rheumatoid arthritis. Ann Rheum Dis 2025; 84(2): 370-2 6 Haghikia A et al.: Clinical efficacy and autoantibody seroconversion with CD19-CAR T cell therapy in a patient with rheumatoid arthritis and coexisting myasthenia gravis. Ann Rheum Dis 2024; 83(11): 1597-8 7 Pecher AC et al.: Relapse after anti-CD19 CAR T-cell therapy in a patient with severe rheumatoid arthritis and multiple sclerosis effectively treated by autologous stem cell transplantation. Ann Rheum Dis 2025; 84(7): 1284-6 8 Li Y et al.: Fourth-generation chimeric antigen receptor T-cell therapy is tolerable and efficacious in treatment-resistant rheumatoid arthritis. Cell Res 2025; 35(3): 220-3 9 Humby F et al.: BiTE therapy for rheumatoid arthritis. Nat Med 2024; 30(6): 1533-4 10 Bucci L et al.: Bispecific T cell engager therapy for refractory rheumatoid arthritis. Nat Med 2024; 30(6): 1593-601 11 Zhang H et al.: Evaluation of proximod, a selective agonist of sphingosine-1-phosphate receptor-1, in healthy volunteers and patients with rheumatoid arthritis: a phase 1, double-blind, randomised, placebo-controlled, ascending dose trial. Lancet Rheumatol 2024; 6(12): e837-47 12 Tuttle J et al.: A phase 2 trial of peresolimab for adults with rheumatoid arthritis. N Engl J Med 2023; 388(20): 1853-62 13 Taylor PC et al.: Nipocalimab, an anti-FcRn monoclonal antibody, in participants with moderate to severe active rheumatoid arthritis and inadequate response or intolerance to anti-TNF therapy: results from the phase 2a IRIS-RA study. RMD Open 2024; 10(2): e004278 14 Ytterberg SR et al.: Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022; 386(4): 316-26 15 Charles-Schoeman C et al.: Risk of major adverse cardiovascular events with tofacitinib versus tumour necrosis factor inhibitors in patients with rheumatoid arthritis with or without a history of atherosclerotic cardiovascular disease: a post hoc analysis from ORAL Surveillance. Ann Rheum Dis 2023; 82(1): 119-29 16 Curtis JR et al.: Malignancy risk with tofacitinib versus TNF inhibitors in rheumatoid arthritis: results from the open-label, randomised controlled ORAL Surveillance trial. Ann Rheum Dis 2023; 82(3): 331-43 17 Russell MD et al.: JAK inhibitors and the risk of malignancy: a meta-analysis across disease indications. Ann Rheum Dis 2023; 82(8): 1059-67 18 Aymon R et al.: Incidence of Major adverse cardiovascular events in patients with rheumatoid arthritis treated with JAK inhibitors compared with biologic disease-modifying antirheumatic drugs: data from an international collaboration of registries. Arthritis Rheumatol 2025; 77(9): 1194-204
Das könnte Sie auch interessieren:
Roboterassistierte primäre Hüfttotalendoprothese – Fortschritt oder Marketing?
Seit der Einführung des RIO®-Systems im Jahr 2006 (MAKO) und der Übernahme durch die Firma Stryker im Jahr 2017 haben nahezu alle grossen Knieendoprothesenhersteller eigene robotische ...
Wann und unter welchen Bedingungen?
Patient:innen unter einer immunsuppressiven Therapie verkennen oft, wie wichtig Impfungen für sie sind. Ein Vortrag von Dr. med. Berger auf dem SGR-Kongress befasste sich mit der Art der ...
Algorithmus zur Behandlung der Hüftinstabilität
Die postoperative Instabilität stellt eine der häufigsten Ursachen für Revisionsoperationen nach Hüfttotalendoprothese dar. Patient:innenspezifische Faktoren, implantatbezogene Aspekte ...