Active Surveillance beim Low-Risk-PCa: was uns Studien wirklich lehren
Autoren:
Dr. Nicolai Hübner
Univ.-Prof. Dr. Sharokh F. Shariat
Universitätsklinik für Urologie
Medizinische Universität Wien
E-Mail: nicolai.huebner@meduniwien.ac.at
Active Surveillance (AS) bei Prostatakarzinom gewinnt unter den Ärzt:innen zunehmend an Akzeptanz. Patienten wünschen sich vermehrt Informationen dazu, um qualifiziert entscheiden zu können. Nicht jeder Patient ist für AS geeignet. Welche Kriterien helfen bei der Selektion, wie läuft gute AS ab, was ist dabei zu beachten und welche Punkte sind beim Shared Decision Making zu bedenken?
Keypoints
-
AS ist sicher für Low-Risk-PCa – bei stringentem Protokoll.
-
MRT ergänzt, ersetzt aber keine systematischen Kontrollbiopsien.
-
Deintensivierung ist möglich nach wiederholt negativen Biopsien.
-
Favorable Intermediate Risk nur selektiv und mit ehrlicher Aufklärung
-
Mehr AS anbieten: Geeignete Patient:innen profitieren onkologisch und funktionell.
Warum Active Surveillance?
AS erhält die Lebensqualität, vermeidet Übertherapie und ermöglicht es dennoch, rechtzeitig kurativ zubehandeln, wenn die Erkrankung fortschreitet. Trotz klarer Leitlinienempfehlungen ist die Nutzung nach wie vor heterogen – oft wegen Unsicherheit bei Arzt/Ärztin und Patient bezüglich notwendiger Kontrollen, Verlässlichkeit der MRT und der Patientenselektion.
Was sagen randomisierte Studien zur Sicherheit?
Die Studien SPCG-4 und PIVOT verglichen die radikale Prostatektomie (RPE) vs. „watchful waiting“ (WW). Dabei zeigte sich kein Unterschied in der PCa-spezifischen Mortalität (PCSM) bei Niedrigrisiko-Patienten.
Die Studie ProtecT randomisierte 1643 Männer in 3 Arme: RPE, Strahlentherapie oder Active Monitoring. Auch in ProtecT zeigte sich kein Unterschied in Hinblick auf die PCSM zwischen den Armen. Die Rate für das Auftreten von Metastasen im Monitoring war etwas höher als unter den zuvor genannten Studien, das Monitoring war aber bereits strukturierter als klassisches WW und beinhaltete PSA-gesteuerte Biopsien. Innerhalb von 8 Jahren wurde bei ≈50% der Teilnehmer eine definitive Therapie durchgeführt. Die konsequente Schlussfolgerung aus diesen Studien ist, dass mit heutigen, noch strengeren AS-Protokollen AS für Low-Risk-Patienten sicher ist.
Moderne AS-Kohorten: Was bringt Protokolldisziplin?
Große prospektive Programme (PASS, PRIAS, Movember GAP3) zeigen unter protokollgeleiteter AS inklusive planmäßiger Biopsien, dass nach 10 Jahren bei nur rund 1% der Patienten Metastasen aufgetreten waren. Die prostatakrebsspezifische Mortalität lag nach 10 Jahren bei <0,5%. Innerhalb von 10 Jahren erfolgte bei rund 50% eine definitive Therapie. Der Grund war meist Upgrading/-staging und nicht verpasste Behandlungschance.
Wer ist trotz Low Risk heikel?
Eine Metaanalyse zeigt, auf welche Patienten man trotz Low-Risk-PCa stärker achten sollte. Jene mit hoher PSA-Dichte und hohem Tumorvolumen hatten ein höheres Reklassifikationsrisiko unter AS. Diese Faktoren müssen offen und genau in Shared-Decision-Making-Gesprächen diskutiert werden.
Deintensivierung: weniger Biopsien – aber gezielt
Viele Patienten bleiben viele Jahre auf AS. Längere Intervalle zwischen Biopsien sind vertretbar bei negativer Bestätigungsbiopsie, besonders bei mehrfach negativen Kontrollbiopsien. In prospektiven Kohortenstudien sowie in Metaanalysen sind negative Biopsien ein Indikator gegen spätere Reklassifikation.
Praxisvorschlag
Nach 2–3 Jahren stabiler Histologie das Intervall von systematischen Biopsien auf q2–3 Jahre strecken, sofern die PSA-Dynamik, die digitale rektale Untersuchung und die MRT unauffällig sind.
Kann die MRT periodische systematische Biopsien ersetzen?
Kurz: nein
In AS-Kohorten liegt der negative prädiktive Wert (NPV) der MRT meist nur zwischen 70 und 80%; 31–36% der Tumorupgrades erfolgen aufgrund von systematischen Stanzen, werden also nicht durch Läsionen begründet, die durch die MRT entdeckt werden.
Im ASIST-Trial wurde bei der Bestätigungsbiopsie kein Unterschied im Upgrading zwischen rein systematischer Biopsie vs. MRT-gezielt festgestellt. Nach 2 Jahren gab es weniger Versagen unter AS im MRT-Arm. D.h. – MRT ist nützlich, ersetzt aber nicht die planmäßige Biopsie. Die serielle Anwendung der MRT wurde in der Studie PRECISE untersucht. Der NPV lag zwischen 81 und 87%. Festgestellte Veränderungen allein sagen eine Progression nicht zuverlässig voraus. Die PRECISE-Gruppe hat dazu einen Score erstellt.
Fazit
Die MRT ist ein Add-on zur Risikostratifizierung und zur Zielbiopsie, nicht jedoch ein Ersatz für periodische systematische Biopsien.
AS bei Intermediate-Risk-PCa: Geht das?
Im Gesamtkollektiv haben Intermediate-Risk-Patienten schlechtere onkologische Ergebnisse als Low-Risk-Patienten. Bei ihnen ist häufiger eine definitive Therapie nötig, es liegt öfter eine ungünstigere Pathologie vor, es treten häufiger Rezidive und Metastasen auf, die PCSM ist höher. Aber: Favorable-Intermediate-Risk-Patienten können selektiert für eine AS geeignet sein, wenn sie die folgenden Kriterien erfüllen:
-
niedrige PSA-Dichte, geringe Tumorlast, geringer Anteil an Muster 4
-
kein kribriformes oder intraduktales Muster
Wichtig
Die transparente Aufklärung des Patienten, dass die Risiken der AS höher sind als bei einem Low-Risk-PCa.
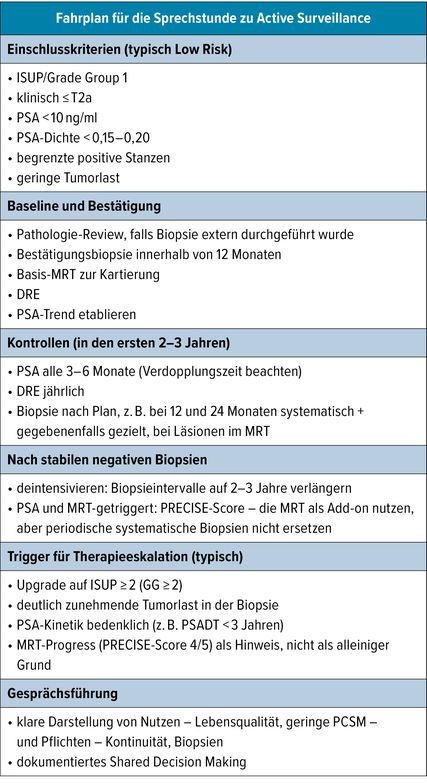
Einen pragmatischen Fahrplan für die Sprechstunde zu Active Surveillance zeigt Tabelle 1.
Fazit
Die Active Surveillance (AS) ist Standard im Management des Low-Risk-PCa in den EAU-Leitlinien. Sie gewinnt an Akzeptanz, wird aber in der Praxis weiterhin zu selten – nur bei ≈60% der geeigneten Patienten, mit starker Streuung – eingesetzt. Randomisierte Studien (SPCG-4, PIVOT, ProtecT) und zeitgemäße AS-Kohorten (PASS, PRIAS, GAP3) belegen eine sehr geringe PCa-spezifische Mortalität unter AS, die Quote für Metastasen liegt bei ≈1% nach 10 Jahren, die prostatakrebsspezifische Mortalität bei <0,5% in gut geführten Programmen.
Die AS ist sicher, wenn sie protokollbasiert erfolgt – das beinhaltet eine strukturierte Bildgebung, Laborkontrollen sowie Biopsien. Die Magnetresonanztomografie (MRT) ist bei AS hilfreich, kann Biopsien aber nicht ersetzen. Auch eine Deintensivierung ist bei wiederholt negativen oderunveränderten Kontrollbiopsien möglich. Bei Patienten mit Favorable-Intermediate-Risk-PCa kann selektiert eine AS ebenfalls eine geeignete Vorgangsweise sein. Wichtig ist dabei die ehrliche Aufklärung über das erhöhte Risiko gegenüber einer AS bei Low-Risk-PCa.
Literatur:
● Baboudjian M et al.: AS for intermediate-risk PCa: meta-analysis. Eur Urol Oncol 2022; 5(6): 617-27 ● Balakrishnan AS et al.: Evaluating the safety of active surveillance: outcomes of deferred radical prostatectomy after an initial period of surveillance. J Urol 2019; 202(3): 506-10 ● Bangma C et al.: Has active surveillance for prostate cancer become safer? Lessons learned from a global clinical registry. Eur Urol Oncol 2025; 8(2): 324-37 ● Beckmann K et al.: Risk of progression following a negative biopsy in prostate cancer active surveillance. Prostate Cancer Prostatic Dis 2023; 26(2): 403-9 ● Bill-Axelson A et al.: Radical prostatectomy or watchful waiting in early prostate cancer. N Engl J Med 2014; 370(10): 932-42 ● Cooperberg MR et al.: Time trends and variation in the use of active surveillance for management of low-risk prostate cancer in the US. JAMA Netw Open 2023; 6(3): e231439-e231439 ● de Vos II et al.: Long-term outcomes of active surveillance for Grade Group 1 prostate cancer and the impact of the use of MRT on overtreatment. BJU Int2025; 136(2): 245-53 ● Frye TP et al.: MRT–TRUS fusion biopsy to detect progression in AS. J Urol 2017; 197(3): 640-6 ● Hamdy FC et al.: Fifteen-year outcomes after monitoring, surgery, or radiotherapy for prostate cancer. N Engl J Med 2023; 388(17): 1547-58 ● Klotz L et al.: Randomized study of systematic biopsy versus magnetic resonance imaging and targeted and systematic biopsy in men on active surveillance (ASIST): 2-year postbiopsy follow-up. Eur Urol 2020; 77(3): 311-7 ● Newcomb LF et al.: Long-term outcomes in patients using protocol-directed active surveillance for prostate cancer. JAMA 2024; 331(24): 2084-93 ● Petrelli F et al.: Predictive factors for reclassification and relapse in prostate cancer eligible for active surveillance: a systematic review and meta-analysis. Urology 2016; 91: 136-42 ● Rajwa P et al.: Association of negative followup biopsy and reclassification during active surveillance of prostate cancer: a systematic review and meta-analysis. J Urol 2021; 205(6): 1559-69 ● Tran GN et al.: MRT–US fusion biopsy during AS. Eur Urol 2017; 72(2): 275-81 ● Wilt TJ et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 2012; 367(3): 203-13
Das könnte Sie auch interessieren:
Weitere DGU-Highlights zu Fortschritten in Therapie, Diagnostik und Digitalisierung
Der 77. Kongress der Deutschen Gesellschaft für Urologie in Hamburg stand unter dem Motto „Urologie verbindet“. Vier Tage lang diskutierten Expert:innen aus Klinik und Forschung die ...
Frischer Wind in Hamburg – Highlights vom DGU 2025
Vom 17. bis 20.9.2025 fand in Hamburg der 77. Kongress der Deutschen Gesellschaft für Urologie (DGU) statt. Der Kongresspräsident Prof. Dr. Bernd Wullich betont in seinen Grußworten, ...
Klassifikationssysteme für intraoperative Komplikationen in der Urologie
Intraoperative Komplikationen gehören zum chirurgischen Alltag, deren systematische Erfassung ist jedoch in der Urologie nach wie vor lückenhaft. Vorhandene Klassifikationssysteme werden ...