Gewebeschäden visualisieren mit neuem FAPI-PET-Tracer
Bericht:
Mag. pharm. Irene Senn, PhD
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Diagnostik und Therapie in der Rheumatologie fokussieren bislang vorwiegend auf die entzündlichen Prozesse. Diese lassen sich mit etablierten bildgebenden Verfahren wie MRT, 18F-FDG-PET/CT oder Ultraschall gut darstellen. Einem anderen Aspekt wird bislang hingegen zu wenig Beachtung geschenkt: nämlich Gewebereaktionen, die zu fibrotischen Veränderungen führen. Diese könnten sich zukünftig mittels einer innovativen 68Ga-FAPI-PET-Methode nicht invasiv visualisieren lassen.
Gewebeschäden werden in der Rheumatologie entweder durch Entzündungen oder durch überschießende fibrotische Vorgänge verursacht. Die beiden Prozesse unterscheiden sich grundlegend – sowohl in Hinblick auf die Krankheitsprognose als auch auf die Behandlungsansätze. „Über den Ablauf des Entzündungsprozesses wissen wir heute relativ viel, aber vergleichsweise wenig ist über die Gewebereaktionen bekannt. Das Stroma spielt jedoch in der Rheumatologie eine wichtigere Rolle als bisher geglaubt“, ist Priv.-Doz. Dr. Andreas Ramming, leitender Oberarzt an der Medizinischen Klinik 3 für Rheumatologie und Immunologie am Universitätsklinikum Erlangen, überzeugt.
Die Rolle des Gewebes
Auf zellulärer Ebene fokussieren die rheumatologische Diagnostik und Therapie vor allem auf Immunzellen wie Monozyten, Makrophagen, T- und B-Zellen. Die Funktion dieser Immunzellen wird jedoch ganz entscheidend im Gewebe moduliert. Das Stroma hat also weit mehr als nur eine strukturgebende Aufgabe. So sind Fibroblasten am Auf- und Abbau von Matrix beteiligt und haben zudem auch eine Art „Wächterfunktion“ im Gewebe: Sie können offenbar über komplexe Mechanismen zur Entzündungsentstehung und Entzündungsauflösung und damit sowohl zum Gewebeschaden als auch zur Gewebereparatur beitragen. Mesenchymale Stromazellen sind außerdem selbst sensitiv für Zytokine. Darüber hinaus ist aus Rezeptor-Ligand-Studien bekannt, dass sie mit Immunzellen interagieren können. „Wenn wir uns also die mesenchymale Komponente von rheumatologischen Erkrankungen vor Augen führen, sehen wir bislang möglicherweise nur die Spitze des Eisberges“, macht Ramming deutlich. Dementsprechend wünschenswert wäre die gleichzeitige Visualisierung von entzündlichen und fibrotischen Prozessen.
Innovativer FAPI-PET-Tracer
Während die 18Fluordesoxyglucose-Positronenemissionstomografie (18F-FDG-PET) gute Einblicke in den Grad der entzündlichen Aktivität ermöglicht, ist die nicht invasive Darstellung von fibrotischen Vorgängen bislang herausfordernd. Ein neuer PET-Marker bietet hier einen innovativen Ansatz. Bei dem Tracer handelt es sich um ein „small molecule“, welches an die schwach radioaktive Substanz Gallium 68 gekoppelt wird. Das Molekül dockt an das Fibroblastenaktivierungsprotein (FAP) an und agiert als FAP-Inhibitor (FAPI). FAP wird an der Zelloberfläche von aktivierten Fibroblasten exprimiert. Der FAPI-Tracer interagiert mit diesem Membranprotein, wird internalisiert, in der Zelle akkumuliert und lässt sich dort aufgrund der radioaktiven Markierung im PET-CT detektieren.
Dieser 68Ga-FAPI-PET-Marker stammt ursprünglich aus der Tumordiagnostik und wird in diesem Bereich bereits erfolgreich eingesetzt.1 Neue klinische Einsatzgebiete werden derzeit intensiv erforscht. So könnte die Technik bei verschiedenen rheumatologischen Erkrankungen Anwendung finden, um entzündliche von fibrotischen Vorgängen zu unterscheiden. Die Akkumulation des FAPI-Tracers weist auf aktive Umbauprozesse im Gewebe hin, wie sie bei Patienten mit systemischer Sklerose, IgG4-Syndrom oder Spondyloarthritis beobachtet werden.
FAPI-PET-CT bei IgG4-assoziierten Erkrankungen
Ein vielversprechendes Einsatzgebiet für die neue FAPI-PET/CT-Technologie ist u.a. das Management von IgG4-assoziierten Erkrankungen. Die Unterscheidung einer entzündlichen von einer fibrotischen Aktivität könnte hier wichtige Hinweise liefern. Schließlich erfordern die von Fibrose dominierten Subtypen der Erkrankung andere Ansätze zur Kontrolle des Fortschreitens der Erkrankung – beispielsweise eine spezifische antifibrotische Therapie anstelle von Glukokortikoiden.
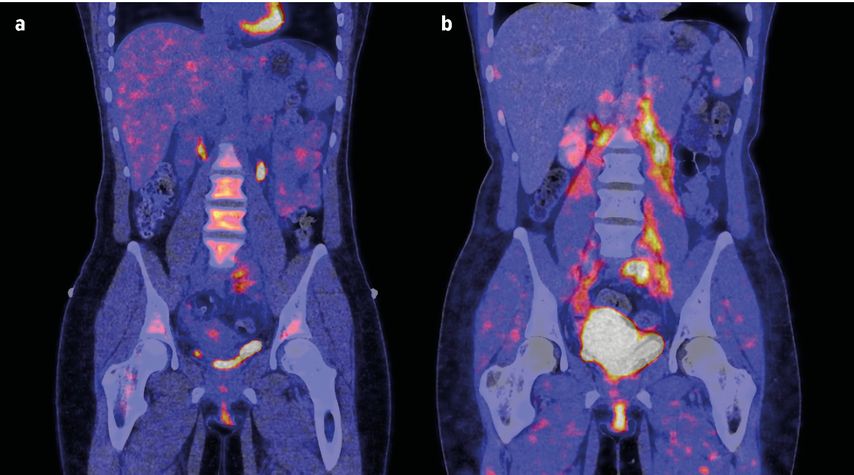
Um die Technologie in dieser Indikation zu validieren, wurde in der Arbeitsgruppe von Ramming eine klinische Querschnittsstudie an einer Kohorte von 27 Patienten mit IgG4-Syndrom durchgeführt.2 Die Probanden wiesen unterschiedliche Grade an entzündlichen, fibrotischen und gemischten Manifestationen auf. Zunächst wurden die Studienteilnehmer einem PET-Scan unterzogen, und zwar einerseits mit einem FAP-spezifischen Tracer (68Ga-FAPI-04) und andererseits mit dem klassischen 18F-FDG-Tracer (zur Visualisierung des Glukosestoffwechsels und damit letztlich des Entzündungsprozesses). Zusätzlich wurden eine MRT und eine Histopathologie gemacht.
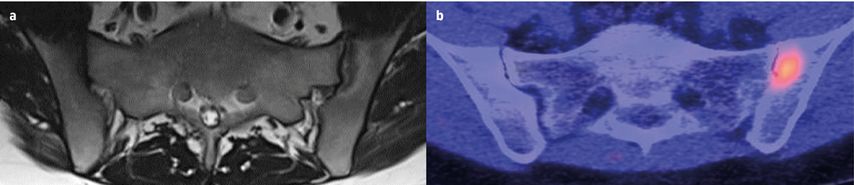
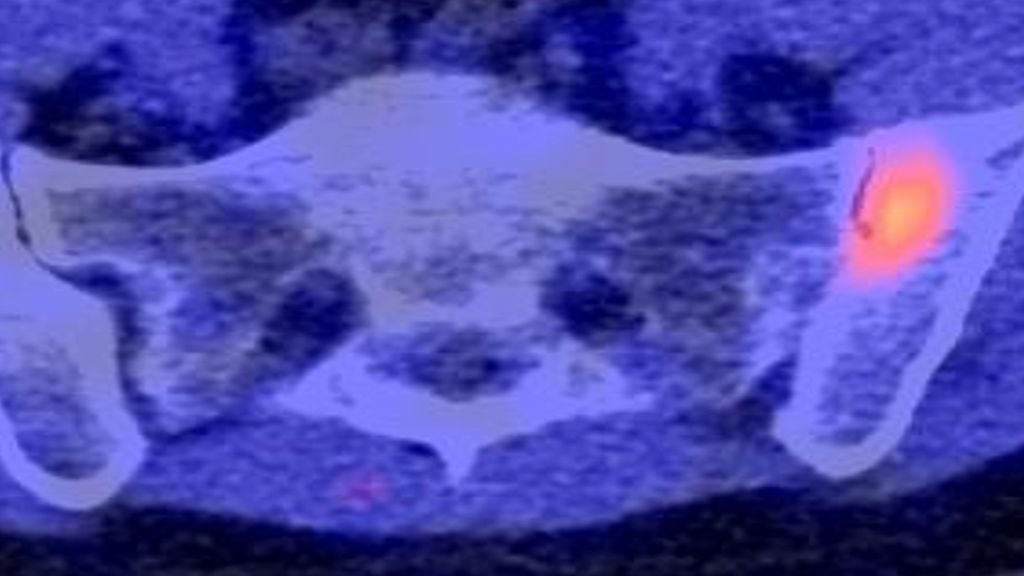
Abb. 2: Die im MRT (a) detektierten Gelenksschädigungen korrelieren mit der Signalintensität im FAPI-PET-CT (b). MRT-Läsionen ohne Gelenksschaden liefern hingegen kein Signal im FAPI-PET/CT
Eine wichtige Beobachtung war, dass sich die sehr frühen entzündlichen Stadien von späteren fibrotischen Stadien unterscheiden ließen. Die entzündlichen Frühstadien zeigten starke Signale im FDG-PET, wohingegen kein FAPI-PET-Signal zu sehen war. Umgekehrt zeigten fibrotische Spätstadien der Erkrankung kein Signal im FDG-PET, allerdings eine deutliche Aktivität im FAPI-PET. Eine Korrelation zwischen den beiden Signalen konnte nicht gefunden werden, was die Forschergruppe in der Annahme bestätigte, dass durch den FAPI-PET-Tracer tatsächlich etwas vollkommen anderes als der entzündliche Prozess detektiert wird.
Außerdem wurde in der Studie die Fragestellung adressiert, inwieweit eine immunsuppressive Therapie die mesenchymale Aktivität beeinflussen kann. In einem longitudinalen Ansatz wurden die PET-CT-Daten (18F-FDG- und 68Ga-FAPI-PET-CT) vor und nach einer immunsuppressiven Therapie mit Rituximab ausgewertet und mit den klinischen Befunden sowie den MRT-Daten korreliert. Es zeigte sich, dass die entzündliche Komponente unter Therapie sehr gut unter Kontrolle zu bringen war, während die mesenchymale Aktivität weit schlechter auf die B-Zell-Depletion ansprach. Mehr als 50% der aktiven FAPI-Läsionen waren nach 6-monatiger Behandlung noch nachweisbar. Die persistierende mesenchymale Aktivität war zudem mit einer weiteren Größenzunahme der jeweiligen Weichteilmasse assoziiert (volumetrisch mittels CT gemessen) und korrelierte mit den klinischen Symptomen der Patienten.
FAPI-PET-CT bei systemischer Sklerose
Auch bei der systemischen Sklerose kann die FAPI-PET-Technologie wichtige diagnostische Hinweise geben. Die Technik wurde hier insbesondere im Bereich der Lungenfibrose validiert.3 Bei der Lungenfibrose im Rahmen einer systemischen Sklerose kommt es bekanntlich zu einem bindegewebigen Umbau der Lunge. Im Mittelpunkt der Untersuchung stand, ob und wie die molekularen Vorgänge in den Fibroblasten visualisiert werden können – mit dem Ziel, eine Therapie möglichst frühzeitig einzuleiten bzw. das Ansprechen zu überprüfen. Und tatsächlich gelang es mittels FAPI-PET-CT-Technologie erstmals, die molekulare Aktivität von aktivierten Fibroblasten im Menschen sichtbar zu machen. Besonders interessant war, dass der Aktivierungsgrad der Fibroblasten mit der Krankheitsaktivität sowie dem Therapieansprechen korrelierte. Zudem waren jene Probanden mit einer besonders ausgeprägten Signalintensität im FAPI-PET auch jene, die im weiteren Verlauf eine Progression zeigten.
FAPI-PET-CT bei Arthritiden
Aber nicht nur bei Kollagenosen, auch bei Arthritiden könnte die FAPI-PET-Technologie von Interesse sein. Die molekularen Pathomechanismen hinter fibrotischen Gewebeschäden werden bislang allerdings noch unzureichend verstanden. Eine präklinische Arbeit aus England untersuchte kürzlich den Einfluss der Fibroblastenaktivität auf den Krankheitsverlauf bei Arthritiden.4 Dazu wurde ein interessanter Ansatz gewählt: Arthritis-Modelltieren wurde ein Diphtherietoxin-Rezeptor (DTR) in die Fibroblasten kloniert; durch die Injektion von Diphtherietoxin lassen sich so die Fibroblasten im Gelenk vollständig depletieren. Die Knochenbefunde der arthritischen Modelltiere zeigten ein erstaunliches Ergebnis. Bei den DTR–-Mäusen (also jenen Tieren mit intakten Fibroblasten im Gelenk) waren deutliche Destruktionen in der Gelenksregion der Vorder- und Hinterpfote sichtbar. Die fibroblastendepletierten Tiere (DTR+) hingegen waren trotz ablaufender Inflammation fast vollständig vor Erosion und Osteoproliferation geschützt. Insgesamt scheinen also Fibroblasten und das FAP auch bei Arthritiden sehr aktiv involviert zu sein.
Inwieweit diese präklinischen Befunde auf den Menschen übertragbar sind, untersuchten Ramming und seine Mitarbeiter in einer rezenten Arbeit.5 In die Studie wurden 20 Patienten mit rheumatoider Arthritis (RA), 50 Patienten mit Psoriasisarthritis (PsA) und 50 Patienten mit axialer Spondyloarthritis (SpA) eingeschlossen. Zunächst wurden mittels FAPI-PET-CT Gewebereaktionen in verschiedenen anatomischen Regionen visualisiert (Hüftgelenksynovitis, Sakroiliitis, Tendinitis, Ellenbogenenthesitis, Facettengelenkassoziationen, Daktylitis). Bemerkenswert ist, dass die Intensität der FAPI-PET-CT-Signale mit den jeweiligen klinischen Scores (DAPSA bei PsA, SPARCC bei Enthesitis, DAS28 bei RA und PsA, ASDAS und BASDAI bei SpA) korrelierte.
In einem nächsten Schritt wurden die Probanden einer FAPI-PET-CT sowie einer MRT unterzogen. Die im MRT detektierten Läsionen wurden systematisch kategorisiert in 1. erosive Schädigungen, 2. osteoproliferative Schädigung bzw. 3. Entzündung ohne Hinweis auf eine Schädigung. Und tatsächlich zeigte sich, dass die im MRT detektierten Gelenksschädigungen mit einer erhöhten FAPI-PET-Signalintensität assoziiert waren, während Läsionen, die lediglich eine Inflammation ohne Gelenksschaden zeigten, kein FAPI-PET-Signal lieferten.
Diese Erkenntnis könnte zukünftig auch für die klinische Praxis von Bedeutung sein. „Tatsächlich sehen wir häufig Patienten mit Gelenksbeschwerden, bei denen in der MRT eine Kontrastmittelanreicherung detektiert wird, aber noch keine Gelenksschädigung vorhanden ist. Andererseits gibt es aber natürlich auch jene Fälle, die sehr schnell nach einer beginnenden Inflammation auch erosive Veränderungen zeigen. Diese beiden Gruppen voneinander zu unterscheiden wäre durchaus interessant – insbesondere in Hinblick auf die Therapieentscheidung“, gab Ramming einen Ausblick in die zukünftigen Einsatzgebiete der neuen Technologie.
Untersucht wurden übrigens auch die Effekte einer Biologikatherapie auf die Gewebereaktion. Dabei zeigte sich, dass sowohl TNF-α-Inhibitoren als auch IL-17A-Blocker die mesenchymale Aktivität reduzierten – und zwar relativ rasch. So war bei einem beispielhaft gezeigten Patienten mit einer Sakroiliitis bereits nach 3 Monaten unter IL-17A-Inhibitor-Therapie das mesenchymale Signal komplett verschwunden.
Quelle:
Rheuma Schweiz, Webinar: Neue Methoden in der rheumatologischen Diagnostik, 20. Februar 2023
Literatur:
1 Syed M et al.: Fibroblast activation protein inhibitor (FAPI) PET for diagnostics and advanced targeted radiotherapy in head and neck cancers. Eur J Nucl Med Mol Imaging 2020; 47(12): 2836-45 2 Schmidkonz C et al.: Disentangling inflammatory from fibrotic disease activity by fibroblast activation protein imaging. Ann Rheum Dis 2020; 79(11): 1485-91 3 Bergmann C et al.: 68Ga-FAPI-04 PET-CT for molecular assessment of fibroblast activation and risk evaluation in systemic sclerosis-associated interstitial lung disease: a single-centre, pilot study. Lancet Rheumatology 2021; 3(3): e185-94 4 Croft AP et al.: Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature 2019; 570(7760): 246-51 5 Rauber S et al.: Molecular imaging with fibroblast activation protein tracers depicts inflammatory joint damage and its transition to resolution of inflammation. bioRxiv 2023; 01.17.524425
Das könnte Sie auch interessieren:
Schwierig zu behandelnde oder therapierefraktäre SpA
Die Behandlungsmöglichkeiten bei Spondyloarthritis haben sich mit Einführung der Biologika dramatisch verbessert. Das bedeutet allerdings nicht, dass alle Patient:innen in ausreichendem ...
Biologikatherapien in der Schwangerschaft
„Biologika sind in der Schwangerschaft in Ordnung“ – mit dieser klaren Aussage fasste Prof.Dr. Ian Giles, University College London, im Rahmen der RheumaPreg-2025- Konferenz in Wien die ...
Spondyloarthritis: Schäden sind bei frühzeitiger Therapie reversibel
Das alte Konzept der nichtradiografischen axialen Spondyloarthritis und der radiografischen ankylosierenden Spondylitis wird zunehmend verlassen und in der Diagnose axiale ...