Neue Entwicklungen der allergenspezifischen Immuntherapie
Autorin:
Univ.-Prof. Dr. Barbara Bohle
Institut für Pathophysiologie und Allergieforschung
Medizinische Universität Wien
E-Mail: barbara.bohle@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die allergenspezifische Immuntherapie (ASIT) oder Hyposensibilisierung existiert seit über 100 Jahren und ist immer noch die einzige ursächliche Behandlung für IgE-vermittelte Allergien, wie z.B. Heuschnupfen durch Pflanzenpollen oder Hausstaubmilben. Basierend auf der Erforschung der durch ASIT ausgelösten Veränderungen der allergenspezifischen Immunantwort im Behandelten wurde kürzlich eine interessante Alternative in zwei Pilotstudien untersucht, die vielversprechende Ergebnisse erzielte: eine passive Immuntherapie mit allergenspezifischen monoklonalen Antikörpern.
Keypoints
-
Allergien sind weit verbreitet und müssen ursächlich behandelt werden, um eine längerfristige Reduktion der allergischen Symptome zu erreichen.
-
Die einmalige Verabreichung von humanen, monoklonalen Antikörpern gegen die Hauptallergene Feld1 und Betv1 führte zur längerfristigen Reduktion allergischer Symptome bei Katzenhaar- und Birkenpollenallergien.
-
Die passive Immuntherapie könnte eine innovative Behandlungsmethode für gewisse Allergieformen darstellen.
Allergenspezifische Immuntherapie (ASIT) ist derzeit die einzige ursächliche Therapie für IgE-vermittelte Überempfindlichkeitsreaktionen des Immunsystems, sog. Allergien. Dabei werden dem Betroffenen kontrolliert steigende Konzentrationen jenes Allergens subkutan oder sublingual verabreicht, das für die Symptome verantwortlich ist. Im Gegensatz zur kurzfristigen Verminderung von Symptomen durch diverse Medikamente, wie z.B. Antihistaminika, führt die ASIT zur längerfristigen Toleranz. Allerdings hat diese Behandlung auch Nachteile. Die reguläre Behandlungsdauer beträgt drei Jahre, was sich häufig negativ auf die Compliance der Betroffenen auswirkt. Dennoch ist eine gute Compliance eine wichtige Voraussetzung für eine erfolgreiche ASIT. Die ASIT wird nicht für alle Arten von Allergien angeboten, da sie bei manchen Allergien weniger effizient ist, wie z.B. beiTierhaarallergien. Jedoch ist die ASIT sehr wirksam bei der Behandlung der Insektengift- und Pollenallergien.
Mechanismen der ASIT
Die regelmäßige Verabreichung von Allergenen während der ASIT führt zu verschiedenen Veränderungen der allergenspezifischen Immunreaktion. Es kommt zur verminderten Reaktivität der Effektorzellen (Mastzellen) sowie zur Abschwächung der – durch Typ-2-T-Helferzellen dominierten – allergenspezifischen T-Zell-Antwort. Ebenfalls wurde bereits 1937 durch die passiven Transferexperimente von Mary Hewitt Loveless der Nachweis erbracht, dass die ASIT zur Bildung von löslichen Faktoren im Blut führt, welche die allergische Sofortreaktion vermindern können.1,2 Damals wurde zunächst Serum von Ragweedallergikern in die Haut eines Nichtallergikers injiziert, worauf sich die im Allergikerserum vorhandenen spezifischen IgE-Antikörper an die Fc-Epsilon-Rezeptoren (FcεRI) der lokalen Mastzellen binden konnten. Nach 48 Stunden folgte eine intradermale Injektion von Ragweedextrakt, die dann eine IgE-vermittelte Sofortreaktion auslöste (Abb.1). Diese Reaktion war deutlich abgeschwächt, wenn das für den Hauttest eingesetzte Ragweedextrakt mit einem Serumeines Ragweedallergikersversetzt wurde, welches nach der Immuntherapie gewonnen worden war.
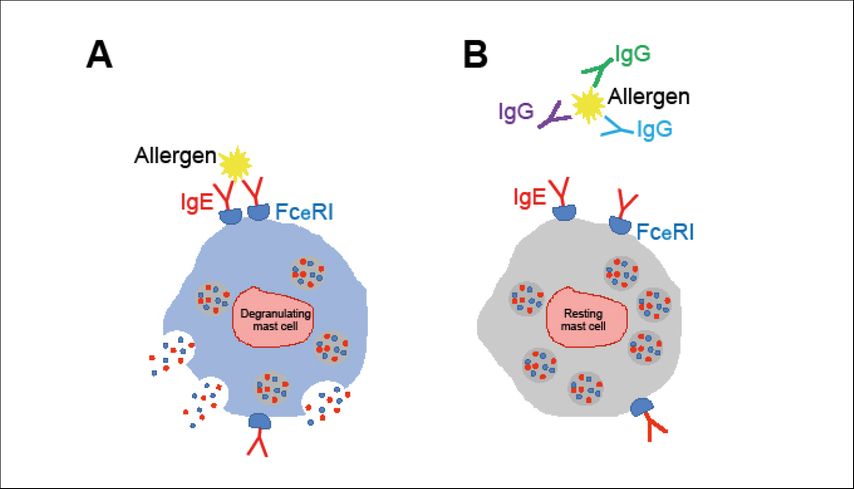
Abb. 1: Wirkmechanismus der allergenspezifischen, blockierenden Antikörper in Mastzellen .A) Bei Allergenkontakt erfolgt die IgE-vermittelte Aktivierung der Mastzelle. Es kommt zur Ausschüttung von präformierten Mediatoren, wie z.B. Histamin. B) ASIT-induzierte, allergenspezifische IgG-Antikörper binden an das Allergen und blockieren dessen Erkennung durch IgE, worauf keine Sofortreaktion in der Mastzelle ausgelöst wird
Zahlreiche Studien haben mittlerweile nachgewiesen, dass es während der ASIT zur Ausbildung allergenspezifischer IgG-Antikörper kommt, wobei v.a. die Titer von allergenspezifischenIgG4-Antikörpern stark ansteigen. Diese Beobachtungen bildeten die Grundlage des Konzepts der „blockierenden Antikörper“.3 Ein Teil der durch ASITinduzierten, allergenspezifischen IgG-Antikörper bindet stark genug an das Allergen und blockiert dadurch eine nachfolgende Bindung durch allergenspezifische IgE-Antikörper. In der Folge wird das an der Oberfläche von Mastzellen gebundene IgE nicht kreuzvernetzt und die Mastzelle nicht aktiviert (Abb.1B). Es werden keine präformierten Mediatoren, wie z.B. Histamine, ausgeschüttet, die für die sofort eintretenden allergischen Symptome verantwortlich sind.
Monoklonale Antikörperzur Allergietherapie – passive Immuntherapiemöglich?
Vor Kurzem sind zwei Studien erschienen, die bestätigt haben, dass spezifische, blockierende Antikörper allergische Symptome reduzieren können. Es wurden erstmalig spezifische, humane, monoklonale Antikörper gegen das Katzenhauptallergen Feld14 sowie gegen das Hauptallergen in Birkenpollen Betv15betroffenen Allergikern verabreicht und die längerfristige Auswirkung auf allergische Reaktionen in Provokationstestungen untersucht.
Die in diesen Studien eingesetzten monoklonalen Antikörper (mAK) wurden durch Immunisierung von sog. VelocImmune-Mäusen mit rekombinantem Feld1 bzw. nativem Betv1 hergestellt. Dieser Mausstamm trägt humane Immunglobulingene und produziert somit humane Antikörper. Nach intensivem Screening wurden die Antikörper mit der höchsten Bindungskapazität an das Allergen identifiziert und als rekombinante IgG4-Antikörper hergestellt. Hochaffine Antikörper, die unterschiedliche Bindungsstellen auf den Allergenen (Epitope) erkannt haben, wurden dann einzeln sowie in Kombination in einem passiven kutanen Anaphylaxiemausmodell auf ihre blockierende Wirkung untersucht. Im Prinzip entsprechen diese Experimente denen von Mary Hewitt Loveless, wobei es heutzutage ethisch nicht mehr möglich wäre, hierfür Nichtallergiker einzusetzen. Transgene Mäuse, die den humanen FcεRI auf ihren Mastzellen exprimieren, wurden durch intradermale Injektion von Allergikerseren passiv sensibilisiert, was bedeutet, dass allergenspezifische IgE-Antikörper über FcεRI an Mastzellen gebunden werden. Nach intravenöserVerabreichung des Allergens zusammen mit dem Farbstoff „Evans-Blau“ kann die IgE-vermittelte Sofortreaktion durch den Austritt des Farbstoffes aus den Gefäßen ins Gewebe gemessen werden. In diesem präklinischen Mausmodell wurde beobachtet, dass einzelne mAK keine ausreichende blockierende Wirkung zeigen. Durch die Kombination von zwei Feld1- bzw. drei Betv1-spezifischen Antikörpern mit unterschiedlicher Epitopspezifität konnte eine starke blockierende Aktivität gegen das jeweilige Allergen erreicht werden.4,6
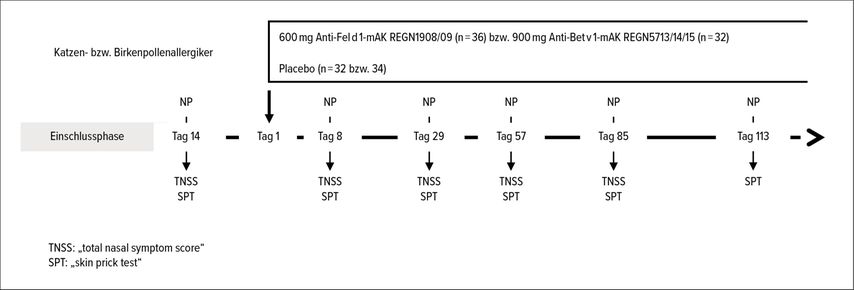
Diese mAK-Kombinationen wurden dannin Pilotstudien bei ca. 70 Katzen- bzw. Birkenpollenallergikern eingesetzt (Abb. 2).Den aktiven Gruppen wurden einmalig entweder 600mg einer Kombination aus zwei Anti-Feld-1-mAK (REGN1908/09) bzw. 900mg einer Kombination aus drei Anti-Bet-v-1-mAK (REGN5713/14/15) subkutan verabreicht. Die Placebogruppen erhielten nicht allergenspezifische Kontrollantikörper desselben Isotyps. Vor und in regelmäßigen Abständen nach der Verabreichung wurden nasale Provokationen mit den jeweiligen Allergenextrakten durchgeführt und die klinischen Reaktionen gemessen.
Abb. 2: Studienprotokoll der Pilotstudien mit allergenspezifischen, blockierenden Antikörpern: Katzen- bzw. Birkenpollenallergiker wurden rekrutiert, nach strikten Einschlusskriterien ausgesucht, nasal mit Allergen provoziert und danach in Behandlungs- und Placebogruppen randomisiert. Nach einmaliger, subkutaner Injektion der Gemische von allergenspezifischen, monoklonalen IgG4-Antikörpern wurden die Provokationen in regelmäßigen Abständen wiederholt. Die Symptome wurden anhand des „total nasal symptom score“ (TNSS) ausgewertet. Ebenso wurden regelmäßig „Prick“-Testungen an der Haut durchgeführt
In beiden Studien zeigten die aktiven Gruppen im Vergleich zur Placebogruppe eine signifikante Verminderung der allergischen Symptome. Diese hielt bei den Katzenallergikern bis zu 85 Tage und bei den Birkenpollenallergikern bis zu 29 Tage nach Verabreichung an. Parallel dazu waren die Reaktionen in Hauttestungen in den aktiven Gruppen signifikant schwächer als in den Placebogruppen. Die In-vivo-Halbwertszeit der drei Bet-v-1-spezifischen monoklonalen Antikörper wurde mit 25 bis 36 Tagen nachgewiesen und war bei Birkenpollenallergikern und Nichtallergikern gleich.
Fazit
Die Hypothese, dass hochaffine, allergenspezifische IgG-Antikörper zur Verminderung von IgE-vermittelten allergischen Reaktionen eingesetzt werden können, wurde in zwei Allergiemodellen, der ganzjährigen Katzenallergie sowie der saisonalen Birkenpollenallergie, bewiesen. Beide Studien zeigten, dass eine einmalige Injektion von Gemischen aus blockierenden Antikörpern zur längerfristigen Verbesserung der Allergie führt. Somit stellt eine passive Immuntherapie mit solchen mAK eine interessante Alternative zur herkömmlichen ASIT dar, v.a. für Allergien, für die keine wirksame ASIT existiert, wie z.B. für Tierhaarallergien.
Selbstverständlich bleiben noch einige Fragen offen. Beide Studien haben Allergiemodelle gewählt, in denen es nur ein Hauptallergen gibt. Ein Erfolg wurde nur mit Kombinationen aus verschiedenen, hochaffinen mAK erzielt. Hier stellt sich die Frage, wie viele verschiedene mAK für die erfolgreiche Behandlung von Allergien, bei denen mehrere Hauptallergene existieren, eingesetzt werden müssen. Ebenfalls ist noch nicht geklärt, wie häufig die mAK verabreicht werden müssen und ob es Nebenwirkungen gibt. Außerdem ist davon auszugehen, dass die passive Immuntherapie zu keiner maßgeblichen Veränderung der allergenspezifischen T-Zell-Antwort führen wird. Diese Veränderung könnte aber für den Therapieerfolg bei allergischem Asthma maßgeblich sein, bei dem allergenspezifische T-Zellen eine wichtige Rolle spielen und welches häufig bei Tierhaarallergikernauftritt. Es ist also noch einiges bezüglich neuer Formen in der Allergiebehandlung in Zukunft zu erwarten!
Literatur:
1 Cooke RA et al.: Studies on immunity in a type of human allergy (hay fever): serologic response of non-sensitive individuals to pollen injections. J Exp Med 1937; 66(6): 689-96 2 Loveless MH: Immunological studies of pollinosis: I. The presence of two antibodies related to the same pollen-antigen in the serum of treated hay-fever patients. J Immunology 1940; 38(1): 25-50 3 Flicker S, Valenta R: Renaissance of the blocking antibody concept in type I allergy. Int Arch Allergy Immunol 2003; 132(1): 13-24 4 Orengo JM et al.: Treating cat allergy with monoclonal IgG antibodies that bind allergen and prevent IgE engagement. Nat Commun 2018; 9(1): 1421 5 Gevaert P et al.: Novel antibody cocktail targeting Betv1 rapidly and sustainably treats birch allergy symptoms in a phase 1 study. J Allergy Clin Immunol 2021; doi: 10.1016/j.jaci.2021.05.039 6 Atanasio A et al.: Targeting immunodominant Betv1 epitopes with monoclonal antibodies prevents the birch allergic response.J Allergy Clin Immunol 2021; doi:10.1016/j.jaci.2021.05.038
Das könnte Sie auch interessieren:
ILD und ILA: von der Früherkennung zur personalisierten Nachsorge
Das Erkennen interstitieller Lungenanomalien (ILA) als potenzielle Frühstadien interstitieller Lungenerkrankungen (ILD) und die gezielte Identifikation von Hochrisikopatient:innen ...
Seltene pulmonale Mykosen: Reisemitbringsel oder doch schon heimisch?
Endemische systemische Mykosen werden überwiegend durch Schimmelpilze verursacht, die im menschlichen Organismus charakteristische Hefeformen annehmen. Klima- und Landnutzungswandel ...