Infektiöse respiratorische Erkrankungen bei immundefizienten Patienten
Autoren:
Dr. med. Holger Flick
Klinische Abteilung für Pulmonologie
Medizinische Universität Graz
E-Mail: holger.flick@medunigraz.at
Dr. med. Emina Talakic
Universitätsklinik für Radiologie
Medizinische Universität Graz
E-Mail: emina.talakic@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Immunsupprimierte Patienten haben ein erhöhtes Infektionsrisiko und stellen die behandelnden Ärzte sowohl vor diagnostische als auch therapeutische Herausforderungen. Besonders im ambulanten Bereich ist die Gefahr, dass solche Patienten eine Pneumonie erwerben, erhöht.
Der Bevölkerungsanteil immundefizienter Patienten nimmt aus verschiedenen Gründen (steigendes Durchschnittsalter und damit verbunden mehr Komorbiditäten und immunsuppressive Therapien) stetig zu und beträgt in den USA 3%.1 Diese Risikogruppe hat ein erhöhtes Infektionsrisiko, ist aber in vielen Studien unterrepräsentiert und wird in Leitlinien (beispielsweise zur ambulant erworbenen Pneumonie) aufgrund mangelnder Evidenz nicht ausreichend thematisiert. Dieses Defizit ist ein relevantes Problem, da 20–30% aller schweren (hospitalisationsbedürftigen) ambulant erworbenen Pneumonien («community acquired pneumonia»; CAP) immundefiziente Patienten betreffen. In Abhängigkeit vom Schweregrad der Immunsuppression sind im Zusammenhang mit diesen Patienten aus infektiologischer Sicht jedoch spezifische diagnostische und auch therapeutische Überlegungen notwendig.
Dieses Problem adressierte eine internationale Expertengruppe aus den Fachbereichen Infektiologie, Pneumologie, Intensivmedizin und Transplantationsmedizin und veröffentlichte im August 2020 ein auf der Delphi-Methode basierendes Konsensus-Statement zum diagnostischen Management immunsupprimierter CAP-Patienten.2 Ausgewählte Definitionen und Empfehlungen werden im Folgenden erläutert, kommentiert und teilweise ergänzt. Darüber hinaus veröffentlichte das französische Nine-i Investigators Network 2020 eine sehr umfassende Übersichtsarbeit zu diesem Thema.3
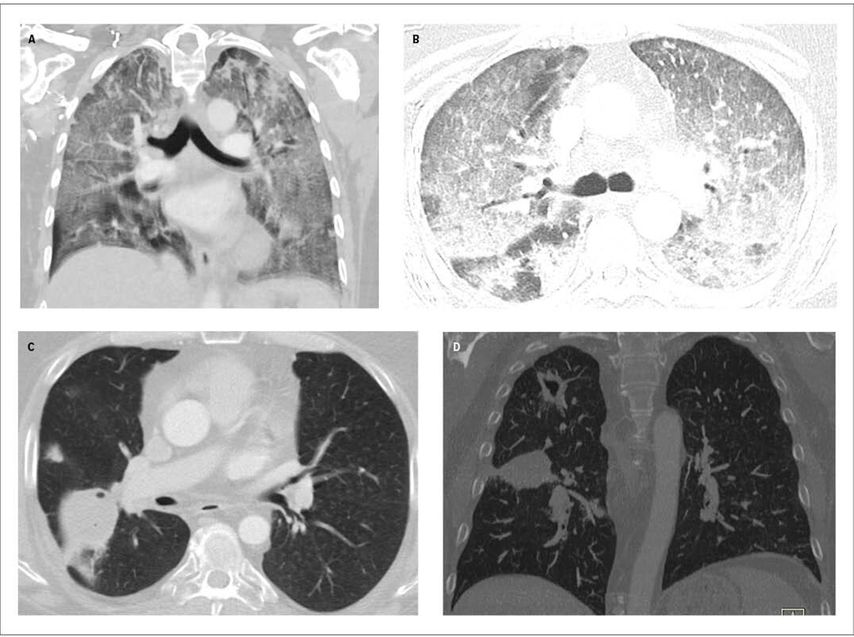
Abb. 1: Infektiöse respiratorische Erkrankungen bei immundefizienten Patienten. A) und B): Pneumocystis-jirovecii-Pneumonie; koronale und axiale CT-Bilder des Thorax: bilateral ausgedehnte milchglasartige Verdichtungen sowie verdickte Septen und noduläre Veränderungen mit teilweise «Crazy paving»-Muster im Rahmen der Pneumocystis-jirovecii-Pneumonie. C) und D): Koronale und axiale CT-Bilder des Thorax demonstrieren kavitierte Läsionen der rechten Lunge im Rahmen einer akuten invasiven Aspergillose
Welche CAP-Patienten gelten als immungeschwächt und welche haben ein Risiko für opportunistische Infektionen?
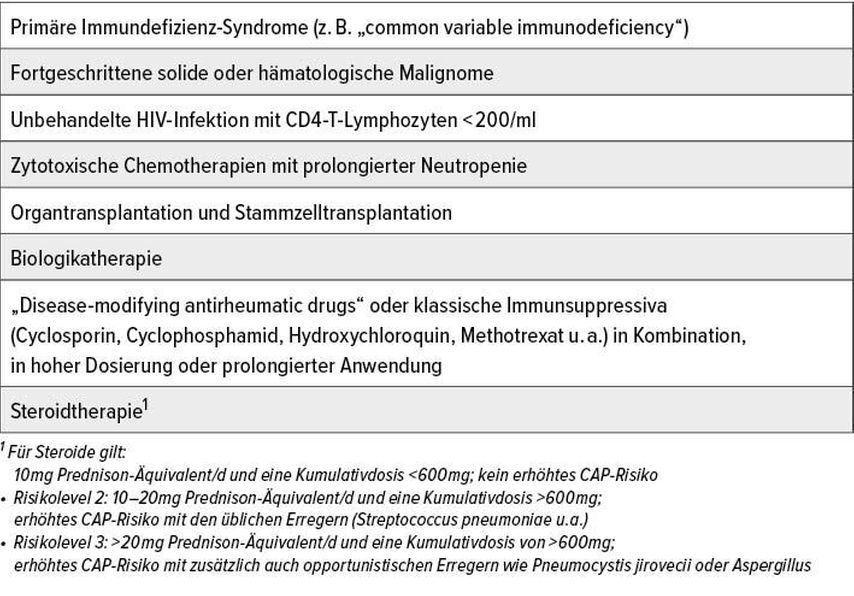
Fast alle Patienten mit einer schweren systemischen Grunderkrankung oder immunsuppressiven Therapie gelten in der Regel als immungeschwächt und haben ein erhöhtes CAP-Risiko. Das Risiko (und auch die Letalitätswahrscheinlichkeit bei CAP) steigt mit dem Alter, der Erkrankungsschwere, der Zahl der Komorbiditäten und der Therapieintensität. Eine Risikoquantifizierung ist im Einzelfall schwierig, aber orientierend möglich. Patienten mit moderater bis schwerer Immunschwäche haben zusätzlich ein erhöhtes Risiko für seltene (opportunistische) Infektionen, was in der Diagnostik und der empirischen Therapie berücksichtigt werden sollte (Tab. 1).
Tab. 1: Häufige Erkrankungen und Therapien, die allein oder in Kombination mit einem relevanten Risiko für opportunistische pulmonale Infektionen assoziiert sind (schwere Immunsuppression)
Welche immunsupprimierten CAP-Patienten müssen hospitalisiert werden?
Prinzipiell sind die allgemeinen CAP-Risikoevaluationsskonzepte anzuwenden (Tab. 2).4 Diese sind jedoch nicht explizit für immunsupprimierte Patienten evaluiert, sodass am Ende situativ entschieden werden muss («clinical judgement»). In der Praxis sollten der CRB-65-Index, der qSOFA-Score, die SpO2, instabile dekompensierte Grunderkrankungen, der Allgemeinzustand sowie soziale Faktoren berücksichtigt werden, in der Notaufnahme zusätzlich die modifizierten Minorkriterien der ATS (American Thoracic Society) und IDSA (Infectious Diseases Society of America) sowie radiologische und laborchemische Befunde. Im Zweifelsfall sollte die Schwelle zur Hospitalisierung bei immunsupprimierten CAP-Patienten niedriger sein als bei anderen Patienten («low threshold for hospital admission»). Fällt die Entscheidung gegen eine Hospitalisierung, ist eine kurzfristige ambulante klinische Kontrolle zu empfehlen.
Tab. 2: Indikatoren für eine Hospitalisierung (u.a. basierend auf CRB-65-Index und den modifizierten ATS/IDSA-Minorkriterien) (modifiziert nach Ewig S et al. 2016)4
Welche Erreger sind bei immunsupprimierten Patienten zu erwarten?
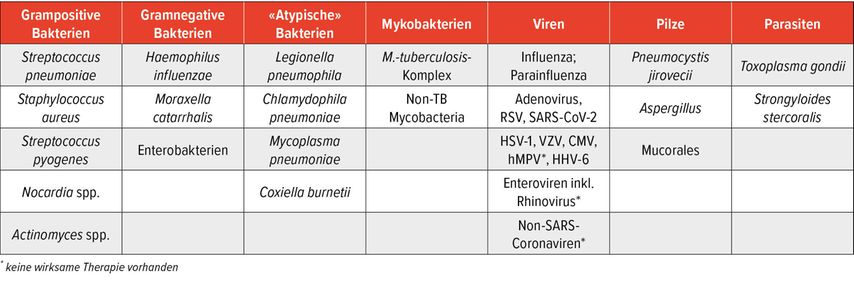
Neben den üblichen CAP-Erregern ist besonders bei schwer immunsupprimierten Patienten (Tab. 1) auch mit opportunistischen Erregern zu rechnen (Tab. 3). Die Diagnostik soll auf die Erreger fokussiert werden, für die eine wirksame Therapie existiert (z.B. Legionella) oder deren Nachweis zumindest eine krankenhaushygienische Konsequenz haben kann (z.B. RSV). Dagegen können teilweise häufige virale CAP-Erreger in der Diagnostik sogar ignoriert werden (z.B. Rhinoviren und Non-SARS-CoV-2-Viren, da keine wirksame Therapie verfügbar und krankenhaushygienisch nicht relevant). Bezüglich der Herpesviren sind in der Regel nur HSV-1, HHV-6, CMV und VZV relevant, aber auch nur, wenn zusätzlich eine Virämie besteht. Eine HSV-2-Pneumonie ist eine absolute Rarität (weltweit <10 Fallberichte; Tab.4).
Tab. 3: Normale und opportunistische CAP-Erreger bei schwer immunsupprimierten Patienten in Mitteleuropa
Welche Erregerdiagnostik ist bei immunsupprimierten Patienten sinnvoll?
Ziel der nicht invasiven Erregerdiagnostik ist eine rasche Identifizierung des ursächlichen Erregers, um eine Deeskalation oder frühzeitige Korrektur der empirischen Therapie zu ermöglichen beziehungsweise krankenhaushygienisch relevante Erreger zu identifizieren (Tab. 4).
Bei einigen schwer immunsupprimierten Patienten sollte vor allem bei klinischer Instabilität, negativer noninvasiver Diagnostik, unspezifischen radiologischen Befunden und möglicherweise multiplen Erregern frühzeitig eine Bronchoskopie erwogen werden (ggf. auch als Notfalluntersuchung noch vor Einleitung der antiinfektiven Therapie oder im Verlauf zum Ausschluss von Erregern, die mit der empirischen Therapie nicht erfasst wurden). Die Indikation und der Zeitpunkt der Bronchoskopie sind individuell festzulegen, abhängig von der klinischen Situation und oft auch von den akut verfügbaren Bronchoskopiekapazitäten. Vor der Bronchoskopie sollte eine Thorax-CT durchgeführt werden. Bei schnell verfügbarer Bronchoskopie und stabilen Patienten ist eine kurze Verzögerung der empirischen Therapie ggf. akzeptabel, damit zuvor die bronchoskopische Diagnostik erfolgen kann. Die Bronchoskopie sollte von einem erfahrenen Team durchgeführt werden, da bei kritisch kranken Patienten (vor allem bei schwerer Hypoxie) die Bronchoskopie mit einer erhöhten Mortalität assoziiert sein kann.3,12
Literatur:
1 Harpaz R et al.: Prevalence of immunosuppression among US adults, 2013. JAMA 2016; 316: 2547-8 2 Julio AR et al.: Treatment of community-acquired pneumonia in immunocompromised adults: a consensus statement regarding initial strategies. Chest 2020; 158: 1896-11 3 Azoulay E et al.: Diagnosis of severe respiratory infections in immunocompromised patients. Intensive Care Med 2020; 46: 298-314 4 Ewig S et al.: Behandlung von erwachsenen Patienten mit ambulant erworbener Pneumonie und Prävention – Update 2016. Pneumologie 2016; 70: 151-200 5 Matthes-Martin S et al.: European guidelines for diagnosis and treatment of adenovirus infection in leukemia and stem cell transplantation: summary of ECIL-4 (2011). Transpl Infect Dis 2012; 14:555-63 6 Papazian L: Cytomegalovirus reactivation in ICU patients. Intensive Care Med 2016; 42: 28-37 7 Mirouse A et al.: Severe varicella-zoster virus pneumonia: a multicenter cohort study. Critical Care 2017; 21: 137 8 Calore EE: Herpes simplex type 2 pneumonia. Braz J Infect Dis 2002; 6: 305-8 9 Gasparetto EL et al.: Herpes simplex virus type 2 pneumonia after bone marrow transplantation high-resolution CT findings in 3 patients. J Thorac Imaging 2005; 20: 71-3 10 Furrer H et al.: Herpes simplex type 2 pneumonia in an Aids patient. Schweiz Med Wochenschr 1989; 119: 1275-8 11 Short WR et al.: Fatal herpes simplex virus type 2 pneumonia in a person with AIDS. AIDS Read 2009; 19; 51-2: 60-1 12 Bauer PR et al.: Diagnosis and outcome of acute respiratory failure in immunocompromised patients after bronchoscopy. Eur Respir J 2019; 54: 1802442
Das könnte Sie auch interessieren:
Allergologische Diagnostik von Überempfindlichkeitsreaktionen auf Arzneimittel
Ungefähr 10% der Allgemeinbevölkerung berichten von unerwünschten Arzneimittelreaktionen, welche sich allerdings nur in weniger als 10% der Fälle diagnostisch verifizieren lassen. ...
Mukoviszidose – eine Erkrankung mit Prädisposition für Pilzinfektionen
Pilzinfektionen stellen eine zunehmende Herausforderung in der Behandlung von Menschen mit Mukoviszidose (zystische Fibrose) dar. Spezifische diagnostische Schritte und therapeutische ...