Aktueller Stand der Forschung, Impact der antibiotischen Therapie und Ausblick für die Klinik
Autorin:
Prof. Dr. Hortense Slevogt
Klinik für Innere Medizin I
Universitätsklinikum Jena
E-Mail: hortense.slevogt@med.uni-jena.de
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Obwohl die COPD in der Häufigkeit weltweit zunimmt, sind die genauen pathologischen Mechanismen, die dieser Erkrankung zugrundeliegen, noch immer nicht vollständig geklärt. Auch im Hinblick auf die Unterschiede zwischen sich oft überlappenden klinischen Phänotypen gibt es immer mehr Hinweise darauf, dass das Vorhandensein von Lungenmikrobiota die Pathogenese und den Verlauf der Erkrankung beeinflussen kann. Daher kann die Charakterisierung der Lungenmikrobiota ein neues Licht auf die Pathogenese der COPD werfen.
Keypoints
-
Der Studienkonsens zeigt: Auch die unteren Atemwege des Gesunden sind mit Mikrobiota besiedelt.
-
Spezieszusammensetzung und Menge des Mikrobioms stehen mit der Pathogenese der COPD in Verbindung.
-
Eine verminderte Diversität an Mikroben in den unteren Atemwegen erhöht das Risiko für COPD-Exazerbationen.
-
Bestimmte Verlaufsformen der COPD sind mit einer charakteristischen Zusammensetzung des Mikrobioms assoziiert, die sich durch ICS-Therapien und Antibiotikaresistenzgene verändern kann.
-
Es besteht eine direkte Wechselwirkung zwischen dem Lungenmikrobiom und dem transkriptionellen Profil des Lungenepithels.
Das Lungenmikrobiom
Es wurde lange angenommen, dass die Atemwege distaldes Larynx aufgrund der verschiedenen Schutzfunktionen in den Atemwegen steril sind. Dieses Konzept beruhte auf der Identifikation von Mikroorganismen mit Hilfe von standardisierten Kultivierungstechniken von Bakterien. Die meisten in der Lunge vorkommenden Mikroorganismen sind jedoch schwer oder nichtkultivierbar und damit nicht nachweisbar. Durch Ergebnisse in neueren Studien, in denen die nichtkulturabhängigen Methoden des Next-GenerationSequencing (NGS) zur Anwendung kamen, ist es inzwischen Konsens, dass auch die unteren Atemwege des Gesunden mit Mikrobiota, d.h. Bakterien, Archaea, Pilzen, Protozoen und Viren, besiedelt sind. Das Lungenmikrobiom bezeichnet die Gesamtheit aller bakterieller DNS, die in der Lunge nachweisbar ist. Es wird in den meisten Studien aus Bronchiallavageflüssigkeit (BALF) oder von Material, welches während der Bronchoskopie mittels geschützter Bürste („protectedspecimenbrush“, PSB) aus den Bronchien entnommen wurde, untersucht. Obwohl die Menge der so identifizierten Bakterien in der Lunge gering ist, wurden im Rahmen des „humanemicrobiome project“ in der Lunge gesunder Menschen über 100 Bakterienarten entdeckt.1 Die mit der größten Häufigkeit nachgewiesenen Phylae des Lungenmikrobioms sind Firmicutes, Bacteroidetes und zu einem geringeren Anteil Proteobacteria. Als Typusgattungen sind Prevotella, Streptococcus und Veillonella sowie Haemophilus spp. am häufigsten nachweisbar.
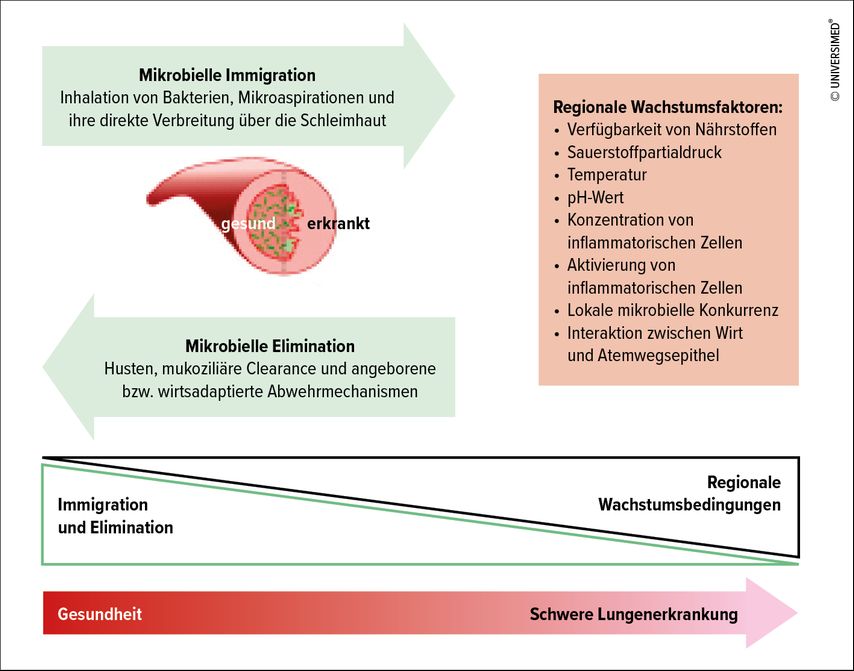
Die Zusammensetzung der Lungenmikrobiota wird durch eine Vielzahl ökologischer Bedingungen wie Nahrungsangebot, pH-Wert, Temperatur, Sauerstoffgehalt etc. mit beeinflusst. Dabei konnte gezeigt werden, dass das Lungenmikrobiom des Gesunden aus Keimen, die durch Aspiration aus dem oberen Respirationstrakt und hier insbesondere aus dem Oropharynx sowie aus Keimen, die durch gastrale Reurgitationen in die Lunge gelangen, zusammengesetzt ist.3 Beim Gesunden kommtes jedoch nicht zu einer direkten Kolonisierung und damit einer Vermehrung von Mikroben im unteren Respirationstrakt, sondern es besteht ein Gleichgewicht von in die Atemwege eindringendenMikroorganismen, die durch Mechanismen wie insbesondere die mukoziliäre Clearance wieder aus den Atemwegen hinausbefördert werden (Abb.1).1
Bei der mukoziliären Clearance handelt es sich um ein effektives Zusammenspiel zwischen Zilien tragenden Atemwegsepithelien und einem muzinreichen Schleimfilm, der von den sekretorischen Atemwegsepithelien gebildet wird und die Oberfläche des Atemwegsepithels bedeckt. Beide mosaikartig zueinander angeordneten Zellarten kleiden die Trachea und die Bronchien aus. Die Zilien des Flimmerepithels befördern den sezernierten Schleim, sodass ein kontinuierlicher, oralwärts gerichteter Schleimstrom entsteht, der eingedrungene Partikel und Mikroorganismen zum Rachen befördert, wo sie verschluckt werden. Für die Funktionsfähigkeit dieses Mechanismus sind die Konsistenz und die Menge des produzierten Schleimes sowie dessen pH-Wert und Salzgehalt von großer Bedeutung. Es ist davon auszugehen, dass es sich bei den meisten in der gesunden Lunge nachweisbaren Mikroorganismen um eine transiente Besiedelung handelt, bei welcher sich Immigration und Eliminierung von Mikroorganismen die Waage halten.
Somit ist in den tiefen Atemwegen ein zu jedem Zeitpunkt nachweisbares charakteristisches, jedoch in seiner Menge um ein Vielfaches geringeres Mikrobiom als im Oropharynx nachweisbar (Huffnagle et al., 2017).4
Das Lungenmikrobiom bei Patienten mit COPD
In verschiedenen Studien konnte gezeigt werden, dass die Spezieszusammensetzung und die Menge des bakteriellen Lungenmikrobioms mit der Pathogenese der chronisch obstruktiven Lungenerkrankung (COPD) in Zusammenhang stehen. Dabei wird davon ausgegangen, dass es im Rahmen der COPD zu pathologischen Veränderungen in den Atemwegen und der Lunge mit der Ausbildung eines sogenannten Lungenpathobioms kommt. Verschiedene Arbeiten berichten darüber, dass eine verminderte Diversität der Mikroben in den tiefen Atemwegen mit einer häufigeren Exazerbation der COPD assoziiert ist.5,6 Dabei war insbesondere der vermehrte Nachweis von Moraxella mit einem 2,6-mal größeren Risiko einer Exazerbation verbunden.5 Es wurde außerdem gezeigt, dass die pulmonale mikrobielle Diversität negativ mit dem Grad einer Emphysembildung korrelierte.7
Über die Menge, Diversität und Zusammensetzung des Mikrobioms bei COPD-Patienten gibt es in der Literatur auch widersprüchliche Ergebnisse. Zum Beispiel zeigten die Ergebnisse der MICROCOPD-Studie, dass die Zusammensetzung des Lungenmikrobioms bei COPD-Patienten mit und ohne Exazerbationen einer zu hohen interindividuellen Varianz unterlagen und sich daher die Ergebnisse für die Vorhersage von Exazerbationen anhand von Veränderungen des Lungenmikrobioms bei diesen Patienten nicht eigneten.8
In einer aktuellen und der bisher größten Studie verglichen die Autoren das Lungenmikrobiom bei COPD-Patienten im Hinblick auf mögliche modulatorische Effekte, die durch den therapeutischen Einsatz einer inhalativen Steroidtherapie (ICS) bedingt sein könnten. Ihre Ergebnisse zeigen, dass in den Atemwegen ein verminderter Nachweis von Prevotella und ein erhöhter Nachweis von Moraxella mit einer zunehmenden Schwere der COPD in Beziehung stand. Bei Patienten mit COPD, die mit ICS behandelt wurden, war die Prevotellahäufigkeit positiv assoziiert mit der Herunterregulation von Genen in den Atemwegsepithelien, die die epitheliale Abwehr fördern, und mit einer Hochregulierung von proinflammatorischen Genen.9 Die Ergebnisse dieser Studie belegen damit auch die direkten Wechselwirkungen des Lungenmikrobioms mit dem transkriptionellen Profil der Atemwegsepithelien.
In einer weiteren Arbeit wurden Mikrobiomzusammensetzungen in der BAL von COPD-Patienten mit Parametern der Lungenfunktion verglichen.10 Die Autoren konnten zeigen, dass auch das Ansprechen der Bronchodilator-Responsiveness (BDR) sowie des exspiratorischen Spitzenflusses in den kleinen Atemwegen mit Veränderungen der Zusammensetzung des Mikrobioms assoziiert war. Diese Studie zeigt, dass eine Differenzierung einer bestimmten COPD-Verlaufsform, in der ein Asthma in der Pathogenese eine Rolle spielt, auch mit einer charakteristischen Zusammensetzung des Mikrobioms in Verbindung gebracht werden kann.
Auch das Vorkommen von Antibiotikaresistenzgenen bei COPD-Patienten kann die Zusammensetzung der Lungenmikrobiota beeinflussen. In einer großen Studie konnte kürzlich gezeigt werden, dass die Mikrobiota in den Atemwegen ein bestimmtes Muster von darin vorhandenen Antibiotikaresistenzgenen zeigten.11 Insbesondere werden diese von gegen Makrolide gerichtete Resistenzgenen dominiert, es waren aber auch vermehrt Betalaktam-, Fluorchinolon- und Tetrazyklin-Resistenzgene nachweisbar. Es ist anhand dieser Ergebnisse denkbar, dass Antibiotikatherapien und die Präsenz von Resistenzgenen die Zusammensetzung der Mikrobiota in den Atemwegen ebenfalls mit beeinflussen.
Ausblick
Als Ausblick auf die weiteren Ziele für die Erforschung des Mikrobioms ist es wichtig, die Heterogenität der Verlaufsformen der COPD zu betrachten und Differenzierungen zwischen den unterschiedlichen phänotypischen Krankheitsformen der COPD in die Analysen miteinzubeziehen.
Außerdem basiert die Analyse des Mikrobioms in den bisherigen Studien fast ausschließlich auf der 16s-rRNA-Sequenzierung, die lediglich die Bestimmung der vorhandenen Taxa ermöglicht. Für weitere funktionelle Analysen ist es wichtig, metagenomische, transkriptomische und metabolomische Ansätze mit in die Forschungsansätze zu integrieren, um auch die Funktion der nachgewiesenen Mikroorganismen zu spezifizieren und um diese dann mit der Pathogenese der COPD in Verbindung bringen zu können. Durch die zunehmenden Möglichkeiten, auch das Vireom und das Fungeom zu analysieren, ist eine Integration auch dieser wichtigen Komponenten erforderlich, um das Gesamtbild der Mikrobiota in der Lunge zu komplettieren.
Fazit
Durch die Differenzierung möglichst vieler Aspekte der klinischen Komplexität der Erkrankung und durch eine möglichst umfassende Analyse des damit assoziierten Lungenmikrobioms eröffnen sich in Zukunft neue Möglichkeiten, dessen Rolle für die Pathogenese der COPD besser zu verstehen. Diese Erkenntnisse können eine vielversprechende Grundlage für die mögliche Entwicklung innovativer Ansätze darstellen, die darauf abzielen, das Lungenmikrobiom spezifisch zu modulieren, um damit den Verlauf der COPD günstig zu beeinflussen.
Literatur:
1 Dickson RP et al.: The microbiome and the respiratory tract. Annu Rev Physiol 2016; 78: 481-504 2 Dickson RP et al.: The role of the microbiome in exacerbations of chronic lung diseases. Lancet 2014; 384(9944): 691-702 3 Bassis CM et al.: Analysis of the upper respiratory tract microbiotas as the source of the lung and gastric microbiotas in healthy individuals. mBio 2015; 6(2): e00037 4 Huffnagle GB et al.: The respiratory tract microbiome and lung inflammation: a two-way street. Mucosal Immunol 2017; 10(2): 299-306 5 Mayhew D et al.: Longitudinal profiling of the lung microbiome in the AERIS study demonstrates repeatability of bacterial and eosinophilic COPD exacerbations. Thorax 2018: 73(5): 422-30 6 Pragman AA: Chronic ob-structive pulmonary disease upper airway microbiota alpha diversity is associated with exacerbation phenotype: a case-control observational study. Respir Res 2019; 20(1): 114. 7 Sze MA et al.: Host response to the lung microbiome in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2015; 192(4): 438-45 8 Leiten EO et al.: The airway microbiota and exacerbations of COPD. ERJ Open Res 2020; 6: 00168-2020 9 Ramsheh MY et al.: Lung microbiome composition and bronchial epithelial gene expression in patients with COPD versus healthy individuals: a bacterial 16S rRNA gene sequencing and host transcriptomic analysis. Lancet Microbe 2021; 2(7): e300-e310 10 Opron K et al.: Lung microbiota associations with clinical features of COPD in the SPIROMICS cohort. NPJ Biofilms Microbiomes 2021; 7(1): 14 11 Mac Aogáin M et al.: Metagenomics reveals a core macrolide resistome related to microbiota in chronic respiratory disease. Am J Respir Crit Care Med 2020; 202(3): 433-47
Das könnte Sie auch interessieren:
ILD und ILA: von der Früherkennung zur personalisierten Nachsorge
Das Erkennen interstitieller Lungenanomalien (ILA) als potenzielle Frühstadien interstitieller Lungenerkrankungen (ILD) und die gezielte Identifikation von Hochrisikopatient:innen ...
Seltene pulmonale Mykosen: Reisemitbringsel oder doch schon heimisch?
Endemische systemische Mykosen werden überwiegend durch Schimmelpilze verursacht, die im menschlichen Organismus charakteristische Hefeformen annehmen. Klima- und Landnutzungswandel ...