20 Jahre JATROS Pneumologie – 20 Jahre COPD
Bericht:
Dr. Katrin Spiesberger
Die Entwicklung des Wissens über COPD und ihre Komponenten – Emphysem, chronische Bronchitis und asthmatische Bronchitis – erstreckt sich über 200 Jahre. Das Stethoskop und das Spirometer wurden schon früh zu wichtigen Instrumenten der Diagnose und Beurteilung. In den letzten 20 Jahren hat sich vor allem im Bereich der medikamentösen COPD-Behandlung einiges getan.
Die chronisch obstruktive Lungenerkrankung (COPD) ist heute eine der drei häufigsten Todesursachen weltweit, und 90% dieser Todesfälle treten in Ländern mit niedrigem bis mittlerem Einkommen auf. COPD stellt also für die öffentliche Gesundheit eine wichtige Herausforderung dar, die sowohl vermeidbar als auch behandelbar ist. COPD ist eine der Hauptursachen für chronische Morbidität und Mortalität und es wird prognostiziert, dass diese aufgrund der anhaltenden Exposition gegenüber COPD-Risikofaktoren und der Alterungder Bevölkerung zunehmen wird.1 Die frühzeitige Erkennung und Vorbeugung sowie die Behandlung der sich abzeichnenden Krankheitsstadien sind daher essenziell.
Die Spirometrie ist nach wie vor das wirksamste Mittel zur Erkennung und Beurteilung des Verlaufs der COPD und des Ansprechens auf die Therapie, wird aber auch in Österreich nur unzureichend eingesetzt. Das Wissen über die Pathogenese, den Verlauf und die Prognose sowie neue Therapieansätze haben unser Verständnis dieser wichtigen klinischen Entität jedoch erheblich verbessert, sodass dieser fortschreitenden Erkrankung zumindest entschlossen entgegengetreten werden kann.
200 Jahre zuvor
Die Anfänge unseres klinischen Verständnisses der chronischen Bronchitiskomponente der COPD gehen auf Badham zurück, der bereits zu Beginn des 18. Jahrhunderts das Wort „Katarrh“ für den chronischen Husten verwendete und die Schleimhypersekretion als Kardinalsymptom erkannte.2, 3
Eine bahnbrechende Entwicklung war die Erfindung des Spirometers durch John Hutchinson im Jahr 1846, das für die Diagnose und Behandlung der COPD von zentraler Bedeutung ist. Das Instrument von Hutchinson maß allerdings nur die Vitalkapazität.2, 4 Es dauerte weitere 100 Jahre, bis Tiffeneau das Konzept der zeitlichen Vitalkapazität als Maß für den Luftstrom hinzufügte und die Spirometrie als Diagnoseinstrument so vervollständigte.5Gaensler führte auf der Grundlage der Arbeiten von Tiffeneau das Konzept des Luftgeschwindigkeitsindex und später der forcierten Vitalkapazität ein, das die Grundlage für die Maßeinheiten FEV1 und FEV1/FVC in Prozent bildet.6, 7
In den darauffolgenden Jahren wurden zahlreiche wissenschaftliche Konferenzen zum Thema COPD abgehalten, die einerseits die Grundlagen für unsere heutigen Definitionen bilden, andererseits neue Konzepte für die Behandlung des akuten Lungenversagens, die häusliche Pflege und Rehabilitation, die derzeit verwendeten pharmakologischen Wirkstoffe und das Konzept des ambulanten Sauerstoffs bei der Behandlung der fortgeschrittenen COPD vorstellten.2
Die Entdeckung des natürlichen Verlaufs der COPD
Ab 1965 beschäftigten sich verschiedenste Forschungsgruppen mit den Mechanismen, die hinter der COPD stecken. Unter Verwendung eines künstlichen Thorax zur Beatmung frischer postmortaler Lungen konnten Forscher zahlreiche physiologische Indizes messen, darunter FEV1, FVC, den maximalen mittleren exspiratorischen Fluss, Restvolumen und Stickstoffauswaschung, um die physiologische Ausprägung von Läsionen der kleinen Atemwege zu untersuchen.8–10 Damals konnte gezeigt werden, dass ein dynamischer Atemwegskollaps der zentralen Atemwege mit einer Verringerung des FEV1 verbunden ist.
Auch das Rauchen als „Ursache des Übels“ wurde identifiziert: Charles Fletcher widmete sein Leben der Erforschung des natürlichen Verlaufs der COPD. Er erkannte die Risiken des Rauchens und den beschleunigten Rückgang des FEV1 bei symptomatischen Rauchern11 – hingegen auch, dass ein Rauchstopp die Geschwindigkeit des FEV1-Rückgangs verlangsamt.12 Damit wurde die wissenschaftliche Grundlage für die Raucherentwöhnung in jedem Krankheitsstadium geschaffen.
Ab den 80er-Jahren war dann klar: Der natürliche Verlauf der COPD beginnt mit komplexen biochemischen und zellulären Vorgängen in den kleinen Atemwegen und den angrenzenden Alveolen. Früh im Verlauf führt die Schädigung der Struktur zu einem Verlust des elastischen Rückstoßes.9 Die Lunge beginnt sich zu vergrößern, und die FVC nimmt zu.2, 9 Dies führt zu frühen physiologischen Veränderungen, die durch einfache Spirometrie leicht festgestellt werden können.13
Erst ab den 1990er-Jahren wurde die COPD als systemische Erkrankung wahrgenommen, die einen Risikofaktor für die Entwicklung von Komorbiditäten wie z.B. kardiovaskulären Erkrankungen, aber auch Osteoporose darstellt.2
Behandlung damals und heute
Vor 50 Jahren waren die einzigen Therapien für COPD Antibiotika gegen Lungenentzündung, Kaliumjodid als Schleimlöser und Kombinationspräparate, die Ephedrin, eine kleine Menge Theophyllin und eine geringe Menge eines Beruhigungsmittels gegen die Nebenwirkungen von Ephedrin enthielten.2 In den frühen 1960er-Jahren begann man, Isoproterenol zu inhalieren. Damals galt Sauerstoff als kontraindiziert, und Sport war aus Angst vor einer Überlastung des rechten Herzens verboten. Kortikosteroide wurden fast nie eingesetzt, auch nicht bei Exazerbationen der COPD. Eine Arbeit von Noehren aus den frühen 1960er-Jahren gab neue Hoffnung, dass zumindest einige Behandlungen bei Emphysemen von Nutzen sein könnten.14 Darin wurden sowohl medizinische als auch chirurgische Therapieansätze beschrieben.
Heute wird der COPD mit pulmonaler Rehabilitation, dem systematischen Einsatz von bronchoaktiven Medikamenten, aber auch mit Langzeit-Sauerstofftherapie (LTOT) und im schlimmsten Fall Lungenvolumenreduktionschirurgie versucht entgegenzuwirken.
20 Jahre COPD, 20 Jahre GOLD
Ein Meilenstein in der länderübergreifenden Bekämpfung der COPD war die Gründung der Global Initiative of Obstructive Lung Disease (GOLD). Vor fast genau 20 Jahren, im Jahr 2001, wurde von der WHO und dem NHLBI diese Initiative ins Leben gerufen, die sowohl den Diagnose- als auch den Therapiealgorithmus aufgearbeitet hat.15
Die Anfänge
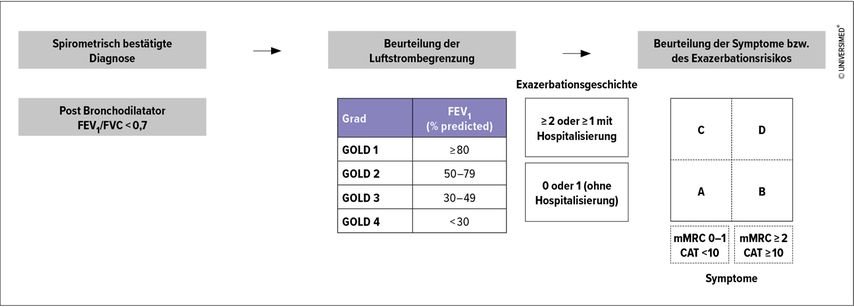
Im ersten GOLD-Bericht 2001 wurde eine neue Klassifizierung des Schweregrads der COPD auf der Grundlage verschiedener FEV1-Schwellenwerte, einschließlich des Vorliegens oder Nichtvorliegens einer chronischen Ateminsuffizienz, zusammen mit wichtigen Therapieempfehlungen eingeführt.15 Zusätzlich zu den vier GOLD-Hauptkategorien (leicht, mittelschwer mit zwei Varianten [a und b] und schwer) gab es die GOLD-0-Stufe „at risk“, die durch das alleinige Vorhandensein von chronischem Husten und Sputum bei normaler Spirometrie definiert war und eine einzigartige Möglichkeit bot, Personen zu identifizieren, die ein erhöhtes Risiko für COPD haben und so mit einer erhöhten Sensibilisierung der Gesundheitsdienstleister einhergehen sollte. Die Behandlung stützte sich bei milder COPD auf SABA, ab der moderaten Stufe kamen weitere Bronchodilatatoren und ICS dazu, aber auch zur pneumologischen Rehabilitation wurde geraten. Bei schwerer COPD wurde im ersten GOLD-Bericht zusätzlich zur LTOT geraten und auch chirurgische Optionen sollten bedacht werden.15
Im zweiten GOLD-Bericht, der 2006 veröffentlicht wurde, basierte die Schweregradeinteilung der COPD weiterhin allein auf den spirometrischen Werten, die im Wesentlichen unverändert blieben. Hervorzuheben ist jedoch, dass GOLD 0 nicht mehr berücksichtigt wurde, da es keine ausreichenden Belege dafür gab, dass Personen, die GOLD 0 erfüllen, zwangsläufig zu GOLD 1 übergehen. Die Bedeutung der Botschaft für die öffentliche Gesundheit, dass das Vorhandensein von Husten und Sputum abnormal ist, blieb jedoch unverändert.15
GOLD 2011- 2022
Der GOLD-Bericht 2011, der 2013 veröffentlicht wurde, stellte eine wesentliche Entwicklung dar, da er zum ersten Mal hervorhob, dass sich die Ziele der COPD-Behandlung auf die von den Patienten angegebenen Hauptergebnisse konzentrieren sollten: Symptome und Exazerbationen. In diesem überarbeiteten Dokument wird eine Bewertung der Symptome, der Lungenfunktion, des Risikos für Exazerbationen und der Komorbiditäten empfohlen. Eine systematische Beurteilung der COPD ist notwendig, um eine ausreichende Qualität des COPD-Managements zu gewährleisten. Hinsichtlich der Symptomerhebung empfahl GOLD die Verwendung des modifizierten Medical Research Council (mMRC) oder des COPD Assessment Test (CAT).15
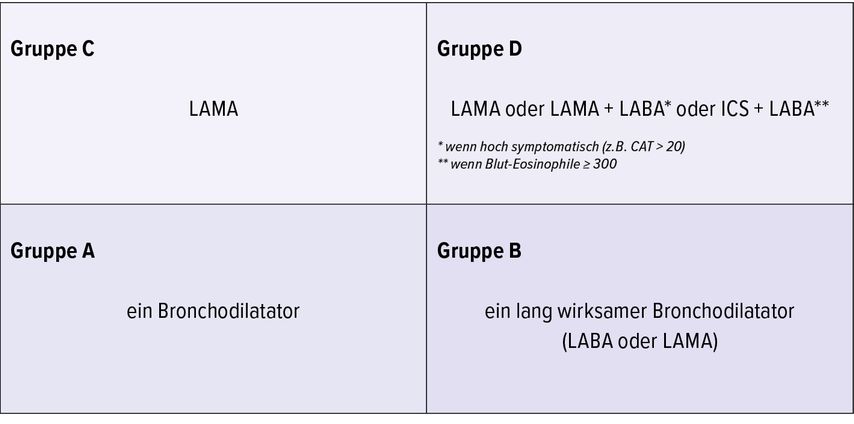
2017 wurde der GOLD-Bericht von 2011 verfeinert. Man erkannte, dass sich die Einschränkung des Luftstroms und das Exazerbationsrisiko in ihrer Vorhersagekraft für das Risiko von Exazerbationen unterscheiden. Daher wurde die spirometrische Bewertung von der Beurteilung der Symptome und der Exazerbationsanamnese getrennt, während die pharmakologische Behandlung nur noch auf den beiden letztgenannten Komponenten beruht (Abb.1 und 2). Mit dem GOLD-Bericht 2017 war der SABA-Einsatz nun endgültig Geschichte und man stützte die Behandlung auf LAMA, LABA und ICS.15
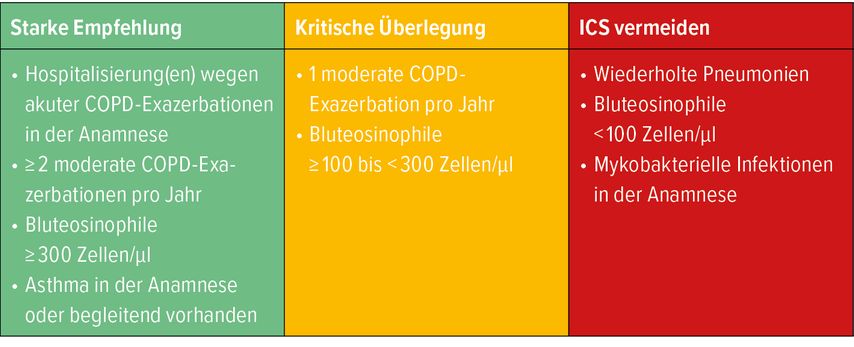
Im aktuellen GOLD-Bericht 2022 werden die COPD-Patienten zusätzlich nun schwerpunktmäßig in Patienten mit Dyspnoe und Patienten mit Exazerbationen eingeteilt. Wenn die initiale pharmakologische Therapie (Abb. 2) nicht greift, wird die Therapie gemäß den Empfehlungen für die beiden Gruppen gehandhabt. Auch für den Einsatz von ICS gibt es nun spezialisierte Empfehlungen, die unter anderem auf dem Eosinophilenwert im Blut basieren (Tab. 1).16
Zukunft der COPD: neue therapeutische Ziele
Die Ätiologie der COPD wird nicht nur durch Umweltnoxen, sondern auch von genetischen und epigenetischen Prädispositionen sowie von pränatalen und frühkindlichen Entwicklungsstörungen der Lunge beeinflusst, die zur Ausprägung von unterschiedlichen Phänotypen der COPD beitragen können. Patienten werden demnach nach bestimmten Kriterien eingeteilt – zum Beispiel danach, ob sie häufige Exazerbationen haben, eine Hyperinflammation aufweisen oder zum pulmonal-vaskulären Phänotyp zählen. Aktuell wird versucht, über die LABA/LAMA/ICS-Therapie hinaus jeden dieser Patienten individuell – mit Rücksicht auf den Phäno- und wenn möglich den Endotyp – zu behandeln.17
Im Fokus der Forschung steht zurzeit einerseits die Behandlung der Inflammation: Es wurde zwar mehrfach versucht, mit monoklonalen Antikörpern gegen Entzündungsmediatoren vorzugehen, leider jedoch wenig erfolgreich. Um die Forschung diesbezüglich zu optimieren, orientiert sich die Wissenschaft nun verstärkt an den Ansätzen aus der Asthmatherapie, bei der die Phänotypisierung weiter fortgeschritten ist. Ein aktueller Ansatz konzentriert sich z.B. auf die Hemmung der globalen Inflammation durch IL-33.18 Ein anderer Schwerpunkt der Grundlagenforschung fokussiert auf die Inhibierung von Lymphotoxin-β-Rezeptoren (LTβR), die in Immunzellen bei COPD erhöht sind.19
Andererseits versucht man, weiteren zentralen Pathomechanismen der COPD wie dem oxidativen Stress entgegenzuwirken, aber auch an „drug repurposing“ wird derzeit geforscht.17
Es bleibt also spannend, aber eines ist gewiss – hier wird sich in den kommenden 20 Jahren noch einiges tun.
Literatur:
1 WHO: Chronic obstructive pulmonary disease (COPD) 2022. https://www.who.int/news-room/fact-sheets/detail/chronic-obstructive-pulmonary-disease-(copd) ; zuletzt aufgerufen am 16.9.2022 2 Petty TL: The history of COPD. Int J COPD 2006; 1(1):3-14 3 Badham C: An essay on bronchitis: with a supplement containing remarks on simple pulmonary abscess. . 2nd ed. London: J Callow 18144 Hutchinson J: On the capacity of the lungs, and on the respiratory functions, with a view of establishing a precise and easy method of detecting disease by the spirometer. Medico-Chirurgical Transactions (London) 1846; 29: 137-61 5 Tiffeneau R, Pinelli AF: Air circulant et air captif dans l’exploration de la function ventilatrice pulmonaire. Paris Med 1947; 133: 624-8 6 Gaensler EA: Air velocity index; a numerical expression of the function- ally effective portion of ventilation. Am Rev Tuberc 1950; 62: 17-28 7 Gaensler EA: Analysis of the ventilatory defect by timed capacity measurements. Am Rev Tuberc 1951; 64: 256-78 8 Petty TL, Silvers GW, Stanford RE et al.:Small airway pathology is related to increased closing capacity and abnormal slope of phase III in excised human lungs. Am Rev Respir Dis1980; 121:449-56 9 Petty TL, Silvers GW, Stanford RE:Small airway disease is associated with elastic recoil changes in excised human lungs. Am Rev Respir Dis1984; 130:42-5 10 Petty TL, Silvers GW, Stanford RE:Mild emphysema is associated with reduced elastic recoil and increased lung size, but not with airflow obstruction. Am Rev Respir Dis1987; 136:867-71 11 Fletcher G, Peto R, Tinker C et al:The natural history of chronic bronchitis and emphysema. New York: Oxford Pr 1976 12 Peto R, Speizer FE, Cochrane AL et al.:The relevance in adults of airflow obstruction, but not of mucus hypersecretion to mortality from chronic lung disease. Am Rev Respir Dis1983; 128:491-500 13 Burrows B, Knudson RJ, Camilli AE et al.:The “horse-racing effect” and predicting decline in the forced expiratory volume in one second from screening spirometry. Am Rev Respir Dis1987; 135: 788-93 14 Noehren TH: Pulmonary emphysema, improved outlook in the man- agement of patients. JAMA1962; 182:889 15 Rodriguez-Roisin R: Twenty years of GOLD (1997-2017). The origins. 2019. https://goldcopd.org/wp-content/uploads/2019/03/GOLD-Origins-Final-Version-mar19.pdf ; zuletzt aufgerufen am 16.9.2022 16 2022 GOLD Report 2022. https://goldcopd.org/2022-gold-reports-2/ ; zuletzt aufgerufen am 16.9.2022 17 Sommer N: Neue Therapiestrategien der COPD aus der Grundlagenforschung. Vortrag im Rahmen des 62. Kongresses der DGP am 28.5.2022, Leipzig 18 Rabe KF et al.: Lancet Med 2021; 9(11): 1288-98 19 Conlon TM et al.: Nature 2020; 588 (7836):151-6
Das könnte Sie auch interessieren:
Wenig genützte Chance: COPD-Therapie abseits der Medikamente
Neben der medikamentösen Behandlung spielen im Management der COPD nicht-medikamentöse Maßnahmen eine wichtige Rolle. Dies betrifft vor allem die pulmonale Rehabilitation, die ...
Gewebeschädigung: Proteasen bahnen der Allergie den Weg
Warum entwickeln manche Menschen Allergien und andere nicht? Viele Aspekte dieser Frage sind nach wie vor ungeklärt. Auf der klinischen Seite zeigt sich zunehmend, dass die Behandlung ...