BIA-ALCL: wo melden?
Autoren:
Dr. Andrzej Hecker, MSc
Univ.-Prof. Dr. Stephan Spendel
Univ.-Prof. Dr. Lars-Peter Kamolz, MSc
Assoz. Prof. PD Dr. David Benjamin Lumenta
Research Unit Digital Surgery, Klinische Abteilung für Plastische, Ästhetische und Rekonstruktive Chirurgie, Universitätsklinik für Chirurgie, Medizinische Universität Graz
korrespondierender Autor:
Assoz. Prof. PD Dr. David Benjamin Lumenta
E-Mail: david.lumenta@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Brustimplantat-assoziierte anaplastische großzellige Lymphom (BIA-ALCL) ist ein seltenes T-Zell-Non-Hodgkin-Lymphom. Dennoch ist zu befürchten, dass die niedrigen Fallzahlen nicht die Realität widerspiegeln, da bislang keine geeigneten Melderegister angeboten werden. Der folgende Beitrag gibt eine Übersicht über Meldungsformen und beinhaltet eine mögliche Lösung für die Realisierung einer nationalen Meldestrategie für das BIA-ALCL in Österreich.
Das Brustimplantat-assoziierte anaplastische großzellige Lymphom (BIA-ALCL) ist ein seltenes T-Zell-Non-Hodgkin-Lymphom, welches in der unmittelbaren Umgebung von Brustimplantaten entstehen kann.1 Bis Jänner 2020 hat die Food and Drug Administration (FDA) weltweit über 733 BIA-ALCL-Fälle registriert.2 Bei der extrem niedrigen Inzidenzrate des BIA-ALCL sind die genaue Ätiologie und Pathogenese noch ungeklärt und die Erkrankung scheint mit genetischer Prädisposition, subklinischer Infektion und Implantatoberfläche einherzugehen.1 Die Assoziation zu vor allem in Europa verwendeten texturierten Implantaten hat bereits die Anzahl der Hersteller von Brustimplantaten verändert.3 Der FDA sind 36 Todesfälle (Stand: Jänner 2020) durch BIA-ALCL weltweit bekannt2 und in Österreich sind bisher 5 BIA-ALCL-Fälle gemeldet. Die niedrigen Fallzahlen hängen am ehesten mit einem „underreporting“ zusammen, sind auf das Fehlen von geeigneten Melderegistern zurückzuführen und daher weder national noch international sicher abschätzbar. Neben der behördlich verpflichtenden Meldung nach Medizinproduktegesetz (§70 ff. MPG, BGBl. 657/1996 idgF.) von medizinproduktbezogenen Vorkommnissen an das Bundesamt für Sicherheit im Gesundheitswesen (BASG), Institut für Überwachung, gibt es für in Österreich tätige Ärztinnen und Ärzte aktuell keine weitere Meldepflicht für BIA-ALCL.
Krankheitsregister
Mithilfe eines klinischen Melderegisters („Krankheitsregister“) werden patientenbezogene medizinische Daten zu einem klar definierten medizinischen Themenbereich (z.B. „Krebsregister“) gesammelt. Krankheitsregister erfassen, wie eine Erkrankung auftritt, verläuft und welche Auswirkungen Therapieoptionen haben.4 Ein Beispiel ist das auf einer gesetzlichen Grundlage (Krebsstatistikgesetz 1969, Krebsstatistikverordnung 1978) beruhende Österreichische Krebsregister, welches auf den jeweiligen Landeskrebsregistergesetzen basiert. Nicht gesetzlich geregelte Register werden häufig von medizinischen Fachgremien oder auch privatwirtschaftlich gegründeten Institutionen betrieben. Für das seltene Krankheitsbild BIA-ALCL existiert in den Vereinigten Staaten die PROFILE-Datenbank („Patient Registry and Outcomes For breast Implants and anaplastic large cell Lymphoma etiology and Epidemiology“, https://www.thepsf.org/research/registries/profile ). Innerhalb der PROFILE-Datenbank werden patientenbezogene und BIA-ALCL-spezifische, klinische Basisdaten erhoben. Bis 2020 konnten laut Angaben der American Society of Plastic Surgeons knapp 520 Fälle von weltweit 733 Fällen aus 25 Ländern in der PROFILE-Datenbank registriert werden.5
Medizinprodukteregister
Implantatregister (Medizinprodukteregister) erfassen die implantierten bzw. verwendeteten Medizinprodukte in/an Patienten.4 Die verpflichtende, behördliche Meldung von Fehlfunktionen, Qualitätsmängeln und Nebenwirkungen von Medizinprodukten gemäß §70 (1) MPG erfolgt zum einen durch medizinisches Personal, zum anderen über die Hersteller selbst. Die Meldung für das medizinische Personal kann elektronisch per E-Mail ( medizinprodukte@basg.gv.at ) anhand einer Meldekarte (abrufbar über https://www.basg.gv.at/marktbeobachtung/meldewesen/medizinprodukte unter „Formular: Vorkommnis melden Ärzte“) oder direkt über ein Online-Vorkommnis-Meldeformular ( https://aforms.ages.at/medizinproduktvorfall/start.do?generalid=medizinproduktvigilanz# ) an das BASG in Österreich erfolgen. An das BASG in Österreich werden ausschließlich Medizinprodukt- (Serien- und Chargennummer, Qualitätsmängel, Fehlfunktionen des Medizinprodukts), Hersteller- (Hersteller und Händler mit Adresse) sowie vereinzelte Patienteninformationen (Patientenalter, Patientenstatus, Auswirkungen des Vorkommnisses) übermittelt. Hersteller melden medizinproduktbezogene Fehlfunktionen, Qualitätsmängel und Nebenwirkungen, die mit patientenbezogenen schwerwiegenden Vorkommnissen direkt oder indirekt in Verbindung gebracht werden. Die Meldung über die Hersteller erfolgt über ein eigenes Meldeformular. Hierbei werden administrative Informationen, Medizinproduktinformationen, Informationen über die medizinproduktbezogenen Vorkommnisse sowie eine analytische Stellungnahme der Hersteller in Bezug auf die gemeldeten medizinproduktbezogenen Vorkommnisse erfasst.
Jeder Hersteller von Medizinprodukten, der seinen Sitz in einem Mitgliedsland der Europäischen Union hat, muss das von ihm in Verkehr gebrachte Medizinprodukt im jeweiligen Mitgliedsstaat registrieren lassen. Dies geschieht in Österreich unbürokratisch über die Homepage „Österreichisches Register für Medizinprodukte“ ( www.medizinprodukteregister.at ). Die Hersteller bekommen nach erfolgter Registrierung eine UDI-Nummer (Unique Device Identification) zugewiesen. Die UDI-Nummer stellt für die Europäische Datenbank für Medizinprodukte (EUDAMED) ein wichtiges Identifikationsmerkmal dar, da jene medizinproduktbezogene Identifikationsnummer bei Zertifikaten der Europaprüfstellen und bei meldepflichtigen, medizinproduktbezogenen Vorkommnissen angegeben werden muss. In der EUDAMED werden zukünftig Daten über Hersteller (Herstellerkennung, Adresse), Medizinprodukt (Produkt-Code, Produktbezeichnung, Risikoklasse, UDI), Medizinproduktbescheinigungen, medizinproduktbezogene Vorkommnisse (Untersuchungen, Hintergrundinformationen zum Vorkommnis, Maßnahmenbeschreibungen, Empfehlungen) sowie klinische Prüfungen des Medizinprodukts erfasst. Die genannte Meldeform für Medizinprodukte erfasst somit keine klinischen Daten, was bei der Ausarbeitung des seltenen BIA-ALCL allerdings erforderlich wäre.6
Kombination Krankheits- und Medizinprodukteregister
Die Bezeichnung der Erkrankung BIA-ALCL beinhaltet definitionsgemäß und anatomisch einen unmittelbaren Zusammenhang zwischen Implantat und Lymphomerkrankung.1,7–9 Das seltene und späte Auftreten (im Durchschnitt nach 8 Jahren)9 führte erst 2016 zur Klassifikation bei der Weltgesundheitsorganisation (WHO) als lymphatische Neoplasie.10 Der medizinproduktbezogene Zusammenhang ist bei BIA-ALCL besonders und kann daher bei der Datenerhebung als Chance genutzt werden, wobei eine Mehrfachdokumentation (Redundanz) für uns Kliniker vermieden werden sollte, wenngleich die Fallzahl überschaubar ist. Bisher existiert allerdings kein europäisches Register, welches beide Informationsmodalitäten miteinander verbindet.
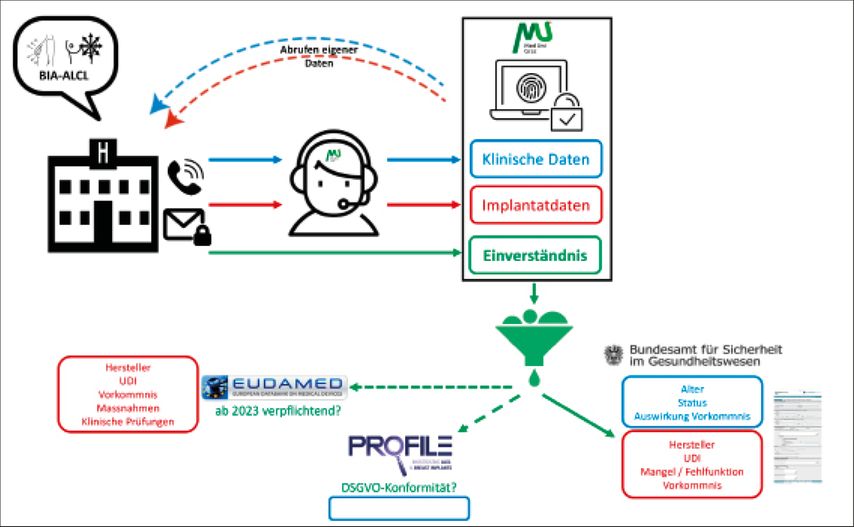
Telefoninterviewmodell: Fallaufbereitung, Datenadministration und Weitermeldung
Die aktuellen national empfohlenen Behandlungspfade („standard operating procedure“, SOP) wurden zuletzt 2020 österreichweit publiziert.11 An unserem Referenzzentrum (LKH-Univ.-Klinikum Graz) wurde des Weiteren eine DSGVO-konforme modulare BIA-ALCL-Datenbank an der Medizinischen Universität Graz (vorhandenes positives Ethikkommissionsvotum EK 32–350 ex 19/20) aufgebaut, die implantatbezogene und klinische Daten dokumentiert. Um der Fallkomplexität bei BIA-ALCL gerecht zu werden und die Datenerhebung für klinisch tätige Kollegen zu vereinfachen, bieten wir zukünftig nach informeller Meldung per E-Mail (Stichwort: BIA-ALCL, E-Mail: plastischechirurgie@medunigraz.at) ein Telefon-Interviewmodell mit ärztlichem Personal in Kombination mit weiterer Möglichkeit der sicheren DSGVO-konformen elektronischen Befundübermittlung an (Abb. 1). Bei vorhandener schriftlicher Einwilligung durch die meldende Klinik kann ebenfalls eine ausschließliche Übermittlung nur der gesetzlich vorgeschriebenen Informationen an das BASG, Meldung nach Medizinproduktegesetz (§70 ff. MPG, BGBl. 657/1996 idgF.) im Anschluss, erfolgen (keine Mehrfacheingaben für meldende Klinik). Weitere Verbindungsstellen zu anderen Datenbanken ermöglichen zukünftig bei vorhandenem Einverständnis der meldenden Klinik und entsprechender DSGVO-Konformität die Übermittlung ohne Doppeldokumentation. Mithilfe dieses Telefoninterviewmodells könnten zukünftig die wenigen BIA-ALCL-Fälle für klinisch tätige Kollegen flexibel aufgearbeitet werden und als nationales Vorbild für eine Kombination aus Krankheits-/Medizinprodukteregister für europäische Kooperationspartner dienen.
Für das vorgeschlagene Administrationsmodell existiert bereits an der Medizinischen Universität Graz eine DSGVO-konforme modulare Datenbank (EK Votum vorhanden), die sowohl klinische als auch Implantatdaten erfasst. Die Meldung erfolgt mittels Telefoninterview nach informeller Bekanntgabe per E-Mail (Stichwort: BIA-ALCL, E-Mail: plastischechirurgie@medunigraz.at). Die meldende Klinik kann eigene Daten abrufen. Eine Weitergabe zur Vereinfachung einer Doppeladministration erfolgt nur bei jeweils vorliegendem schriftlichem Einverständnis der meldenden Klinik und es werden ausschließlich die für die jeweiligen Behörden/Melderegister erforderlichen Daten extrahiert.
Literatur:
1 Clemens MW et al.: Finding consensus after two decades of breast implant-associated anaplastic large cell lymphoma. Semin Plast Surg 2019; 17; 33(04): 270-8 2 U.S. Food and Drug Administration: Medical device reports of breast implant-associated anaplastic large cell lymphoma | FDA [Internet]. Vol. January, Medical Device Reports of Breast Implant-Associated Anaplastic Large Cell Lymphoma. 2020 [cited 2020 Oct 10]. Available from: https://www.fda.gov/medical-devices/breast-implants/medical-device-reports-breast-implant-associated-anaplastic-large-cell-lymphoma 3 U.S. Food and Drug Administration: The FDA requests Allergan voluntarily recall natrelle biocell textured breast implants and tissue expanders from the market to protect patients: FDA safety communication 2020 4 Sund R et al.: Use of Health Registers. In: Handbook of Epidemiology [Internet]. New York, NY: Springer New York; 2014. p. 707-30. Available from: http://link.springer.com/10.1007/978-0-387-09834-0_5 5 McCarthy CM et al.: Patient registry and outcomes for breast implants and anaplastic large cell lymphoma etiology and epidemiology (PROFILE): initial report of findings, 2012-2018. Plast Reconstr Surg 2019; 143(3S A Review of Breast Implant-Associated Anaplastic Large Cell Lymphoma): 65S-73S 6 European Commission: Medical Devices - EUDAMED 7 Roden AC et al.: Seroma-associated primary anaplastic large-cell lymphoma adjacent to breast implants: an indolent T-cell lymphoproliferative disorder. Mod Pathol 2008; 21(4): 455-63 8 Ebner PJ et al.: Breast implant-associated anaplastic large cell lymphoma, a systematic review and in-depth evaluation of the current understanding. J Surg Oncol 2019; 120(4): 573-7 9 DeCoster RC et al.: Breast implant-associated anaplastic large cell lymphoma. Ann Surg 2021; 273(3): 449-58 10 Swerdlow SH et al.: The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016; 19; 127(20): 2375-90 11 Flores T et al.: BIA-ALCL – was tun bei Verdacht? Jatros Dermatologie & Plastische Chirurgie 2020; 1: 26-9
Das könnte Sie auch interessieren:
Aktuelle Versorgungssituation von trans Männern
Die Versorgung von trans Personen ist in Österreich auf wenige Kliniken und Fachabteilungen beschränkt. Noch immer bestehen Ressentiments und die Patientengruppe wird in ...
Funktionell-ästhetische Nagelchirurgie
Die Entwicklung der Nagelchirurgie ist im Vergleich zu anderen chirurgischen Disziplinen noch wenig weit fortgeschritten. Dennoch stehen verschiedene Methoden sowohl zur Diagnosestellung ...
Jugendlich statt „schön“ um jeden Preis
Die ästhetische Medizin hat sich aus den Möglichkeiten der Medizin und den Wünschen der Menschen entwickelt. Die angebotenen Behandlungen haben eine Sonderstellung, denn viele davon sind ...